Agentes de unión a esclerostina.
Un anticuerpo de unión a esclerostina que comprende las siguientes secuencias de CDR:
CDR-H1: DYNMH (SEC ID Nº: 245);
CDR-H2: EINPNSGGAGYNQKFKG (SEC ID Nº: 246);
CDR-H3: LGYDDIYDDWYFDV (SEC ID Nº: 247);
CDR-L1: RASQDISNYLN (SEC ID Nº: 78);
CDR-L2: YTSRLLS (SEC ID Nº: 79); y
CDR-L3: QQGDTLPYT (SEC ID Nº: 80).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/016441.
Solicitante: AMGEN INC..
Inventor/es: LU, HSIENG, SEN, LATHAM,John, PASZTY,CHRISTOPHER, ROBINSON,MARTYN KIM, GRAHAM,KEVIN, HENRY,ALISTAIR JAMES, HOFFMANN,KELLY SUE, LAWSON,ALASTAIR, POPPLEWELL,ANDY, SHEN,WENYAN, WINKLER,DAVID, WINTERS,AARON GEORGE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/51 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor morfogénico óseo; Osteogenina; Factor osteogénico; Factor óseoinductor.
- C07K16/18 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
PDF original: ES-2412857_T3.pdf
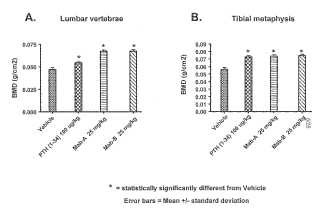
Fragmento de la descripción:
Agentes de unión a esclerostina.
Campo técnico La presente invención se refiere en general a anticuerpos capaces de unirse a esclerostina.
Antecedentes de la invención Durante la vida de un individuo suceden dos o tres fases de cambios distintas en la masa ósea (véase Riggs, West
J. Med. 154: 63-77 (1991) ) . La primera fase se produce tanto en hombres como en mujeres y continúa hasta la consecución de una masa de hueso máxima. Esta primera fase se consigue mediante crecimiento lineal de las placas de crecimiento endocondriales y crecimiento radial debido a una tasa de aposición perióstea. La segunda 15 fase comienza aproximadamente a los 30 años para el hueso trabecular (huesos planos tales como las vértebras y la pelvis) y aproximadamente a los 40 años para hueso cortical (por ejemplo, huesos largos hallados en las extremidades) y continúa hasta la vejez. Esta fase se caracteriza por pérdida de hueso lenta y se produce tanto en hombres como en mujeres. En mujeres, también se produce una tercera fase de pérdida de hueso, más probablemente debido a deficiencias de estrógenos posmenopáusicas. Durante esta fase solamente, las mujeres pueden perder una masa de hueso adicional del hueso cortical y del compartimento trabecular (véase, Riggs, mencionado anteriormente) .
La pérdida de contenido mineral óseo puede estar provocada por una amplia diversidad de afecciones y puede dar como resultado problemas médicos significativos. Por ejemplo, la osteoporosis es una enfermedad debilitante en 25 seres humanos y está caracterizada por reducciones notables de la masa ósea esquelética y densidad mineral, deterioro estructural del hueso, incluyendo degradación de la microarquitectura del hueso y aumentos correspondientes de la fragilidad ósea (es decir, reducciones de la fuerza ósea) , y susceptibilidad a fractura en individuos aquejados. La osteoporosis en seres humanos está generalmente precedida de osteopenia clínica (densidad mineral ósea que es mayor de una desviación típica pero menor de 2, 5 desviaciones típicas por debajo 30 del valor medio para hueso adulto joven) , una afección hallada en aproximadamente 25 millones de personas en los Estados Unidos. Se ha diagnosticado a otros 7-8 millones de pacientes en Estados Unidos con osteoporosis clínica (definida como contenido mineral óseo mayor de 2, 5 desviaciones típicas por debajo de la del hueso de adulto joven maduro) . La frecuencia de osteoporosis en la población humana aumenta con la edad. Entre los caucásicos, la osteoporosis es predominante en mujeres quienes, en los Estados Unidos, comprenden el 80% del grupo de pacientes con osteoporosis. La fragilidad aumentada y susceptibilidad a fractura del hueso esquelético en los ancianos está agravada por el mayor riesgo de caídas accidentales en esta población. Las fracturas de caderas, muñecas y vértebras están entre las lesiones más habituales asociadas con la osteoporosis. Las fracturas de cadera en particular son extremadamente incómodas y caras para el paciente, y para las mujeres se correlacionan con altas tasas de mortalidad y morbilidad.
Aunque la osteoporosis se ha considerado como un aumento en el riesgo de fractura debido a la reducción de la masa ósea, pocos de los tratamientos actualmente disponibles para trastornos esqueléticos pueden aumentar la densidad ósea de los adultos, y la mayoría de los tratamientos disponibles en la actualidad actúa principalmente inhibiendo adicionalmente la resorción del hueso en lugar de estimular nueva formación de hueso. El estrógeno se 45 está prescribiendo ahora para retardar la pérdida de hueso. Sin embargo, existe cierta controversia sobre si los pacientes obtienen algún beneficio a largo plazo y si el estrógeno tiene algún efecto en pacientes de más 75 años de edad. Además, se cree que el uso de estrógenos aumenta el riesgo de cáncer de mama y endometrio. También se ha sugerido calcitonina, osteocalcina con vitamina K o altas dosis de calcio dietético, con o sin vitamina D, para mujeres posmenopáusicas. Las altas dosis de calcio, sin embargo, tienen con frecuencia efectos secundarios 50 gastrointestinales no deseados, y los niveles de calcio en suero y orina deben supervisarse continuamente (por ejemplo, Khosla y Riggs, Mayo Clin. Proc. 70: 978982, 1995) .
Otros enfoques terapéuticos actuales para la osteoporosis incluyen bifosfonatos (por ejemplo, Fosamax™, Actonel™, Bonviva™, Zometa™, olpadronato, neridronato, skelid, bonefos) , hormona paratiroidea, calcilíticos,
calcimiméticos (por ejemplo, cinacalcet) , estatinas, esteroides anabólicos, sales de lantano y estroncio y fluoruro sódico. Dichos compuestos terapéuticos, sin embargo, se asocian con frecuencia con efectos secundarios indeseables (véase Khosla y Riggs, mencionado anteriormente) .
La esclerostina, el producto del gen SOST, está ausente en esclerosteosis, una enfermedad esquelética 60 caracterizada por sobrecrecimiento del hueso y huesos densos fuertes (Brunkow et al., Am. J. Hum. Genet., 68: 577589, 2001; Balemans et al., Hum. Mol. Genet., 10: 537-543, 2001) . La secuencia de aminoácidos de la esclerostina humana se ha presentado en Brunkow et al. en la referencia anterior y se divulga en el presente documento como SEC ID Nº: 1.
Breve sumario de la invención Se divulgan en el presente documento composiciones y métodos que pueden usarse para aumentar al menos uno de formación de hueso, densidad mineral ósea, contenido mineral óseo, masa ósea, calidad ósea y fuerza ósea, y
que puede por lo tanto usarse para tratar una amplia diversidad de afecciones en las que sea deseable un aumento de al menos uno de formación del hueso, densidad mineral ósea, contenido mineral óseo, masa ósea, calidad ósea y fuerza ósea. La presente invención también ofrece otras ventajas relacionadas descritas en el presente documento.
La invención se refiere a anticuerpos, que se unen específicamente a esclerostina. Los anticuerpos comprenden las siguientes secuencias de CDR: CDR-H1 DYNMH (SEC ID Nº: 245) ; CDR-H2 EINPNSGGAGYNQKFKG (SEC ID Nº: 246) ; CDR-H3 LGYDDIYDDWYFDV (SEC ID Nº: 247) ; CDR-L1 RASQDISNYLN (SEC ID Nº: 78) ; CDR-L2 YTSRLLS (SEC ID Nº: 79) ; y CDR-L3 QQGDTLPYT (SEC ID Nº: 80) . Los anticuerpos pueden caracterizarse por su capacidad para bloquear de forma cruzada la unión de al menos un anticuerpo divulgado en el presente documento con esclerostina y/o para bloquearse de forma cruzada de la unión con esclerostina por al menos un anticuerpo divulgado en el presente documento. Los anticuerpos también pueden caracterizarse por su patrón de unión con péptidos de esclerostina humana en un “ensayo de unión competitiva de epítopos peptídico de esclerostina humana” como se divulga en el presente documento.
La invención se refiere a anticuerpos, que pueden aumentar al menos uno de formación del hueso, densidad mineral ósea, contenido mineral óseo, masa ósea, calidad ósea y fuerza ósea en un mamífero.
La invención se refiere a anticuerpos que pueden bloquear el efecto inhibidor de esclerostina en un ensayo de mineralización basado en células.
La divulgación también se refiere a una parte inmunogénica de esclerostina humana que comprende los aminoácidos 86-111 de SEC ID Nº: 1; la parte inmunogénica puede consistir esencialmente en los aminoácidos contiguos CGPARLLPNAIGRGKWWRPSGPDFRC (SEC ID Nº: 6) .
La divulgación se refiere además a una parte inmunogénica de esclerostina de rata, que comprende los aminoácidos 92-109 de SEC ID Nº: 98; la parte inmunogénica puede consistir esencialmente en los aminoácidos contiguos PNAIGRVKWWRPNGPDFR (SEC ID Nº: 96) . La divulgación se refiere además a una parte inmunogénica de esclerostina de rata, que comprende los aminoácidos 99-120 de SEC ID Nº: 98; la parte inmunogénica puede consistir esencialmente en los aminoácidos contiguos KWWRPNGPDFRCIPDRYRAQRV (SEC ID Nº: 97) .
La divulgación se refiere además a un anticuerpo aislado que bloquea de forma cruzada la unión de al menos uno de los anticuerpos 1-24 (Ab-1 a Ab-24) con una proteína de esclerostina. El agente de unión a esclerostina también puede bloquearse de forma cruzada de la unión con esclerostina por al menos uno de los anticuerpos 1-24 (Ab-1 a Ab-24) . El anticuerpo aislado, o fragmento de unión a antígeno del mismo, puede ser un anticuerpo policlonal, un anticuerpo monoclonal, un anticuerpo humanizado, un anticuerpo humano o un anticuerpo quimérico.
La divulgación también se refiere a un anticuerpo aislado que está bloqueado de forma cruzada de la unión con esclerostina por al menos uno de los anticuerpos 1-24 (Ab-1 a Ab-24) ; el anticuerpo aislado o un fragmento de unión a antígeno del mismo, puede... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo de unión a esclerostina que comprende las siguientes secuencias de CDR:
CDR-H1: DYNMH (SEC ID Nº: 245) ; CDR-H2: EINPNSGGAGYNQKFKG (SEC ID Nº: 246) ; CDR-H3: LGYDDIYDDWYFDV (SEC ID Nº: 247) ; CDR-L1: RASQDISNYLN (SEC ID Nº: 78) ; CDR-L2: YTSRLLS (SEC ID Nº: 79) ; y CDR-L3: QQGDTLPYT (SEC ID Nº: 80) .
2. El anticuerpo de unión a esclerostina de la reivindicación 1 que comprende una cadena pesada que comprende una secuencia polipeptídica que tiene al menos 85% de identidad con la secuencia de SEC ID Nº: 378.
3. El anticuerpo de unión a esclerostina de la reivindicación 1 o 2 que comprende una cadena ligera que comprende una secuencia polipeptídica que tiene al menos 85% de identidad con la secuencia de SEC ID Nº: 376.
4. El anticuerpo de unión a esclerostina de una de cualquiera de las reivindicaciones 1 a 3 que comprende tanto una cadena pesada que comprende una secuencia polipeptídica que tiene al menos 85% de identidad con la secuencia de SEC ID Nº: 378 como una cadena ligera que comprende una secuencia polipeptídica que tiene al menos 85% de identidad con la secuencia de SEC ID Nº: 376.
5. El anticuerpo de unión a esclerostina de una de cualquiera de las reivindicaciones 1 a 4, que comprende una región constante de cadena ligera y/o cadena pesada.
6. El anticuerpo de unión a esclerostina de la reivindicación 5, que es un IgG.
7. El anticuerpo de unión a esclerostina de la reivindicación 5, que comprende la región constante de IgG4 humano o IgG2 humano.
8. El anticuerpo de unión a esclerostina de la reivindicación 1, que tiene las cadenas pesadas de SEC ID Nº: 137 y cadenas ligeras de SEC ID Nº: 133.
9. El anticuerpo de unión a esclerostina de la reivindicación 1, que tiene las cadenas pesadas de SEC ID Nº: 145 o 392 y cadenas ligeras de SEC ID Nº: 141.
10. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones 1 a 4, donde dicho anticuerpo es un fragmento de anticuerpo de unión a esclerostina que comprende las seis CDR expuestas en la reivindicación 1.
11. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones 1 a 9, que es un anticuerpo completo.
12. El anticuerpo de unión a esclerostina de la reivindicación 10, donde dicho anticuerpo es un fragmento F (ab’) 2, Fab, Fab’ o Fv.
13. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones 1 a 7, que es un anticuerpo humanizado o un anticuerpo quimérico.
14. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones precedentes, donde dicho anticuerpo tiene una constante de disociación para esclerostina humana como se mide por resonancia de plasmón superficial de menos de o igual a 1 x 10-9 M, menos de o igual a 1 x 10-10 M, menos de o igual a 1 x 10-11 M o menos de o igual a 1 x 1012 M.
15. Un anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones precedentes al que están unidas una o más moléculas efectoras o indicadoras.
16. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones precedentes, donde dicho anticuerpo puede aumentar al menos uno de formación de hueso, densidad mineral ósea, contenido mineral óseo, masa ósea, calidad ósea y fuerza ósea en un mamífero.
17. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones precedentes, donde dicho anticuerpo puede bloquear el efecto inhibidor de esclerostina en un ensayo de mineralización basado en células.
18. Una secuencia polinucleotídica aislada que codifica el anticuerpo de unión a esclerostina de acuerdo con una cualquiera de las reivindicaciones 1 a 17.
19. Un vector de expresión o clonación que comprende una o más secuencias polinucleotídicas de acuerdo con la reivindicación 18.
20. El vector de la reivindicación 19, donde el vector comprende al menos una secuencia proporcionada en SEC ID Nº: 134, 136, 138, 140, 142, 144, 146, 148 y 379.
21. Una célula hospedadora que comprende uno o más vectores de expresión o clonación de acuerdo con la reivindicación 19 o reivindicación 20.
22. Un proceso para la producción del anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones 1 a 17, que comprende cultivar la célula hospedadora de la reivindicación 21 y aislar el anticuerpo de unión a esclerostina.
23. Una composición farmacéutica que comprende un anticuerpo de unión a esclerostina de acuerdo con una cualquiera de las reivindicaciones 1 a 17 en combinación con uno o más de un excipiente, diluyente y vehículo farmacéuticamente aceptable.
24. La composición farmacéutica de la reivindicación 23, que comprende adicionalmente otros principios activos.
25. El anticuerpo de unión a esclerostina de una cualquiera de las reivindicaciones 1 a 17 o la composición farmacéutica de la reivindicación 23 o reivindicación 24, para su uso en el método de tratamiento de un trastorno ósea asociado con al menos uno de baja formación de hueso, baja densidad mineral ósea, bajo contenido mineral óseo, baja masa ósea, baja calidad ósea y baja fuerza ósea en un sujeto mamífero, comprendiendo dicho método proporcionar a un sujeto que necesite dicho tratamiento una cantidad de dicho anticuerpo suficiente para aumentar al menos uno de formación de hueso, densidad mineral ósea, contenido mineral óseo, masa ósea, calidad ósea y fuerza ósea.
26. El anticuerpo o composición farmacéutica de acuerdo con la reivindicación 25 para dicho uso, donde el trastorno ósea es osteopenia, osteoporosis, pérdida de hueso o crecimiento o desarrollo anómalo de hueso provocado por al menos uno de acondroplasia, disostosis cleidocraneal, encondromatosis, displasia fibrosa, Enfermedad de Gaucher, raquitismo hipofosfatémico, síndrome de Marfan, exotosis hereditarias múltiples, neurofibromatosis, osteogénesis imperfecta, osteopoiquilosis, lesiones escleróticas, pseudoartrosis, osteomielitis piógena, enfermedad periodontal, pérdida de hueso inducida por fármaco anti-epiléptico, hiperparatiroidismo primario y secundario, síndromes de hiperparatiroidismo familiar, pérdida de hueso inducida por ingravidez, osteoporosis en hombres, pérdida de hueso posmenopáusica, osteoartritis, osteodistrofia renal, trastornos infiltrativos del hueso, pérdida de hueso oral, osteonecrosis de la mandíbula, enfermedad de Paget juvenil, melorreostosis, enfermedades óseas metabólicas, mastocitosis, enfermedad/anemia falciforme, pérdida de hueso relacionada con trasplante de órganos, pérdida de hueso relacionada con trasplante de riñón, lupus eritematoso sistémico, espondilitis anquilosante, epilepsia, artritis juveniles, talasemia, mucopolisacaridosis, enfermedad de Fabr y , síndrome de Turner, Síndrome de Down, Síndrome de Klinefelter, lepra, Enfermedad de Perthes, escoliosis idiopática adolescente, enfermedad inflamatoria multisistémica de aparición infantil, Síndrome de Winchester, Enfermedad de Menkes, Enfermedad de Wilson, enfermedad de hueso isquémica (tal como enfermedad de Legg-Calve-Perthes, osteoporosis migratoria regional) , estados anémicos, afecciones provocadas por esteroides, pérdida de hueso inducida por glucocorticoides, pérdida de hueso inducida por heparina, trastornos de la médula ósea, escorbuto, malnutrición, deficiencia de calcio, alcoholismo, enfermedad hepática crónica, estado posmenopáusico, afecciones inflamatorias crónicas, artritis reumatoide, enfermedad inflamatoria del intestino, colitis ulcerosa, colitis inflamatoria, enfermedad de Crohn, oligomenorrea, amenorrea, embarazo, diabetes mellitus, hipertiroidismo, trastornos tiroideos, trastornos paratiroideos, enfermedad de Cushing, acromegalia, hipogonadismo, inmovilización o inactividad, síndrome de distrofia simpática refleja, osteoporosis regional, osteomalacia, pérdida de hueso asociada con reemplazo de articulaciones, pérdida de hueso asociada con VIH, pérdida de hueso asociada con pérdida de hormona del crecimiento, pérdida de hueso asociada con fibrosis quística, pérdida de hueso asociada con quimioterapia, pérdida de hueso inducida por tumor, pérdida de hueso relacionada con cáncer, pérdida de hueso ablativa hormonal, mieloma múltiple, pérdida de hueso inducida por fármaco, anorexia nerviosa, pérdida de hueso facial asociada con enfermedad, pérdida de hueso craneal asociada con enfermedad, pérdida de hueso de la mandíbula asociada con enfermedad, pérdida de hueso del cráneo asociada con enfermedad, pérdida de hueso asociada con el envejecimiento, pérdida de hueso facial asociada con el envejecimiento, pérdida de hueso craneal asociada con el envejecimiento, pérdida de hueso de la mandíbula asociada con el envejecimiento, pérdida de hueso del cráneo asociada con el envejecimiento y pérdida de hueso asociada con viaje espacial.
27. El anticuerpo o composición farmacéutica de la reivindicación 25 para dicho uso, donde el trastorno óseo es osteoporosis.
28. El anticuerpo de una cualquiera de las reivindicaciones 1 a 17 o la composición farmacéutica de la reivindicación 23 o 24, para su uso en un método para mejorar el resultado en un mamífero que se somete a uno o más de un procedimiento ortopédico, procedimiento dental, cirugía de implante, reemplazo de articulaciones, injerto de hueso, cirugía cosmética de hueso y reparación de hueso tal como curación de fracturas, curación sin unión, curación de
unión retardada y reconstrucción facial, comprendiendo dicho método administrar dicho anticuerpo o composición a dicho mamífero antes, durante y/o después de dicho procedimiento, reemplazo, injerto, cirugía o reparación.
29. Un kit de diagnóstico que comprende el anticuerpo de una cualquiera de las reivindicaciones 1 a 17.
30. Uso del anticuerpo de una cualquiera de las reivindicaciones 1 a 17 para la fabricación de un medicamento para el tratamiento de un trastorno óseo asociado con al menos de uno de formación de hueso baja, densidad mineral ósea baja, contenido mineral óseo bajo, masa ósea baja, calidad ósea baja y fuerza ósea baja en un sujeto mamífero.
31. El uso de la reivindicación 30, donde el trastorno óseo es osteopenia, osteoporosis, pérdida de hueso o crecimiento o desarrollo anómalo de hueso provocado por al menos uno de acondroplasia, disostosis cleidocraneal, encondromatosis, displasia fibrosa, Enfermedad de Gaucher, raquitismo hipofosfatémico, síndrome de Marfan, exotosis hereditarias múltiples, neurofibromatosis, osteogénesis imperfecta, osteopetrosis, osteopoiquilosis, lesiones escleróticas, pseudoartrosis, osteomielitis piógena, enfermedad periodontal, pérdida de hueso inducida por fármaco anti-epiléptico, hiperparatiroidismo primario y secundario, síndromes de hiperparatiroidismo familiar, pérdida de hueso inducida por ingravidez, osteoporosis en hombres, pérdida de hueso posmenopáusica, osteoartritis, osteodistrofia renal, trastornos infiltrativos del hueso, pérdida de hueso oral, osteonecrosis de la mandíbula, enfermedad de Paget juvenil, melorreostosis, enfermedades óseas metabólicas, mastocitosis, enfermedad/anemia falciforme, pérdida de hueso relacionada con trasplante de órganos, pérdida de hueso relacionada con trasplante de riñón, lupus eritematoso sistémico, espondilitis anquilosante, epilepsia, artritis juveniles, talasemia, mucopolisacaridosis, enfermedad de Fabr y , síndrome de Turner, Síndrome de Down, Síndrome de Klinefelter, lepra, Enfermedad de Perthes, escoliosis idiopática adolescente, enfermedad inflamatoria multisistémica de aparición infantil, Síndrome de Winchester, Enfermedad de Menkes, Enfermedad de Wilson, enfermedad de hueso isquémica (tal como enfermedad de Legg-Calve-Perthes, osteoporosis migratoria regional) , estados anémicos, afecciones provocadas por esteroides, pérdida de hueso inducida por glucocorticoides, pérdida de hueso inducida por heparina, trastornos de la médula ósea, escorbuto, malnutrición, deficiencia de calcio, alcoholismo, enfermedad hepática crónica, estado posmenopáusico, afecciones inflamatorias crónicas, artritis reumatoide, enfermedad inflamatoria del intestino, colitis ulcerosa, colitis inflamatoria, enfermedad de Crohn, oligomenorrea, amenorrea, embarazo, diabetes mellitus, hipertiroidismo, trastornos tiroideos, trastornos paratiroideos, enfermedad de Cushing, acromegalia, hipogonadismo, inmovilización o inactividad, síndrome de distrofia simpática refleja, osteoporosis regional, osteomalacia, pérdida de hueso asociada con reemplazo de articulaciones, pérdida de hueso asociada con VIH, pérdida de hueso asociada con pérdida de hormona del crecimiento, pérdida de hueso asociada con fibrosis quística, pérdida de hueso asociada con quimioterapia, pérdida de hueso inducida por tumor, pérdida de hueso relacionada con cáncer, pérdida de hueso ablativa hormonal, mieloma múltiple, pérdida de hueso inducida por fármaco, anorexia nerviosa, pérdida de hueso facial asociada con enfermedad, pérdida de hueso craneal asociada con enfermedad, pérdida de hueso de la mandíbula asociada con enfermedad, pérdida de hueso del cráneo asociada con enfermedad, pérdida de hueso asociada con el envejecimiento, pérdida de hueso facial asociada con el envejecimiento, pérdida de hueso craneal asociada con el envejecimiento, pérdida de hueso de la mandíbula asociada con el envejecimiento, pérdida de hueso del cráneo asociada con el envejecimiento y pérdida de hueso asociada con viaje espacial.
32. El uso de la reivindicación 30, donde el trastorno óseo es osteoporosis.
33. Uso del anticuerpo de una cualquiera de las reivindicaciones 1 a 17 para la fabricación de un medicamento para mejorar el resultado en un mamífero que se somete a uno o más de un procedimiento ortopédico, procedimiento dental, cirugía de implante, reemplazo de articulaciones, injerto de hueso, cirugía cosmética de hueso y reparación del hueso tales como curación de fracturas, curación sin unión, curación de unión retardada y reconstrucción facial, donde el medicamento es para administrar a dicho mamífero, antes, durante y/o después de dicho procedimiento, reemplazo, injerto, cirugía o reparación.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]