Procedimiento para la preparación de S-fluorometil-6,9-difluoro-11-hidroxi-16-metil-17-propioniloxi-3-oxo-androsta-1,4-dieno-17-carbotioato e intermedios.
Un procedimiento para preparar S-fluorometil-6α,9α
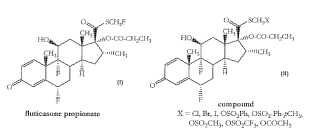
-difluoro-11ß-hidroxi-16α-metil-17α-propioniloxi-3-oxoandrosta-1,4-dieno-17ß-carbotioato I. **Fórmula**
que comprende usar fluoruros mixtos solubles para fluorar un compuesto.**Fórmula**
en la que X es un grupo saliente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2007/050328.
Solicitante: GENERICS UK LIMITED .
Nacionalidad solicitante: Reino Unido.
Dirección: ALBANY GATE DARKES LANE POTTERS BAR HERTFORDSHIRE EN6 REINO UNIDO.
Inventor/es: GORE,VINAYAK G, GADAKAR,MAHESH, POKHARKAR,K, WAKCHURE,V.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/56 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que contienen el sistema cíclico del ciclopenta[a]hidrofenantreno; Sus derivados, p. ej. esteroides.
- A61P5/44 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 5/00 Medicamentos para el tratamiento de trastornos del sistema endocrino. › Glucocorticoides; Medicamentos para aumentar o potenciar la actividad de los glucocorticoides.
- C07J31/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen uno o más átomos de azufre que no pertenecen a un heterociclo.
PDF original: ES-2388307_T3.pdf
Fragmento de la descripción:
Procedimiento para la preparación de S-fluorometil-6, 9-difluoro-11-hidroxi-16-metil-17-propioniloxi-3-oxo-androsta1, 4-dieno-17-carbotioato e intermedios
Campo de la invención
La presente invención se refiere a un procedimiento para la preparación de tioatos 17º-carboxílicos esteroideos. Más particularmente la presente invención se refiere a una síntesis eficiente y conveniente de tioatos 17ºcarboxílicos esteroideos, tales como propionato de fluticasona I, usando fluoruros mixtos solubles para introducir flúor desplazando un grupo saliente apropiado X en compuestos II dando como resultado la fluoración selectiva y controlada. La presente invención se refiere también a intermedios II y a su preparación.
Antecedentes de la invención
El propionato de fluticasona I, químicamente conocido como S-fluorometil-6a, 9a-difluoro-11º-hidroxi-16a-metil-17apropioniloxi-3-oxo-androsta-1, 4-dieno-17º-carbotioato, es un miembro de la familia de corticosteroides de éster fluorometílico del ácido androstano 17º-tioico y un esteroide sintético de la familia de glucocorticoides. La hormona
natural, cortisol o hidrocortisona, es producida por las glándulas adrenales. Los esteroides glucocorticoides tienen potentes acciones antiinflamatorias. Cuando se usan como inhalador nasal o pulverización, la medicación va directamente a la mucosa interna de la nariz y muy poco se absorbe en el resto del cuerpo.
Se conocen en la técnica anterior procedimientos para la síntesis de propionato de fluticasona I, pero tienen varias dificultades asociadas . Por ejemplo, el procedimiento descrito en la patente de EE.UU. US 4335121, y la patente del
RU GB 2088877, una patente de producto asignada a Glaxo, comienza con flumetasona, en la que salvo los grupos funcionales en el C-17 todas las demás características funcionales requeridas ya están en su lugar.
La funcionalización de C-17 se consigue por la secuencia representada en el esquema 1.
La primera etapa implicó la escisión oxidante del grupo hidroximetilo en C-17 en flumetasona, que es conocida químicamente como 6a, 9a-difluoro-11º, 17a, 21-trihidroxi-16a-metil-androsta-1, 4-dieno-3, 20-diona, por medio de ácido periódico para obtener ácido 6a, 9a-difluoro-11º, 17a, dihidroxi-16a-metil-androsta-1, 4-dieno-3-ona-17 5 carboxílico 2. La activación del grupo carboxilo del compuesto 2 usando N, N’-carbonildiimidazol (CDI) en dimetilformamida (DMF) y tratamiento subsecuente con H2S dio 6a, 9a-difluoro-11º, 17a, dihidroxi-16a-metil-3-oxoandrosta-1, 4-dieno-17º-carbotioico 3. El grupo hidroxilo de C-17 del compuesto 3 se esterificó usando cloruro de propionilo y trietilamina (TEA) para obtener ácido 6a, 9a-difluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxoandrosta-1, 4-dieno-17º-carbotioico 4. La alquilación del compuesto 4 con bromoclorometano usando NaHCO3, y 10 dimetilacetamida (DMAc) dio S-clorometil-6a, 9a-difluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4dieno-17º-carbotioato 5. El intercambio de halógeno con NaI en acetona convirtió el éster de clorometilo 5 en Syodometil-6a, 9a-difluoro-11 º-hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4-dieno-17º-carbotioato 6. En la etapa final, el éster de yodometilo 6 se hizo reaccionar con fluoruro de plata (AgF) en acetonitrilo para obtener propionato de fluticasona I. El éster de clorometilo 5 se puede convertir también en el compuesto II con X=Br (S15 bromometil-6a, 9a-difluoro-11º -hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4-dieno-17º-carbotioato) usando
un nucleófilo apropiado, tal como bromuro de litio.
Aunque el procedimiento descrito anteriormente es respetuoso con el medio ambiente, no es capaz de proporcionar propionato de fluticasona I suficientemente puro para cumplir con los límites de las exigentes especificaciones de la farmacopea (EP/USP) , y las condiciones de procesado para la conversión del éster de clorometilo 5 en éster de yodometilo 6 y a continuación en propionato de fluticasona I son muy tediosas e ineficientes.
Específicamente, la conversión del éster de clorometilo 5 en éster de yodometilo 6 descritas en el documento US 4335121 adolece de las siguientes limitaciones:
• Quedan trazas del material de partida éster de clorometilo 5 incluso después de largos tiempos de reacción (más de 48 horas) . Estas trazas se arrastran a las etapas subsecuentes hasta el propionato de fluticasona I. Las trazas de éster de clorometilo 5 son difíciles de retirar por cristalizaciones múltiples o incluso por separación
cromatográfica debido a la pobre solubilidad del éster en la mayor parte de los disolventes polares así como en los no polares.
• La conversión de éster de clorometilo 5 en éster de yodometilo 6 adolece de la generación de impurezas de degradación oxidante. Los compuestos de azufre 4, 5 y 6 tienen tendencia a la dimerización oxidante, y se observaron impurezas dímeras como los compuestos 11 y 12 a más altas temperaturas (más de 60ºC) o con
mayores tiempos de reacción. Se observó que tales subproductos se forman en cantidades significativas, que son difíciles de controlar/reducir dentro de los límites de las exigentes especificaciones de la farmacopea (EP/USP) incluso después de múltiples purificaciones.
Compuesto 11: X = -S-S- [17, 17’- (disulfanodiildicarbonil) bis (6a, 9a-difluoro-11º-hidroxi-16a-metil-3-oxo-androsta-1, 420 dieno-17a-il) dipropionato]
Compuesto 12: X = -S-S-S- [17, 17’- (trisulfanodiildicarbonil) bis (6a, 9a-difluoro-11º-hidroxi-16a-metil-3-oxo-androsta1, 4-dieno-17a-il) dipropionato]
La conversión de éster de yodometilo 6 en propionato de fluticasona I descrita en el documento US 4335121 adolece de las siguientes limitaciones:
• La reacción tarda mucho tiempo (72 horas - 11 días)
• Se debe usar un exceso de fluoruro de plata (10-15 eq) para la conversión completa, lo que provoca problemas durante la recuperación del fluoruro de plata de la corriente de desecho.
• Debido al exceso de fluoruro de plata usado, se forma un residuo negro espeso insoluble, que interfiere en la homogeneidad de la reacción.
• Las partículas negras metálicas suspendidas no se pueden eliminar fácilmente por filtración en Kieselguhr, en la que estas impurezas se transfieren incluso después de múltiples filtraciones. Las impurezas negras metálicas requieren múltiples lavados con HCl 2M para la retirada completa.
• Al final, después de todo el tedioso tratamiento acuoso, el aislamiento del producto requiere cromatografía
preparativa y dos cristalizaciones para obtener material que cumpla los límites de la farmacopea. Esta 35 purificación cromatográfica limita adicionalmente la aplicabilidad de este procedimiento a escala comercial.
Según la solicitud de patente israelí IL 109656, se sintetizó propionato de fluticasona I a partir de ácido 6a, 9adifluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4-dieno-17 º-carbotioico 4 usando un halofluorometano, por ejemplo, bromofluorometano, y catalizadores de transferencia de fase, como se muestra en el esquema 2. La ventaja de este procedimiento es el uso de halofluorometanos, tales como bromofluorometano, que
son reactivos no respetuosos con el medio ambiente que se sabe que dañan la capa de ozono de la atmósfera.
El procedimiento descrito en la solicitud de patente internacional WO 2004/001369 implica las siguientes etapas representadas en el esquema 3.
Ácido 6a, 9a-difluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4-dieno-17 º-carboxílico 7 se convirtió en el correspondiente tiocarbonato 8 usando cloruro de N, N-dimetiltiocarbamoilo en un disolvente aprótico inerte en presencia de un catalizador de yoduro y una base. El compuesto 17 º-N, N-dimetiltiocarbamoiloxicarbonilo 8 se trató con un sistema alcohol-carbonato de metal alcalino, por ejemplo carbonato de potasio en metanol para obtener la sal 9 de metal alcalino del compuesto 4 (6a, 9a-difluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxo-androsta-1, 4-dieno
17º-carbotioato de sodio) . La sal de metal alcalino 9 se trató in situ con bromofluorometano para obtener propionato de fluticasona I. Alternativamente, el compuesto 4 se aisló por... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para preparar S-fluorometil-6a, 9a-difluoro-11º-hidroxi-16a-metil-17a-propioniloxi-3-oxoandrosta-1, 4-dieno-17º-carbotioato I.
en la que X es un grupo saliente.
2. El procedimiento de la reivindicación 1, en el que el grupo saliente X es:
(a) un grupo cloro, bromo, yodo, bencenosulfonilo, p-toluenosulfonilo (tosilo) , metilsulfonilo (mesilo) , trifluorometanosulfonilo (triflato) , o acetilo; y/o
(b) yodo.
10 3. El procedimiento de la reivindicación 1 o 2, en el que los fluoruros mixtos solubles:
(a) se seleccionan de fluoruro de potasio, fluoruro de cesio, fluoruro de antimonio, fluoruro de tetrabutilamonio, fluoruro de calcio, fluoruro de plata, trifluoruro de bis (2-metoxietil) aminoazufre (Deoxo-Fluor®) , trifluoruro de dietilaminoazufre (DAST®) , y hexafluoropropildietilamina (MEC-81®) ; y/o
(b) se seleccionan de fluoruro de potasio, fluoruro de cesio, fluoruro de antimonio, fluoruro de tetrabutilamonio, 15 fluoruro de calcio, y fluoruro de plata; y/o
(c) comprenden fluoruro de plata y por lo menos otro fluoruro; y/o
(d) comprenden o son fluoruro de plata y fluoruro de calcio; y/o
(e) son una disolución de fluoruros mixtos solubles en un disolvente orgánico; y/o
(f) son una disolución de fluoruros mixtos solubles en un disolvente orgánico, y en el que la disolución de
fluoruros mixtos solubles se prepara calentando los fluoruros mixtos solubles en el disolvente orgánico a una temperatura d.
2. 95ºC; y/o
(g) son una disolución de fluoruro de plata y fluoruro de calcio en un disolvente orgánico; y/o
(h) son una disolución de fluoruro de plata y fluoruro de calcio en un disolvente orgánico, y en el que la
disolución de fluoruros mixtos solubles se prepara calentando los fluoruros mixtos solubles en el disolvente 25 orgánico a una temperatura d.
2. 95ºC.
4. El procedimiento de la reivindicación 3, en el que el disolvente orgánico: (a) se selecciona de acetonitrilo, tetrahidrofurano, acetato de etilo, dimetilformamida, dimetilacetamida, y una combinación de acetato de etilo y acetonitrilo, benzonitrilo o propionitrilo; y/o
(b) comprende o es acetonitrilo.
5. El procedimiento de una cualquiera de las reivindicaciones precedentes; en el que:
(a) el uso de los fluoruros mixtos solubles da como resultado la fluoración selectiva y controlada del grupo –CO-SCH2X del compuesto II; y/o
(b) el procedimiento comprende adicionalmente la etapa de cristalizar el compuesto I en un alcohol.
6. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que
(a) el compuesto I obtenido comprende menos de 0, 4% de impurezas dímeras 17, 17’
(disulfanodiildicarbonil) bis (6a, 9a-difluoro-11 º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17a-il) dipropionato 11 y 17, 17’- (trisulfanodiildicarbonil) bis (6a, 9a-difluoro-11º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17ail) dipropionato 12; y/o
(b) la pureza HPLC del compuesto I obtenido es mayor de 97%, y/o
(c) el rendimiento del compuesto I obtenido es mayor de 60%.
7. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que previamente a la fluoración el compuesto II se cristaliza usando un sistema disolvente que comprende un disolvente polar y uno no polar.
8. El procedimiento de la reivindicación 7, en el que el sistema disolvente comprende:
(a) acetato de etilo, acetato de butilo, acetato de metilo, acetato de isopropilo, metanol, acetona, THF,
dimetilformamida, dimetilacetamida, acetato de metilo/ácido fórmico, acetato de metilo/ácido acético, acetato de etilo/ácido acético, acetato de isopropilo/ácido acético, acetato de butilo/ácido acético, acetato de etilo/ácido propiónico, o acetato de etilo/ácido butírico; y/o
(b) acetato de etilo y ácido acético.
9. El procedimiento de la reivindicación 7 u 8, en el que:
(a) el compuesto II obtenido comprende menos de 0, 4% de impurezas dímeras 17, 17’ (disulfanodiildicarbonil) bis (6a, 9a-difluoro-11 º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17a-il) dipropionato 11 y 17, 17’- (trisulfanodiildicarbonil) bis (6a, 9a-difluoro-11º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17ail) dipropionato 12; y/o
(b) la pureza HPLC del compuesto II obtenido es mayor de 95%, y/o 30 (c) el rendimiento del compuesto II obtenido es mayor de 60%.
10. El procedimiento de una cualquiera de las reivindicaciones precedentes, en el que previamente a la fluoración el compuesto II se prepara convirtiendo un compuesto III
en el que Y es otro grupo saliente, en el compuesto II en presencia de un inhibidor de radicales o un antioxidante o 35 ambos.
11. El procedimiento de la reivindicación 10, en el que el grupo saliente Y es:
(a) un grupo cloro, bromo o hidroxilo; y/o
(b) cloro
12. El procedimiento de la reivindicación 10 u 11, en el que:
(a) el inhibidor de radicales se selecciona de metilhidroquinona, bis (4-metoxi-3-terc-butil-5-metil-fenil) sulfuro, ciclohexeno, L-cisteína, N, N-dimetilglicina, ácido sórbico e hidroquinona; y/o
(b) el inhibidor de radicales es hidroquinona; y/o
(c) el antioxidante se selecciona de ácido ascórbico, metabisulfito de potasio, metabisulfito de sodio, tiosulfato de sodio, hidroxianisol butilado e hidroxitolueno butilado; y/o
(d) el antioxidante es hidroxitolueno butilado; y/o
(e) la conversión se lleva a cabo en presencia de hidroquinona e hidroxitolueno butilado. 10 13. El procedimiento de una cualquiera de las reivindicaciones 10 a 12, en el que:
(a) el compuesto II obtenido comprende menos de 0, 5% de impurezas dímeras 17, 17’ (disulfanodiildicarbonil) bis (6a, 9a-difluoro-11 º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17a-il) dipropionato 11 y 17, 17’- (trisulfanodiildicarbonil) bis (6a, 9a-difluoro-11º-hidroxi-16a-metil-3-oxo-androsta-1, 4-dieno-17ail) dipropionato 12; y/o
(b) la pureza HPLC del compuesto II obtenido es mayor de 95%, y/o
(c) el rendimiento del compuesto II obtenido es mayor de 60%.
14. El procedimiento de una cualquiera de las reivindicaciones 10 a 13, en el que el compuesto II se purifica adicionalmente por un procedimiento según una cualquiera de las reivindicaciones 7 a 9.
Patentes similares o relacionadas:
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Derivados de ácidos biliares como agonistas FXR/TGR5, del 1 de Julio de 2020, de ENANTA PHARMACEUTICALS, INC: Un compuesto representado por la Formula I, o una sal o ester aceptable farmaceuticamente de este: **(Ver fórmula)** en donde: Ra es hidrogeno o -C1-C8 alquilo […]
Yoduro de povidona, un conservante alternativo novelo para composiciones oftálmicas, del 3 de Junio de 2020, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Una composición oftálmica estable adecuada para administración tópica en el ojo, que comprende una mezcla de: a. yoduro de povidona (PVP-I) a una concentración entre 0,01% […]
Composiciones y métodos para suprimir las proliferaciones endometriales, del 13 de Mayo de 2020, de Allergan Pharmaceuticals International Limited: Antagonista de progesterona seleccionado de 21-metoxi-17a-acetoxi-11b-(4-N,N-dimetilaminofenil)-19- norpregna-4,9-dieno-3,20-diona (CDB-4124) o 17α-acetoxi-11β-(4-N,N-dimetilaminofenil)-19-norpregna-4,9- […]
Composiciones oftálmicas que comprenden povidona yodada, del 29 de Abril de 2020, de CLS PHARMACEUTICALS, INC: Una composición adecuada para la administración tópica a un ojo, eficaz para el tratamiento y/o la profilaxis de una infección por microorganismos […]
Uso de desoxicolato de sodio para la eliminación no quirúrgica de grasa, del 8 de Abril de 2020, de Lundquist Institute for Biomedical Innovation at Harbor-UCLA Medical Center: Uso de desoxicolato de sodio para la eliminación no terapéutica y no quirúrgica de acumulación de grasa localizada.
Suministro transdérmico, del 8 de Abril de 2020, de AGILE THERAPEUTICS, INC: Un método anticonceptivo, que comprende: (A) aplicar de manera consecutiva múltiples dispositivos de tratamiento de suministro de hormonas transdérmico a la piel […]
Método de tratamiento y composiciones que comprenden un inhibidor dual de la quinasa PI3K delta-gama y un corticoesteroide, del 1 de Abril de 2020, de Rhizen Pharmaceuticals S.A: Un inhibidor dual de PI3K delta y gamma y un corticosteroide para su uso en el tratamiento de una enfermedad o afección autoinmune, respiratoria […]