Procedimiento para juzgar el riesgo de granulocitopenia inducida por fármacos.
Un procedimiento de detectar un polimorfismo del gel del sustrato 2 del receptor de insulina humana de una muestra derivada de un sujeto para determinar la presencia del riesgo de granulocitopenia inducida por fármacos de un sujeto,
en el que la presencia del riesgo de granulocitopenia inducida por fármacos se determina mediante el uso de al meno un polimorfismo genético seleccionado del grupo que consiste en el sustrato 2 del receptor de insulina humana que se describe más adelante en (a) a (f):
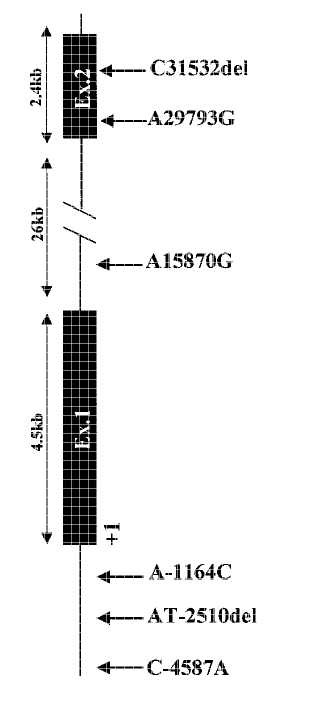
(a) un polimorfismo que es conversión de C (Silvestre) en A en la posición 4.587 en 5' del codón de inicio de la traducción;
(b) un polimorfismo que es una deleción de AT (Silvestre) en la posición 2.510 en 5' del codón de inicio de la traducción;
(c) un polimorfismo que es conversión de A (Silvestre) en C en la posición 1.164 en 5' del codón de inicio de la traducción;
(d) un polimorfismo que es conversión de A (Silvestre) en G en la posición 15.870 en 3' del codón de inicio de la traducción;
(d) un polimorfismo que es conversión de A (Silvestre) en G en la posición 29.793 en 3' del codón de inicio de la traducción; y
(f) un polimorfismo que es una deleción de AT (Silvestre) en la posición 31.532 en 3' del codón de inicio de la traducción;
en los que los números de posición corresponden a los números de posición que cuentan desde A a ATG como codón para Met en el extremo N de la proteína cuando el ARNm se traduce en proteína.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2004/010722.
Solicitante: OTSUKA PHARMACEUTICAL CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 9, KANDATSUKASA-CHO 2-CHOME CHIYODA-KU TOKYO 101-8535 JAPON.
Inventor/es: SUEMATSU,Koji, HASEGAWA,Kouichi.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2379811_T3.pdf
Fragmento de la descripción:
Procedimiento para juzgar el riesgo de granulocitopenia inducida por fármacos
Campo de la técnica
La presente invención se refiere a un procedimiento para evaluar el riesgo de granulocitopenia inducida por fármacos mediante el uso, como índice, de un polimorfismo del gen del sustrato 2 del receptor de la insulina humana; a un procedimiento de detectar el polimorfismo genético empleado como índice de la evaluación del riesgo mencionada anteriormente; a oligonucleótidos empleados para estos procedimientos; y a un kit para la evaluación y/o la detección.
Técnica anterior
El pilar principal de la medicina moderna es la terapia farmacológica, que emplea fármacos para tratar o prevenir diversas enfermedades. Casi todos los fármacos empleados en la terapia farmacológica (p. ej., compuestos de bajo peso molecular) son, intrínsecamente, sustancias extrañas para el cuerpo humano y, por tanto, la administración de dichos fármacos proporciona eficacia terapéutica pero puede producir diversos efectos secundarios. Dichos efectos secundarios a menudo hacen que se abandone la terapia farmacológica. Asimismo, algunos fármacos se han encontrado una situación en la que la investigación y el desarrollo se tienen que suspender debido a efectos secundarios graves, aunque se ha demostrado que los fármacos son útiles para pacientes con una enfermedad determinada. Además, el uso de algún otro fármaco está estrictamente regulado con el fin de detectar el signo de sus efectos secundarios mediante exploraciones obligatorias.
De acuerdo con las estadísticas publicadas en EE.UU., los casos de efectos secundarios inducidos por fármacos constituyen dos millones o más al año y más de 100.000 debido a dichos efectos secundarios (JAMA, 279, 1200 (1998) ) . En Japón, se han notificado 26.545 de efectos secundarios inducidos por fármacos (incluidos casos notificados de forma redundante) y 1.239 muertes por dichos efectos secundarios solo en el año 2000 (Ministr y of Health, Labor and Welfare, June 6, 2003, House of Representatives, Responsive Pleading No. 55) .
Entre los efectos secundarios debidos a la administración de fármacos, la granulocitopenia es un efecto secundario mortal. En particular, una disminución en los granulocitos tiende a producir una infección y el inicio de agranulocitosis implica un riesgo muy alto de enfermedad infecciosa grave, tal como neumonía o sepsis. Ejemplos de fármacos que en general se sabe que inducen granulocitopenia incluyen fármacos analgésicos-antipiréticos (aminopirina) , antibióticos (cloromicetina) , fármacos antitiroideos (merazol) , fármacos anticonvulsivos, fármacos antidiabéticos y fármacos diuréticos. Es menos probable que la aparición de efectos secundarios causados por dicho fármaco esté relacionada con su dosis y se considera que está relacionada con la predisposición de un paciente (p. ej., predisposición alérgica o idiosincrasia) . Por tanto, la aparición de dichos efectos secundarios es casi imposible de predecir. Con el fin de evitar la aparición de dichos efectos secundarios, los médicos deben manejar sus respectivos casos cuidadosamente, mediante entrevistas detalladas con pacientes individuales con respecto a, por ejemplo, los registros de administración de fármacos en otros departamentos, un análisis de los resultados de análisis de sangre etc. Es notable el hecho de que si y cuando un paciente presenta un inicio de un efecto secundario de granulocitopenia, los médicos deberán tomar medidas inmediatas, incluida la hospitalización.
Se conocen otros fármacos que inducen granulocitopenia, entre los que se incluye dibenzodiazepina (clozapina) , que es un fármaco antipsicótico. Cabe esperar que este fármaco tenga una eficacia alta, pero los ensayos clínicos del fármaco en Japón se han suspendido. Otros fármacos que inducen granulocitopenia incluyen vesnarinona, que tiene actividades inhibidoras sobre PDE3 y los canales de K. Este fármaco es un fármaco inotrópico eficaz que es menos probable que produzca arritmias y otros acontecimientos cardíacos (p. ej., inicio de insuficiencia cardíaca y hospitalización) . No obstante, la administración de este fármaco puede producir efectos secundarios, por ejemplo leucopenia, granulocitopenia y la posterior agranulocitosis. Por tanto, el uso de este fármaco está estrictamente limitado.
Los polimorfismos de un solo nucleótido (SNP) son los marcadores genéticos más usados en los análisis genéticos humanos. Ya se ha demostrado que los SNP son marcadores útiles para un estudio de asociación entre los antecedentes genéticos y las enfermedades habituales o respuestas farmacológicas (véanse los documentos no patentes 1, 2 y 3) . Como se sabe, el análisis del haplotipo, construido con múltiples SNP, es útil para analizar la susceptibilidad de enfermedades poligénicas (véanse los documentos no patentes 4 y 5) . En la práctica, algunas enfermedades, como la enfermedad de Alzheimer y la hipertensión, ya han sido analizados intensamente mediante dicho procedimiento de análisis (Jeunemaitre, X., y coI., Am. J. Hum. Genet., 60, 1448-1460 (1997) ; Martin, E. R., Am. J. Hum. Genet., 67, 383-394 (2000) ) .
En los últimos años, los avances en el análisis del genoma han conducido al desarrollo de la toxicogenómica, que estudia la relación entre genes y toxicidades, tales como el efecto de un fármaco sobre el citocromo P450 (CYP) (es decir, una enzima de metabolismo de fármacos) . En concreto, los estudios de asociación de antecedentes genéticos individuales y la sensibilidad/respuesta se han propuesto como una herramienta potente para acarar la causa de los efectos adversos. Cabe esperar que la denominada terapia adaptada se realice a través de estos enfoques. Bernal y coI., Diabetes vol. 47 (1998) 976-979 divulga la identificación de nuevos polimorfismos de aminoácidos del sustrato 2 del receptor de la insulina y su ausencia de asociación con la diabetes de tipo 2 entre caucasianos.
Documento no patente 1: Brookes, A. J., "The essence of SNPs, " Gene, USA, (1999) , 234, 177-186 Documento no patente 2: Cargill, M, y col., "Characterization of single-nucleotide polymorphisms in coding regions of human genes, " Nature Genet., USA, (1999) , 22, 231-238 Documento no patente 3: Evans, W. E., & Reiling, M. V., "Pharmacogenomics: translating functional genomics into rational therapeutics, " Science, USA, (1999) , 286, 487-491 Documento no patente 4: Stephens, J. C., et aI., "Dating the origin of the CCRS-Delta32 AIDS-resistance allele by the coalescence of haplotypes, " Am. J. Hum. Genet., USA, (1998) , 62, 1507-1515 Documento no patente 5: Tishkoff, S. A., y col., "The accuracy of statistical methods for estimation of haplotype frequencies: an example from the CD4 locus, " Am. J. Hum. Genet., USA, (2000) , 67, 518-522
Divulgación de la invención
Problemas que ha de resolver la invención
Un objetivo principal de la presente invención es proporcionar medios para evaluar el riesgo de garnulocitopenia inducida por fármacos mediante el uso, como índice, de polimorfismos del gen del sustrato 2 del receptor de la insulina humana o medios para detectar los polimorfismos genéticos empleados como índice para el medio de evaluación del riesgo. Medios para resolver los problemas Con el fin de resolver los problemas mencionados anteriormente, en primer lugar, los presentes inventores han seleccionado, como genes para el análisis de los polimorfismos, 115 genes candidatos, incluidos los genes relacionados con las citocinas, genes de la región del MHC, genes relacionados con G-CSF, genes relacionados con el TNF-a, genes relacionados con NFK, genes relacionados con AMPc y genes relacionados con los canales de K, en los que se buscaron SNP en estos genes candidatos de la base de datos de polimorfismos de un solo nucleótido japoneses y se escogieron 188 SNP candidatos para análisis.
Posteriormente, los presentes inventores han determinado la frecuencia de esos SNP en el ADN genómico de las muestras de los siguientes dos grupos: un grupo de sujetos con granulocitopenia inducida por la administración de un fármaco específico y un grupo de sujetos sin granulocitopenia que han recibido el mismo fármaco. Como resultado, los presentes inventores han confirmado que los SNP con la diferencia más estadísticamente significativa entre los dos grupos mencionados anteriormente están presentes en el gen del sustrato 2 del receptor de insulina (J-SNP 10: IMS-JST040476) (en lo sucesivo se hará referencia al gen como "gen IRS-2") .
Además, los presentes inventores han realizado amplios estudios sobre la relación... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de detectar un polimorfismo del gel del sustrato 2 del receptor de insulina humana de una muestra derivada de un sujeto para determinar la presencia del riesgo de granulocitopenia inducida por fármacos de un sujeto, en el que la presencia del riesgo de granulocitopenia inducida por fármacos se determina mediante el uso de al meno un polimorfismo genético seleccionado del grupo que consiste en el sustrato 2 del receptor de insulina humana que se describe más adelante en (a) a (f) :
(a) un polimorfismo que es conversión de C (Silvestre) en A en la posición 4.587 en 5' del codón de inicio de la traducción;
(b) un polimorfismo que es una deleción de AT (Silvestre) en la posición 2.510 en 5' del codón de inicio de la traducción;
(c) un polimorfismo que es conversión de A (Silvestre) en C en la posición 1.164 en 5' del codón de inicio de la traducción;
(d) un polimorfismo que es conversión de A (Silvestre) en G en la posición 15.870 en 3' del codón de inicio de la traducción;
(d) un polimorfismo que es conversión de A (Silvestre) en G en la posición 29.793 en 3' del codón de inicio de la traducción; y
(f) un polimorfismo que es una deleción de AT (Silvestre) en la posición 31.532 en 3' del codón de inicio de la traducción;
en los que los números de posición corresponden a los números de posición que cuentan desde A a ATG como codón para Met en el extremo N de la proteína cuando el ARNm se traduce en proteína.
2. Un procedimiento como se ha descrito en la reivindicación 1, en el que el polimorfismo genético se detectan mediante al menos una técnica seleccionada del grupo que consiste en secuenciación directa de nucleótidos, análisis de transferencia de puntos de oligonucleótidos específicos de alelo (ASO) , polimorfismo de la longitud completa del fragmento sometido a PCR con enzimas de restricción, ensayo invasor, PCR cuantitativa en peso real y un ensayo de polimorfismo genético empleando un espectrómetro de masas (ensayo de masas) .
3. Un procedimiento como se ha descrito en la reivindicación 2, en el que el polimorfismo genético se detecta mediante secuenciación nucleotídica directa.
4. Un procedimiento como se ha descrito en la reivindicación 2, en el que el polimorfismo genético se detecta mediante análisis del polimorfismo de longitud de fragmento (RFLP) con PCR-enzimas de restricción.
5. Un procedimiento como se ha descrito en la reivindicación en el que el análisis del polimorfismo de longitud de fragmento (RFLP) con PCR-enzimas de restricción se realiza mediante el uso de la enzima de restricción Afa I para detectar la conversión de A a G en la posición 29.793 en 3' desde el codón de inicio de la traducción del Met del sustrato 2 del receptor de la insulina humana.
6. Un procedimiento como se ha descrito en la reivindicación 1, que detecta un polimorfismo genético para evaluar el riesgo de granulocitopenia inducida por fármacos atribuida a la administración de vesnarinona mediante el uso de los oligonucleótidos seleccionados del grupo que consiste en los oligonucleótidos descritos en los siguientes (a) a (f) :
(a) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es la conversión de C en A en la posición 4.587 en 5' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana;
(b) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es deleción de AT en la posición 2.510 en 5' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana;
(c) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es la conversión de A en C en la posición 1.164 en 5' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana;
(d) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es la conversión de A en C en la posición 15.870 en 3' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana;
(e) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es la conversión de A en C en la posición 29.793 en 3' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana; y
(f) un oligonucleótido que tiene una secuencia que incluye un polimorfismo genético que es deleción de C en la posición 31.532 en 3' del codón de inicio de la traducción del gen del sustrato 2 del receptor de insulina humana.
(a) un oligonucleótido que tiene la secuencia de SEC ID Nº 1;
(b) un oligonucleótido que tiene la secuencia de SEC ID Nº 2;
O mediante el uso de un oligonucleótido seleccionado del grupo que consiste en una combinación de los oligonucleótidos descritos más adelante en (a) y (b) , (c) y (d) , (e) y (f) , (g) y (h) , (i) y (j) , y (k) y (I) :
(c) un oligonucleótido que tiene la secuencia de SEC ID Nº 4; 5 (d) un oligonucleótido que tiene la secuencia de SEC ID Nº 5;
(e) un oligonucleótido que tiene la secuencia de SEC ID Nº 7;
(f) un oligonucleótido que tiene la secuencia de SEC ID Nº 8;
(g) un oligonucleótido que tiene la secuencia de SEC ID Nº 10;
(h) un oligonucleótido que tiene la secuencia de SEC ID Nº 11; 10 (i) un oligonucleótido que tiene la secuencia de SEC ID Nº 13;
(j) un oligonucleótido que tiene la secuencia de SEC ID Nº 14;
(k) un oligonucleótido que tiene la secuencia de SEC ID Nº 15; y
(l) un oligonucleótido que tiene la secuencia de SEC ID Nº 16.
7. Un procedimiento como se ha descrito en la reivindicación que detecta un polimorfismo genético usado para evaluar el riesgo de granulocitopenia inducida por fármacos atribuida a la administración de vesnarinona mediante el uso de oligonucleótidos que tiene una secuencia que incluye un polimorfismo génico que es conversión de A a G en la posición 29.793 en 3' desde el codón de inicio de la traducción del sustrato 2 del receptor de la insulina humana y la enzima de restricción Afa I.
8. Un procedimiento como se ha descrito en la reivindicación 1, en el que el gen del sustrato 2 del receptor de la insulina humana corresponde a 93.673 a 126.402 en la secuencia en GenBank con número de registro AL162497.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]