Genes y proteínas de oxidasa de alcohol graso de Cándida Tropicalis y métodos relacionados con los mismos.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/012144.
Solicitante: COGNIS IP MANAGEMENT GMBH.
Nacionalidad solicitante: Alemania.
Dirección: HENKELSTRASSE 67 40589 DUSSELDORF ALEMANIA.
Inventor/es: CRAFT, DAVID, L., EIRICH, L., DUDLEY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Oxidoreductasas (1).
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C07K1/00 C07 […] › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Procedimientos generales de preparación de péptidos.
- C12N1/20 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- C12N9/04 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre grupos CHOH como dadores, p. ej. glucosa oxidasa de glucosa, deshidrogenasa láctica (1.1).
- C12P21/04 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Péptidos o polipéptidos cíclicos o puenteados, p. ej. bacitracina.
- C12P21/06 C12P 21/00 […] › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
- C12Q1/00 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
- C12Q1/34 C12Q […] › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
PDF original: ES-2379776_T3.pdf
Fragmento de la descripción:
Genes y proteínas de oxidasa de alcohol graso de Candida tropicalis y métodos relacionados con los mismos Referencia cruzada con solicitudes relacionadas La presente invención reivindica el beneficio de la Solicitud Provisional de los Estados Unidos con Serial No. 60/374.021, presentada el 19 de abril de 2002, la cual se incorpora aquí como referencia.
Antecedentes de la invención Diferentes cepas modificadas por ingeniería genética de Candida tropicalis han sido utilizadas en fermentaciones para la bioconversión del ácido graso de 18 carbonos como ácido oleico en ácido dicarboxílico de 18 carbonos. Cuando se cultiva sobre ácidos grasos, C. tropicalis de tipo silvestre convierte ácidos grasos de cadena larga en acetil CoA por medio de un proceso conocido como oxidación en º, que es el catabolismo secuencial de fragmentos de 2 carbonos de longitud de un ácido graso en acetil CoA. La oxidación en º es por lo tanto llamada así debido a que se presenta el ataque oxidativo inicial en el segundo átomo de carbono del grupo carboxílico. C. tropicalis puede catabolizar también ácidos grasos a través de una ruta de oxidación en w en la cual únicamente el carbono del metilo terminal es oxidado hasta un ácido carboxílico, produciendo un ácido dicarboxílico. En la oxidación en w, el ácido graso es convertido en ácido dicarboxílico a lo largo de una ruta de tres etapas comenzando con la oxidación del grupo metilo terminal hasta un alcohol. Esta etapa es catalizada por el complejo hidroxilasa que contiene tanto las proteínas citocromo P450 monooxigenasa (CYP) como la citocromo P450 reductasa (NCP) . El alcohol es luego convertido en un aldehído por medio de la alcohol graso oxidasa (FAO) luego en el ácido dicarboxílico por medio de una aldehído deshidrogenasa. El producto deseado es el ácido dicarboxílico de cadena larga. Una oxidasa de alcohol graso se diferencia de una alcohol oxidasa en su especificidad por una cadena larga. Las alcohol oxidasas son en general específicas para metanol pero algunas veces pueden oxidar alcoholes hasta de C4. Las oxidasas de alcohol graso generalmente no oxidan alcoholes con longitudes de cadena menores de ocho.
En la Candida tropicalis de tipo silvestre, la oxidación en º consume ácidos grasos mucho más rápido de lo que la ruta de la oxidación en w puede oxidarlos. Sin embargo, por medio de la inactivación de los genes POX 4 y POX 5, cuyos productos génicos son responsables por la iniciación de la oxidación en º, tales cepas modificadas por medio de ingeniería genética de C. tropicalis preferencialmente desvían los ácido grasos dentro de la ruta de la oxidación en w. La cepa base utilizada para el desarrollo de diversas cepas amplificadas por el gen es H5343, que es la cepa 20336 de C. tropicalis (American Type Culture Collection) tanto con los genes POX 4 como POX 5 inactivados por medio de inactivación por inserción. La cepa primaria utilizada en fermentaciones de producción a gran escala es HDC23-3, que se deriva de H5343, pero también tiene al gen CYP52A2 (una citocromo P450 monooxigenasa) amplificado. El complejo de hidroxilasa es responsable por catalizar la primera etapa en la oxidación en w, que es considerada la etapa limitante de la velocidad. La amplificación de los genes CYP52A2 y NCP ayuda a superar esta limitación de la velocidad, pero luego el siguiente cuello de botella vuelve la conversión del alcohol en el aldehído por medio de la enzima FAO. Durante las fermentaciones con HDC23-3, se ha descubierto que una pequeña cantidad (aproximadamente 0, 5% p/p en el caldo) del ácido graso w-hidroxi (HFA) se acumula durante la fermentación. Este producto de oxidación parcial interfiere con las etapas de purificación posteriores y provoca rendimientos totales menores. Existe por lo tanto la necesidad adicional, de reductor el cuello de botella en la conversión del alcohol en un aldehído durante la segunda etapa de la ruta de oxidación en w.
Un pequeño número oxidasas de alcohol graso ha sido descrito en la literatura científica en diversas levaduras, ejemplos de las cuales son Candida tropicalis (1, 2, 3, 4) , Candida maltosa (5, 6) , Candida cloacae (4) , Torulopsis candida (7) , Candida (Torulopis) bombicola (8) , y Candida (Torulopsis) apicola (9) . La FAO fue purificada a partir de la levadura cultivada en hexadecano, T candida (7) y descrita como un tetrámero (pm 290 kD) con un peso molecular por subunidad de 75 ID. Tiene un pH óptimo de 7, 6 y oxida alcoholes superiores con una cadena carbonada de C4 a C16. C. bombicola (8) cultivada en hexadecano tiene aparentemente dos diferentes actividades como alcohol oxidasa, una con una especificidad óptima de longitud de cadena de 10 para n-alcoholes y otra con una especificidad óptima de longitud de cadena de 14. La FAO de C. maltosa (6) cataliza la oxidación de 1-alcanoles (C4 a C22) con la actividad más alta utilizando 1-octanol. También oxida 2-alcanoles (C8 a C16) . Se encontró que los a, w-alcanodioles, el ácido w-hidroxipalmítico, los fenilalcanoles y los alcoholes terpénicos, todos eran sustratos para la FAO, pero con muy bajas tasas de oxidación. La oxidación de 2-alcanoles es estereoselectiva únicamente para los R (-) enantiómeros.
La FAO de C. tropicalis (ATCC 20336) cultivada sobre hexadecano fue descrita primero por Kemp et al. en 1988 (1) . Se encontró que oxida 1-alcanoles de C4 a C18, pero tiene una actividad máxima con dodecanol. Se encontró que oxida 16-hidroxipahnitato pero no 12-hidroxilaurato. La FAO fue posteriormente purificada (3) y se demostró que era un dímero (pm = 145 kD) con un peso molecular por subunidad de 68 - 72 kD. La enzima purificada mostró especificidad similar por el sustrato como se describió anteriormente, pero demostró actividad adicional con 12hidroxilaurato y 2-dodecanol. Se encontró que la enzima era una flavoproteína sensible a la luz, pero la identidad de
la flavina no se conocía (10) .
Recientemente se clonaron dos genes FAO de C. cloacae y un gen FAO de C. tropicalis y se determinaron las secuencias de ADN (4, 12) . Las identidades del marco de lectura abierto (ORF) y 74, 8% y 76, 2% similitudes de la secuencia de aminoácidos con la FAO1 y FAO2 de C. cloacae, respectivamente. El gen FAO1 pero no el gen FAO2 ha sido exitosamente clonado y expresado en Escherichia coli.
WO 99/47685 divulga secuencias aisladas de ácido nucleico que codifican un polipéptido que tiene actividad de FAO, constructos de supresión de ácido nucleico, células mutantes que suprimen FAO, y usos de los mismos.
La presente invención proporciona genes FAO de C. tropicalis y composiciones y métodos que emplean los genes FAO. Las composiciones y los métodos son útiles para incrementar la actividad de la FAO durante la segunda etapa de oxidación en omega de ácido grasos y en última instancia en un incremento en productividad de diácido.
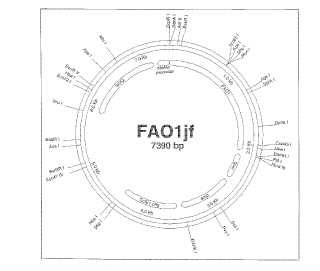
Breve descripción de los dibujos La Figura 1 es un mapa de restricción de FAO1jf que es la región de codificación del gen para FAO1 ligado dentro del vector de expresión pJF118EH.
La Figura 2 es un mapa de restricción de FAO2jf que s la región de codificación del gen para FAO2 ligado dentro del vector de expresión pJF118EH.
La Figura 3 describe gráficamente la actividad típica de la alcohol oxidasa en fermentaciones a escala de laboratorio con ácido oleico como sustrato.
La Figura 4 describe gráficamente la actividad de FAO1, FAO2a, y FAO2a' sobre 1-alcanoles.
La Figura 5 describe gráficamente la actividad de FAO 1, FAO2a y FAO2a' sobre 2-alcanoles.
La Figura 6 describe gráficamente la actividad de FAO1, FAO2, y FAO2a' sobre otros alcanoles.
La Figura 7 describe gráficamente una comparación de productividad en fermentaciones con cepas amplificadas por la FAO o una cepa base, H5343.
La Figura 8 describe gráficamente una comparación de la concentración del ácido graso T-hidroxi en fermentaciones con la cepa amplificada por la FAO, HDC40-7, o la cepa base, H5343.
La Figura 9 describe gráficamente una comparación de la actividad de la alcohol oxidasa entre la cepa amplificada por FAO1, HDC40-7, y la cepa base, H5343.
La Figura 10 describe gráficamente una comparación de la concentración del ácido graso T-hidroxi en fermentaciones con la cepa amplificada por la FAO, HDC40-1, HDC40-5, o HDC40-7, utilizando ácido ricinoleico como sustrato.
Resumen de la invención La presente invención proporciona una oxidasa de alcohol graso o un fragmento enzimáticamente activo de la misma que tiene... [Seguir leyendo]
Reivindicaciones:
1. Una oxidasa de alcohol graso o un fragmento enzimáticamente activo de la misma que tiene una identidad de secuencia de aminoácidos superior al 90% cuando se la compara con la secuencia de aminoácidos expuesta en la SEQ ID NO: 2.
2. Una oxidasa de alcohol graso de acuerdo con la reivindicación 1, o un fragmento enzimáticamente activo de la misma que tiene una identidad de secuencia de aminoácidos superior al 95% cuando se la compara con la secuencia de aminoácidos expuesta en la SEQ ID NO: 2.
3. La oxidasa de alcohol graso de la reivindicación 1 ó 2 que comprende además un péptido firma que tiene la secuencia de aminoácidos expuesta en la SEQ ID NO: 13.
4. Una molécula aislada de ácido nucleico que codifica una oxidasa de alcohol graso que tiene una secuencia de aminoácidos como la expuesta en la SEQ ID NO: 2, o un análogo, derivado o fragmento enzimáticamente activo de la misma que tiene una identidad de secuencia de aminoácidos superior al 90% cuando se la compara con la secuencia de aminoácidos expuesta en la SEQ ID NO: 2.
5. La molécula aislada de ácido nucleico de la reivindicación 4 que contiene una secuencia de nucleótidos como la expuesta en la SEQ ID NO: 1.
6. Un vector que comprende una de las moléculas aisladas de ácido nucleico seleccionadas de entre el grupo que consiste de moléculas aisladas de ácido nucleico de la reivindicación 4 o la reivindicación 5.
7. Los vectores de la reivindicación 6 en donde el vector es un vector plásmido, fagémido, fago, cósmido, o vector de ADN lineal.
8. Una célula huésped que comprende uno de los vectores de la reivindicación 7.
9. La célula huésped de la reivindicación 8 en donde la célula es una célula bacteriana, una célula de hongo, una célula de insecto, una célula de animal o una célula de una planta.
10. La célula de hongo de la reivindicación 9 en donde la célula de hongo es una célula de levadura seleccionada de entre el grupo que consiste de Yarrowia sp., Bebaromyces sp., Saccharomyces sp., Schizosaccharomyces sp., Pichia sp. y Candida sp.
11. Un método para la producción de una proteína FAO1 que tiene una secuencia de aminoácidos como la expuesta en la SEQ ID NO: 2, dicho método comprendiendo: la transformación de una célula huésped adecuada con una secuencia de ADN que codifica una proteína que tiene una secuencia de aminoácidos como la expuesta en la SEQ ID NO: 2, y el cultivo de la célula bajo condiciones que favorezcan la expresión de la proteína FAO1.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Composiciones y métodos para inmunomodulación en un organismo, del 19 de Febrero de 2020, de UNIVERSITY OF CONNECTICUT: Una composicion para su uso en un metodo de (i) tratamiento de cancer en un ser humano; (ii) mejora de la vacunacion en un ser humano; (iii) aumento de las respuestas […]
CD33 soluble para tratar síndromes mielodisplásicos (MDS), del 8 de Enero de 2020, de H. Lee Moffitt Cancer Center And Research Institute, Inc: Una proteína de fusión recombinante quimérica, que comprende: (a) una combinación de al menos dos fracciones de unión a S100A9 seleccionados de entre el grupo que […]
Métodos para la diferenciación y transducción in vitro de células b de memoria con vectores virales pseudotipados vsv-g, del 1 de Enero de 2020, de Immusoft Corporation: Un método in vitro para expresar un ácido nucleico de interés en una célula B, que comprende (a) poner en contacto células B de memoria con una composición que comprende […]
 Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Intercambio de casetes de la región variable de la inmunoglobulina, del 12 de Junio de 2019, de Humanigen, Inc: Un método de modificación genética de un anticuerpo que retiene la especificidad de unión de un anticuerpo de referencia con un antígeno diana, comprendiendo el método: […]
Procedimiento de modificar células eucariotas, del 3 de Abril de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento de reemplazar in situ, en parte, en una célula madre embrionaria (ES) de ratón, un locus génico endógeno de región variable de […]
Diacuerpos covalentes y usos de los mismos, del 2 de Abril de 2019, de MACROGENICS, INC: Una molécula de diacuerpo que comprende una primera cadena polipeptídica y una segunda cadena polipeptídica, en la que: (a) dicha primera cadena […]