Compuestos de benzofurano marcados isotópicamente como radiotrazadores para proteínas amiloidógenas.
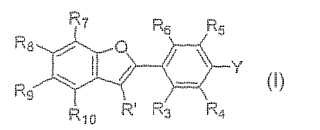
Compuesto de fijación a amiloide de fórmula (I) o una sal farmacéuticamente aceptable del mismo:
en el que
Y es F, CI, Br, I, O-(CR''2)n-X, o -(CR''2)n-X;
en el que
X es F, Cl, Br o I; y
n es 1 a 5;
R' es H o un grupo alquilo(C1-8);
R'' es H o un grupo alquilo(C1-8);
R3 a R10 se seleccionan independientemente entre el grupo que consiste en H, F, Cl, Br, I, alquilo(C1-C5), (CH2)1-3- OR11, CF3, -(CH2)1-3-X, -O-(CH2)1-3-X, CN, -CO-R11, -N(R11)2, -NR''3
+, -NO2, -CO-N(R11)2, -O-(CO)-R11, OR11, SR11,
COOR11, Rph, -CR11=CR11-Rph y -C(R11)2-C(R11)2-Rph, en el que
X es F, Cl, Br o I; y
Rph es fenilo opcionalmente sustituido con uno o más sustituyentes seleccionados entre el grupo que consiste en F, Cl, Br, I, alquilo(C1-C5), (CH2)1-3-O-R11, CF3, -(CH2)1-3-X, -O-(CH2)1-3-X, CN, -CO-R11, -N(R11)2, -CO-N(R11)2, -O-(CO)- R11, OR11, SR11 y COOR11, en el que cada R11 es independientemente H o alquilo(C1-C5); y
Y o R3-R10 comprenden al menos una marcación detectable seleccionada entre el grupo que consiste en 131l, 123l, 124l, 125l, 76Br, 75Br, 18F, 19F, 11C, 13C, 14C y 3H.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/039412.
Solicitante: UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 200 GARDNER STEEL CONFERENCE CENTER THACKERAY & O'HARA STREETS PITTSBURGH, PA 15260 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KLUNK,William E, MATHIS,JR. Chester A.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K51/04 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Compuestos orgánicos.
- C07D307/79 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › con solamente átomos de hidrógeno, radicales hidrocarbonados o hidrocarbonados sustituidos unidos directamente a los átomos de carbono del heterociclo.
PDF original: ES-2379987_T3.pdf
Fragmento de la descripción:
Compuestos de benzofurano marcados isotópicamente como radiotrazadores para proteínas amiloidógenas.
CAMPO DE LA INVENCIÓN
La presente invención se refiere de forma general al campo de los compuestos de benzofurano marcados isotópicamente que son sustrato de proteínas amiloidógenas, por ejemplo, Aº1-42, una proteína amiloide, cuyos depósitos en el cerebro se relacionan con la enfermedad de Alzheimer.
ANTECEDENTES DE LA INVENCIÓN
I. AMILOIDOSIS EN EL CEREBRO
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa caracterizada por la pérdida de memoria y otros trastornos cognitivos. McKhann et al., Neurology 34: 939 (1984) . Es la causa más frecuente de demencia en los Estados Unidos. La EA puede afectar a personas de tan solo 40-50 años de edad; sin embargo, dado que es difícil de determinar la presencia de la enfermedad sin una biopsia del cerebro, que siempre es peligrosa, se desconoce el momento de su aparición. La prevalencia de la EA se incrementa con la edad, y se estima que puede llegar a verse afectada hasta el 40-50% de la población hacia los 85-90 años de edad. Evans et al., JAMA 262: 2551 (1989) ; Katzman, Neurology 43:13 (1993) .
Los estudios sugieren que el depósito de amiloide en el cerebro es un acontecimiento causal temprano durante la patogenia de la enfermedad de Alzheimer (EA) . La progresión del depósito de amiloide da lugar a la formación de placas neuríticas y ovillos neurofibrilares en regiones del cerebro que están relacionadas con el aprendizaje y la memoria. Una placa neurítica de Alzheimer típica comprende axones distróficos alrededor de un núcleo de material de amiloide. El componente principal del núcleo de amiloide es una proteína denominada amiloide-º (Aº) .
En la práctica, la EA se diagnostica definitivamente mediante la evaluación del tejido cerebral, normalmente en la autopsia. Khachaturian, Arch. Neurol. 42: 1097 (1985) ; McKhann et al., Neurology 34; 939 (1984) . Desde el punto de vista neuropatológico, esta enfermedad se caracteriza por la presencia de placas neuríticas (PN) , ovillos neurofibrilares (ONF) y neuropenia, junto con otros muchos hallazgos. Mann, Mech. Ageing Dev. 31: 213 (1985) . Los cortes de tejido encefálico tras la muerte de los enfermos de Alzheimer muestran la presencia de la amiloide en forma de núcleos extracelulares proteínicos de las placas neuríticas que caracterizan la EA.
Los núcleos de amiloide de estas placas neuríticas están formados por una proteína llamada amiloide º (Aº) cuya disposición predominante es en una configuración de lámina de hojas º. Mori et al., Journal of Biological Chemistr y 267: 17082 (1992) ; Kirschner et al., PNAS 83: 503 (1986) . Las placas neuríticas son un aspecto temprano e invariable de la enfermedad. Mann et al., J. Neurol. Sci. 89: 169; Mann, Mech. Ageing Dev. 31: 213 (1985) ; Terr y et al., J. Neuropathol. Exp. Neurol. 46: 262 (1987) .
El depósito inicial de la Aº probablemente se produce mucho antes de que los síntomas clínicos sean apreciables. Los "criterios microscópicos mínimos" recomendados en la actualidad para el diagnóstico de la EA se basan en el número de placas neuríticas encontradas en el cerebro. Khachaturian, Arch. Neurol. (1985) , véase más arriba. Sin embargo, la valoración del número de placas neuríticas hay que retrasarlo hasta después de la muerte.
Las placas neuríticas que contienen la amiloide son una característica prominente de determinadas áreas del cerebro de la EA, así como del síndrome de Down y de las personas homocigotas para el alelo apolipoproteína E4, que son muy propensas a desarrollar la EA. Corder et al., Science 261: 921 (1993) ; Divr y , P., J. Neurol. Psych. 27: 643-657 (1927) ; Wisniewski et al., en Zimmerman, H. M. (ed.) : Progress in Neuropathology (Grune y Stratton, N.Y. 1973) págs. 1-26.
La amiloide en el cerebro se pone de manifiesto con facilidad mediante la tinción de cortes del cerebro con tioflavina S o rojo Congo. Puchtler et al., J. Histochem. Cytochem. 10: 35 (1962) . La amiloide teñida con rojo Congo se caracteriza por una apariencia dicroica, que muestra un color de polarización amarillo-verdoso. La fijación dicroica es el resultado de una estructura de lámina de hojas º de las proteínas amiloides. Glenner, G. N. Eng. J. Med. 302: 1283 (1980) . Se puede encontrar una explicación detallada de la bioquímica y de la histoquímica de la amiloide en Glenner. N. Eng. J. Med., 302: 1333 (1980) .
Hasta ahora, el diagnóstico de la EA se ha conseguido principalmente mediante la evaluación de criterios clínicos, biopsias del cerebro y estudios hitológicos tras la muerte. Los esfuerzos en la investigación para el desarrollo de métodos para diagnosticar la enfermedad de Alzheimer in vivo incluyen pruebas genéticas, métodos de inmunoensayo y técnicas de diagnóstico por imagen.
Las pruebas de que las anomalías del metabolismo de la Aº son necesarias y suficientes para el desarrollo de la EA se basan en el descubrimiento de mutaciones puntuales en la proteína precursora Aº en varias familias infrecuentes con una forma dominante autosómica de EA. Hardy, Nature Genetics, 1: 233 (1992) ; Hardy et al., Science 256: 184 (1992) . Estas mutaciones aparecen cerca de los puntos de escisión del extremo amino y del extremo carboxilo necesarios para la generación de la Aº a partir de su proteína precursora. St. George-Hyslop et al., Science 235: 885 (1987) ; Kang et al., Nature 325: 733 (1987) ; Potter, patente internacional WO 92/17152. Sin embargo, el análisis genético de un gran número de familias de EA ha demostrado que la EA es heterogénea desde el punto de vista genético. St. George-Hyslop et al., Nature 347: 194 (1990) . El ligamiento a los marcadores del cromosoma 21 se ha demostrado sólo en algunas familias de EA de aparición precoz, y en ninguna familia de EA de aparición tardía. Más recientemente, Sherrington et al., Nature, 375: 754-760 (1995) han identificado un gen en el cromosoma 14 cuyo producto se predice que contiene varios dominios transmembranarios y que se parece a una proteína integral de la membrana. Este gen puede dar cuenta de hasta el 70% de las EA dominantes autosómicas de aparición temprana. Los datos preliminares sugieren que la mutación de este cromosoma 14 ocasiona un incremento de la síntesis de la Aº. Scheuner et al., Soc. Neurosci. Abstr. 21: 1500 (1995) . Se ha identificado una mutación en un gen muy similar en el cromosoma 1 de los alemanes emparentados de la región del Volga con una EA de aparición temprana. Levy-Lahad et al., Science 269: 973-977 (1995) .
Se ha sugerido que la detección selectiva de genotipos con apolipoproteína E proporciona una ayuda para el diagnóstico de la EA. Scott. Nature, 366: 502 (1993) ; Roses, Ann. Neurol. 38: 6-14 (1995) . Sin embargo, surgen dificultades con esta tecnología, porque el alelo apolipoproteína E4 es sólo un factor de riesgo para la EA, no un marcador de la enfermedad. Está ausente en muchos pacientes con EA y presente en muchas personas ancianas sin demencia. Bird, Ann. Neurol. 38: 2-4 (1995) .
Se han desarrollado métodos de inmunoensayo para detectar la presencia de marcadores neuroquímicos en los pacientes con la EA y para detectar una proteína amiloide relacionada con la EA en el líquido cefalorraquídeo. Warner, Anal. Chem. 59: 1203A (1987) ; patente internacional nº 92/17152 de Potter; Glenner et al., patente de los EE.UU. nº 4 666 829. Estos métodos para el diagnóstico de la EA no se ha demostrado que detecten la EA en todos los pacientes, en particular en las etapas iniciales de la enfermedad, y son relativamente invasivos al requerir una punción lumbar. También se ha intentado desarrollar anticuerpos monoclonales como sondas para los diagnósticos por imagen de la Aº. Majocha et al., J. Nucl. Med., 33: 2184 (1992) ; Majocha et al., patente internacional WO 89/06242 y Majocha et al., patente de los EE.UU. nº 5 231 000. La desventaja principal de las sondas inmunoglobulínicas es la dificultad para conseguir que estas grandes moléculas atraviesen la barrera hematoencefálica. La utilización de anticuerpos para el diagnóstico in vivo de la EA requeriría que la barrera hematoencefálica presentara anomalías notables para que pudieran llegar al cerebro. No hay ninguna prueba funcional convincente de que en la EA existan de verdad anomalías de la barrera hematoencefálica. Kalaria, Cerebrovascular & Brain Metabolism Reviews, 4: 226 (1992) .
El péptido Aº radiomarcado se ha utilizado para marcar placas difusas, compactas y de tipo neurítico en los cortes... [Seguir leyendo]
Reivindicaciones:
1. Compuesto de fijación a amiloide de fórmula (I) o una sal farmacéuticamente aceptable del mismo:
en el que Y es F, CI, Br, I, O- (CR''2) n-X, o - (CR''2) n-X; en el que X es F, Cl, Br o I; y n es 1 a 5; R' es H o un grupo alquilo (C1-8) ;
R'' es H o un grupo alquilo (C1-8) ; R3 a R10 se seleccionan independientemente entre el grupo que consiste en H, F, Cl, Br, I, alquilo (C1-C5) , (CH2) 1-3-OR11, CF3, - (CH2) 1-3-X, -O- (CH2) 1-3-X, CN, -CO-R11, -N (R11) 2, -NR''3+, -NO2, -CO-N (R11) 2, -O- (CO) -R11, OR11, SR11, COOR11, Rph, -CR11=CR11-Rph y -C (R11) 2-C (R11) 2-Rph, en el que X es F, Cl, Br o I; y Rph es fenilo opcionalmente sustituido con uno o más sustituyentes seleccionados entre el grupo que consiste en F, Cl, Br, I, alquilo (C1-C5) , (CH2) 1-3-O-R11, CF3, - (CH2) 1-3-X, -O- (CH2) 1-3-X, CN, -CO-R11, -N (R11) 2, -CO-N (R11) 2, -O- (CO) -R11, OR11, SR11 y COOR11, en el que cada R11 es independientemente H o alquilo (C1-C5) ; y Y o R3-R10 comprenden al menos una marcación detectable seleccionada entre el grupo que consiste en 131l, 123l, 124l, 125l, 76Br, 75Br, 18F, 19F, 11C, 13C, 14C y 3H.
2. Compuesto de fijación a amiloide de acuerdo con la reivindicación 1, en el que cada uno de R3, R4, R5 y R6, R7 y R10 es H, y R8 y R9 son independientemente OR11.
3. Compuesto de fijación a amiloide de acuerdo con la reivindicación 2, en el que Y comprende al menos una marcación detectable.
4. Compuesto de fijación a amiloide de acuerdo con la reivindicación 2 que tiene la fórmula siguiente:
5. Composición farmacéutica que comprende
(i) una cantidad eficaz de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4; y
(ii) un vehículo farmacéuticamente aceptable.
6. Compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, para uso en un método de detección de depósito o depósitos de amiloide in vivo, comprendiendo dicho método:
(i) administrar a un mamífero una cantidad eficaz de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, en donde el compuesto puede fijarse a cualquier depósito o depósitos de amiloide en el mamífero; y
(ii) detectar la fijación del compuesto al depósito o depósitos de amiloide en el mamífero.
7. Compuesto para uso en un método de acuerdo con la reivindicación 6, en el que el depósito o depósitos de amiloide están localizados en el cerebro del mamífero.
8. Compuesto para uso en un método de acuerdo con la reivindicación 7, en el que el mamífero es un humano que se sospecha que tiene la enfermedad de Alzheimer, la enfermedad de Alzheimer familiar, el síndrome de Down o que es homocigoto para el alelo apolipoproteína E4.
9. Método de detección de depósito o depósitos de amiloide in vitro que comprende:
(i) poner en contacto un tejido corporal con una cantidad eficaz de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, en donde el compuesto se puede fijar a todo depósito o depósitos de amiloide en el tejido; y
(ii) detectar la fijación del compuesto al depósito o depósitos de amiloide en el tejido.
10. Método de acuerdo con la reivindicación 9, en donde el método comprende adicionalmente:
(iii) separar del tejido el depósito o depósitos de amiloide fijados al compuesto; y
(iv) cuantificar el depósito o depósitos de amiloide fijados al compuesto.
11. Compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, para uso en un método que permite diferenciar entre un cerebro enfermo de Alzheimer y un cerebro normal que comprende:
(i) obtener tejidos de (i) el cerebelo y de (ii) otra área del mismo cerebro, de un mamífero normal y de un mamífero que se sospecha que tiene la enfermedad de Alzheimer;
(ii) poner en contacto los tejidos con un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4;
(iii) cuantificar la amiloide fijada al compuesto;
(iv) calcular la proporción entre (a) la cantidad de amiloide en el área del cerebro que no corresponde al cerebelo y (b) la cantidad de amiloide en el cerebelo; y
(v) comparar la proporción para un mamífero normal con la proporción para un mamífero del que se sospecha que tiene la enfermedad de Alzheimer.
12. Compuesto de fijación a amiloide de acuerdo con la reivindicación 11, en el que la proporción entre (i) la fijación del compuesto a un área del cerebro que no corresponda al cerebelo y (ii) la fijación del compuesto al cerebelo, en un sujeto, se compara con la proporción para los sujetos normales.
13. Método de detección de depósitos de amiloide en tejido de animal o de humano obtenido por biopsia o autopsia que comprende las etapas de:
(a) incubar el tejido fijado en formol o congelado en fresco con una solución de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o de una sal farmacéuticamente aceptable del mismo para formar un depósito marcado; y
(b) detectar el depósito marcado.
14. Método para cuantificar la cantidad de amiloide en el tejido obtenido por biopsia o autopsia que comprende las etapas de:
a) incubar un derivado radiomarcado de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o de una sal farmacéuticamente aceptable del mismo con un homogeneizado de tejido obtenido por biopsia o por autopsia, en el que al menos uno de los sustituyentes en el compuesto está marcado con una radiomarcación seleccionada entre el grupo que consiste en 125l, 3H, y un sustituyente con carbono, en el que al menos un carbono es 14C;
b) separar el derivado radiomarcado del compuesto fijado al tejido del que no está fijado al tejido, c) cuantificar el derivado radiomarcado del compuesto fijado al tejido, y d) convertir las unidades de derivado radiomarcado del compuesto fijado al tejido en unidades de microgramos de amiloide por 100 mg de tejido por comparación con un estándar.
15. Método para fijar selectivamente un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o una sal farmacéuticamente aceptable del mismo a placas de amiloide, pero no a ovillos neurofibrilares, en el tejido encefálico que contiene a ambos, comprendiendo dicho método la puesta en contacto de las placas de amiloide, en ensayos de tinción o fijación in vitro, con un compuesto de acuerdo con una cualquiera de las reivindicaciones 1-4 a una concentración por debajo de unos 10 nM.
16. Compuesto de fijación a amiloide de acuerdo a una cualquiera de las reivindicaciones 1-4 para uso en un método de fijación selectiva in vivo de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o de una sal farmacéuticamente aceptable del mismo a placas de amiloide, pero no a ovillos neurofibrilares, en el tejido encefálico que contiene a ambos, comprendiendo dicho método la administración de una cantidad eficaz de un compuesto de acuerdo con una cualquiera de las reivindicaciones 1-4 o de una sal farmacéuticamente aceptable del mismo de tal forma que la concentración sanguínea del compuesto administrado permanezca por debajo de unos 10 nM in vivo.
17. Compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 para uso en un método in vivo o in vitro de detección en un sujeto de al menos un depósito de amiloide que comprende al menos una proteína amiloidógena, comprendiendo dicho método las etapas de:
(a) administrar, a un sujeto que padece una enfermedad relacionada con una amiloidosis, una cantidad detectable de una composición farmacéutica que comprende al menos un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o una sal farmacéuticamente aceptable del mismo y un vehículo farmacéuticamente aceptable; y
(b) detectar la fijación del compuesto a un depósito de amiloide que comprende al menos una proteína amiloidógena.
18. Compuesto para uso en un método de acuerdo con la reivindicación 17, en el que el sujeto padece una enfermedad relacionada con una amiloidosis sistémica.
19. Compuesto para uso en un método de acuerdo con la reivindicación 18, en el que al menos un depósito de amiloide está localizado en tejido seleccionado entre el grupo que consiste en nervio periférico, piel, lengua, corazón
o hígado.
20. Compuesto para uso en un método de acuerdo con la reivindicación 18, en el que al menos un depósito de amiloide está localizado en un órgano parenquimatoso.
21. Compuesto para uso en un método de acuerdo con la reivindicación 20, en el que el órgano se selecciona entre el grupo que consiste en bazo, riñón, hígado y glándula suprarrenal.
22. Compuesto para uso en un método de acuerdo con la reivindicación 18, en el que la enfermedad relacionada con una amiloidosis sistémica se selecciona entre el grupo que consiste en mieloma múltiple, macroglobulinemia, linfoma, enfermedad inflamatoria crónica, artritis reumatoide, enfermedad infecciosa, dermatomiositis, esclerodermia, enfermedad de Crohn, colitis ulcerosa, tuberculosis, osteomielitis crónica, bronquiectasia, absceso cutáneo, absceso pulmonar, cáncer, enfermedad de Hodgkin, amiloidosis heredofamiliar, fiebre mediterránea familiar, demencia familiar y polineuropatía amiloide familiar.
23. Compuesto para uso en un método de acuerdo con la reivindicación 17, en el que el sujeto está recibiendo hemodiálisis para la insuficiencia renal crónica.
24. Compuesto para uso en un método de acuerdo con la reivindicación 17, en el que el sujeto padece una enfermedad relacionada con una amiloidosis localizada.
25. Compuesto para uso en un método de acuerdo con la reivindicación 24, en el que al menos un depósito de amiloide está localizado en el páncreas.
26. Compuesto para uso en un método de acuerdo con la reivindicación 24, en el que la enfermedad relacionada
con una amiloidosis localizada se selecciona entre el grupo que consiste en mieloma primario, demencia familiar, encefalopatías espongiformes, tumor tiroideo de células C, insulinoma, prolactinoma y tumor de Pindborg.
27. Compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, para uso en un método de identificación de un paciente como prodrómico de una enfermedad relacionada con un depósito de amiloide, que comprende:
A) administrar al paciente, que presenta signos de demencia clínica o signos clínicos de un trastorno cognitivo leve, un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o una sal farmacéuticamente aceptable del mismo; luego B) tomar imágenes de dicho paciente para obtener datos;
y C) analizar dichos datos para evaluar la cantidad de amiloide en dicho paciente por referencia a una cantidad normal, por lo que se identifica a dicho paciente como prodrómico de una enfermedad relacionada con un depósito de amiloide.
28. Compuesto para uso en un método de acuerdo con la reivindicación 27, en el que el paciente tiene un diagnóstico de trastorno cognitivo leve.
29. Compuesto para uso en un método de acuerdo con la reivindicación 27, en el que la enfermedad amiloide es la enfermedad de Alzheimer.
30. Compuesto para uso en un método de acuerdo con la reivindicación 27, en donde dichos datos indican que un trastorno de demencia de origen incierto está provocado por una enfermedad relacionada con un depósito de amiloide.
31. Compuesto para uso en un método de acuerdo con la reivindicación 27, que comprende la distinción entre la enfermedad de Alzheimer y la demencia frontotemporal.
32. Compuesto para uso en un método de acuerdo con la reivindicación 27, que comprende adicionalmente la vigilancia de dicho paciente para detectar la aparición de la enfermedad de Alzheimer.
33. Compuesto para uso en un método de acuerdo con la reivindicación 27, que comprende el diagnóstico de la enfermedad de Alzheimer en un paciente diagnosticado clínicamente con un trastorno cognitivo leve.
34. Compuesto para uso en un método de acuerdo con la reivindicación 27, en el que el paciente presenta un trastorno de demencia de origen incierto.
35. Compuesto para uso en un método de acuerdo con la reivindicación 27 o 34, en el que el paciente tiene una EA sin diagnosticar.
36. Compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4, para uso en un método de determinación de la eficacia terapéutica del tratamiento de la amiloidosis, que comprende:
A) administrar a un paciente que lo necesita una cantidad eficaz de un compuesto de fijación a amiloide de acuerdo con una cualquiera de las reivindicaciones 1-4 o una sal farmacéuticamente aceptable del mismo;
B) tomar imágenes de dicho paciente; luego C) administrar a dicho paciente que lo necesita al menos un fármaco antiamiloide;
D) posteriormente, administrar a dicho paciente que lo necesita una cantidad eficaz de un compuesto de acuerdo con una cualquiera de las reivindicaciones 1-4;
E) tomar imágenes de dicho paciente; y F) comparar la cantidad de depósitos de amiloide en dicho paciente antes del tratamiento con dicho al menos un fármaco antiamiloide con la cantidad de depósitos de amiloide en dicho paciente después del tratamiento con dicho al menos un fármaco antiamiloide.
37. Compuesto para uso en un método de acuerdo con la reivindicación 36, en el que dicha amiloidosis es la EA.
Patentes similares o relacionadas:
Método para la preparación de derivados de 4-sustituido-2,3-dihidro-1-benzofurano mediante la ciclación de sales de 2-(2-diazonio-6-sustituido fenil)-etanol, del 29 de Julio de 2020, de BAYER CROPSCIENCE AKTIENGESELLSCHAFT: Método para preparar derivados de 2,3-dihidro-1-benzofurano sustituido de la fórmula (I): **(Ver fórmula)** en la cual R1 es Cl (Ia), Br (Ib) o metilo (Ic), […]
Compuestos de alquilamido y usos de los mismos, del 6 de Mayo de 2020, de Nogra Pharma Limited: Compuesto de fórmula: **(Ver fórmula)** que presenta una configuración S, o una sal farmacéuticamente aceptable del mismo, para la utilización en el […]
Moduladores de GPR120 de ácido biciclo[2.2.2], del 30 de Octubre de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I): **(Ver fórmula)** o un estereoisómero, un tautómero o una sal farmacéuticamente aceptable del mismo, en la que: L1 […]
Inhibidores de quinurenina-3-monooxigenasa, composiciones farmacéuticas, y método de uso de los mismos, del 7 de Agosto de 2019, de CHDI Foundation, Inc: Un compuesto de fórmula:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Donadores de nitroxilo de N-hidroximetanosulfonamida, del 29 de Mayo de 2019, de Cardioxyl Pharmaceuticals Inc: Un compuesto de Fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo, en donde: cada X se selecciona independientemente entre el grupo que […]
Nuevos compuestos organolépticos, del 16 de Mayo de 2019, de INTERNATIONAL FLAVORS & FRAGRANCES INC.: Un compuesto, 5-etoxi-3-metil-2,3-dihidro-benzofurano.
Aminas terciarias para su uso en el tratamiento de trastornos cardíacos, del 17 de Abril de 2019, de UNIVERSITETET I OSLO: Un compuesto de fórmula (I) o una sal fisiológicamente aceptable del mismo para su uso en el tratamiento o la prevención de la insuficiencia cardíaca […]
Compuestos inmunomoduladores y antiinflamatorios novedosos, del 27 de Marzo de 2019, de Incozen Therapeutics Pvt. Ltd: Un compuesto de fórmula (I)**Fórmula** o un tautómero, estereoisómero (tal como un enantiómero o diastereómero), sal farmacéuticamente aceptable, o Nóxido del mismo, en […]