Composiciones y procedimientos que utilizan los anticuerpos anti-CS1 para tratar el mieloma múltiple.
Anticuerpo IgG1 antiCS1 humanizado y uno o dos agentes terapéuticos para su utilización simultánea,
separada osecuencial en el tratamiento del mieloma múltiple, en los que dicho anticuerpo presenta la secuencia de la regiónvariable de cadena pesada de la SEC. ID. nº 5 y la secuencia de la región variable de cadena ligera de la SEC. ID.nº 6, y en los que dichos uno o dos agentes terapéuticos son la dexametasona o la dexametasona y la talidomida.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/075401.
Solicitante: Abbott Biotherapeutics Corp.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1500 SEAPORT BOULEVARD REDWOOD CITY, CA 94063 ESTADOS UNIDOS DE AMERICA.
Inventor/es: AFAR,DANIEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
PDF original: ES-2391790_T3.pdf
Fragmento de la descripción:
Composiciones y procedimientos que utilizan los anticuerpos anti-CS1 para tratar el mieloma múltiple.
Antecedentes
El mieloma múltiple ("MM") representa una proliferación maligna de células plasmáticas procedentes de un único clon. Los términos mieloma múltiple y mieloma se utilizan indistintamente para referirse a la misma enfermedad. El tumor de mieloma, sus productos, y la respuesta del hospedador a éstos da como resultado numerosas disfunciones de órganos y síntomas de dolor de huesos o fracturas, insuficiencia renal, sensibilidad a la infección, anemia, hipocalcemia, y anormalidades de coagulación ocasionales, síntomas neurológicos y manifestaciones vasculares de hiperviscosidad. Véase D. Longo, en Harrison's Principles of Internal Medicine 14a edición, pág. 713 (McGraw-Hill, New York, 1998) . No existe ningún tratamiento a largo plazo eficaz actualmente para el MM. Es una enfermedad maligna de las células plasmáticas, que se manifiesta como hiperproteinemia, anemia, disfunción renal, lesiones óseas e inmunodeficiencia. El MM es difícil de diagnosticar a tiempo porque puede no resultar asintomático en la fase inicial. La enfermedad tiene un curso evolutivo con una duración media de supervivencia de seis meses cuando no se administra tratamiento. La quimioterapia general es el principal tratamiento, y la media actual de supervivencia con quimioterapia es de unos tres años, sin embargo menos del 5% viven más de 10 años (véase Anderson, K. et al., Anual Meeting Report 1999. Recent Advances in the Biology and Treatment of Multiple Myeloma (1999) ) .
Mientras que el mieloma múltiple se considera que es una enfermedad sensible a fármacos, casi todos los pacientes que responden inicialmente a la quimioterapia, finalmente sufren recaídas (véase Anderson, K. et al., Anual Meeting Report 1999. Recent Advances in the Biology and Treatment of Multiple Myeloma (1999) ) . Desde la introducción de la terapia con melfalán y prednisona para el MM, se han probado numerosas poliquimioterapias que incluyen alcaloides de las vincas, antraciclina y tratamientos a base de nitrosourea (véase Case, D.C. et al., (1977) Am. J. Med. 63:897 903) ; sin embargo, ha habido pocas mejoras en los resultados en las últimas tres décadas (véase Case, D.C. et al., (1977) Am. J. Med. 63:897 903; Otsuki, T. et al, (2000) Cancer Res. 60:1) . Se necesitan nuevos métodos de tratamiento, tales como las politerapias que utilizan anticuerpos monoclonales, agentes terapéuticos e inhibidores de moléculas pequeñas de receptores celulares y/o proteínas implicadas en MM.
Sumario
La presente invención proporciona un anticuerpo IgG1 antiCS1 humanizado y uno o dos agentes terapéuticos para utilización simultánea, separada o secuencial en el tratamiento del mieloma múltiple, en el que dicho anticuerpo tiene la secuencia de la región variable de cadena pesada de la SEC. ID. nº 5 y la secuencia de la región variable de cadena ligera de la SEC. ID. nº 6, y en los que dichos uno o dos agentes terapéuticos son dexametasona o dexametasona y talidomida. La presente invención proporciona además la utilización de un anticuerpo IgG1 antiCS1 humanizado y uno o dos agentes terapéuticos para la preparación de un medicamento destinado al tratamiento del mieloma múltiple, en el que dicho anticuerpo tiene la secuencia de la región variable de cadena pesada de la SEC. ID. nº 5 y la secuencia de la región variable de cadena ligera de la SEC. ID. nº 6, y en los que dichos agentes terapéuticos son la dexametasona o la dexametasona y la talidomida. En la presente memoria se describen composiciones y procedimientos útiles para aprovechar las propiedades antitumorales de anticuerpos antiCS1. Los anticuerpos antiCS1 que se pueden utilizar en los procedimientos y composiciones se describen en las publicaciones de las patentes US nº 2005/0025763 y nº 2006/00242961. Los anticuerpos antiCS1 se dirigen a CS1 (CD2-subconjunto 1) , que se conoce también como SLAMF7, CRACC, 19A, APEX 1- y FOAP12 (número de registro en Genbank NM_021181.3) . La CS1, es una glucoproteína que se expresa mucho en muestras de médula ósea de pacientes diagnosticados con MM. Tanto en estudios in vitro como in vivo, los anticuerpos antiCS1 presentan una actividad antimieloma importante (véase, por ejemplo, las publicaciones de las patentes US nº 2005/0025763 y nº 2006/0024296) . A título de ejemplo no limitativo, el anticuerpo antiCS1, HuLuc63 media eficazmente la lisis de células de mieloma por citotoxicidad celular dependiente de anticuerpos (CCDA) (véase, por ejemplo, la publicación de la patente US nº 2005/0025763) . En un modelo tumor de mieloma de ratón, el tratamiento con HuLuc63 redujo considerablemente la masa tumoral en más de un 50% (véase, por ejemplo, la publicación de la patente US nº 2005/0025763) .
La presente descripción se refiere a composiciones y procedimientos para tratar a los pacientes con diagnóstico de gammapatía monoclonal de significado incierto (GMSI) , mieloma latente, MM asintomático y MM sintomático, que comprenden desde recién diagnosticados hasta recidivante/resistentes al tratamiento en fase tardía. En particular, los procedimientos se refieren a la administración de una composición farmacéutica que comprende un anticuerpo antiCS1 combinado con uno o más agentes terapéuticos. Los anticuerpos antiCS1 se suelen administrar por vía intravenosa a dosis comprendidas entre 0, 5 y 20 mg/kg, desde una vez por semana a una vez al mes.
Uno o más agentes terapéuticos, tales como agentes dirigidos, agentes de quimioterapia convencional, agentes de terapia hormonal, y agentes de asistencia complementaria y/o combinaciones de los mismos, se pueden administrar simultáneamente, antes o después de la administración de un anticuerpo antiCS1. Los agentes pueden administrarse por separado o mezclados y administrarse juntos como una sola composición. La composición o composiciones se pueden administrar por cualesquier medios conocidos en la técnica.
En algunas formas de realización, la administración de las composiciones farmacéuticas descritas en la presente memoria aumenta la sensibilidad de células de mieloma múltiple a un agente terapéutico. Por ejemplo, la inclusión de un anticuerpo antiCS1, como HuLuc63, aumenta la actividad de los agentes terapéuticos, de modo que se pueden utilizar dosis más bajas que en las composiciones y procedimientos descritos en la presente memoria.
En algunas formas de realización, la administración de las composiciones farmacéuticas descritas en la presente memoria provoca por lo menos una de las respuestas beneficiosas definidas por el grupo europeo para trasplantes de sangre y médula ósea (EBMT) . Por ejemplo, la administración de las composiciones farmacéuticas descritas en la presente memoria puede producir una respuesta completa, una respuesta parcial, una respuesta mínima, ningún cambio o estabilización.
Breve descripción de las figuras
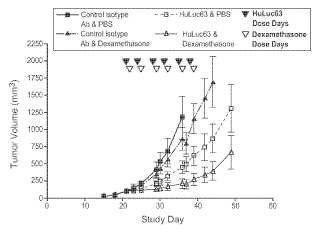
La figura 1 representa la actividad antitumoral de HuLuc63 solo y en combinación con dexametasona en un modelo de xenotrasplante de mieloma múltiple en ratón in vivo;
la figura 2 representa la actividad antitumoral de HuLuc63 solo, talidomida sola y HuLuc63 combinado con talidomida en un modelo de xenotrasplante de mieloma múltiple en ratón in vivo;
la figura 3 representa la actividad antitumoral de HuLuc63 solo, talidomida/dexametasona y HuLuc63 combinado con talidomida y dexametasona en un modelo de xenotrasplante de mieloma múltiple en ratón in vivo; y
la figura 4 representa la actividad antitumoral de HuLuc63 solo y combinado con bevacizumab en un modelo de xenotrasplante de mieloma múltiple en ratón in vivo.
Descripción detallada
Las composiciones descritas en la presente memoria combinan anticuerpos antiCS1 con uno o más agentes terapéuticos en dosis específicas para potenciar o complementar las actividades antimieloma de la otra. Los ejemplos de anticuerpos antiCS1 comprenden de manera no limitativa anticuerpos aislados que unen uno o más de los tres grupos de epítopo identificados en CS1 y los anticuerpos monoclonales producidos por las estirpes celulares de hibridoma: Luc2, Luc3, Luc15, Luc22, Luc23, Luc29, Luc32, Luc34, Luc35, Luc37, Luc38, Luc39, Luc56, Luc60, Luc63, Luc69, LucX.1, LucX.2 o Luc90. Estos anticuerpos monoclonales se denominan como los anticuerpos: Luc2, Luc3, Luc15, Luc22, Luc23, Luc29, Luc32, Luc34, Luc35, Luc37, Luc38, Luc39, Luc56, Luc60, Lug63, Luc69, LucX y Luc90, respectivamente, en lo sucesivo. Las versiones humanizadas se indican mediante el prefijo... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo IgG1 antiCS1 humanizado y uno o dos agentes terapéuticos para su utilización simultánea, separada o secuencial en el tratamiento del mieloma múltiple, en los que dicho anticuerpo presenta la secuencia de la región variable de cadena pesada de la SEC. ID. nº 5 y la secuencia de la región variable de cadena ligera de la SEC. ID. nº 6, y en los que dichos uno o dos agentes terapéuticos son la dexametasona o la dexametasona y la talidomida.
2. Anticuerpo y uno o dos agentes terapéuticos para su utilización según la reivindicación 1, en los que dicho anticuerpo se administra por vía intravenosa a una dosis desde aproximadamente 0, 5 mg/kg hasta aproximadamente 20 mg/kg.
3. Anticuerpo y uno o dos agentes terapéuticos para su utilización según la reivindicación 1 ó 2, en los que dichos anticuerpo y uno o dos agentes terapéuticos provocan una respuesta completa, definiéndose una respuesta completa como la ausencia de proteína M detectada en el suero o la orina por inmunofijación durante un mínimo de 6 semanas y menos de 5% de células plasmáticas en la médula ósea.
4. Anticuerpo y uno o dos agentes terapéuticos para su utilización según la reivindicación 1 ó 2, en los que dichos anticuerpo y uno o dos agentes terapéuticos provocan una disminución superior a 90% de la proteína M.
5. Anticuerpo y uno o dos agentes terapéuticos para su utilización según la reivindicación 1 ó 2, en los que dichos anticuerpo y uno o dos agentes terapéuticos provocan una reducción superior a 50% de la concentración de la proteína M sérica y/o una reducción de 90% de la excreción de cadena ligera libre en la orina o la reducción a menos de 200 mg/24h durante 6 semanas.
6. Anticuerpo y uno o dos agentes terapéuticos para su utilización según la reivindicación 1 ó 2, en los que dichos anticuerpo y uno o dos agentes terapéuticos provocan una reducción de 25 a 49% de la concentración de la proteína M sérica y/o una reducción de 50 a 89% de la excreción de cadena ligera libre en la orina que supera todavía 200 mg/24h durante 6 semanas.
7. Utilización de un anticuerpo IgG1 antiCS1 humanizado y uno o dos agentes terapéuticos para la preparación de un medicamento destinado al tratamiento del mieloma múltiple, en la que dicho anticuerpo presenta la secuencia de la región variable de cadena pesada de la SEC. ID. nº 5 y la secuencia de la región variable de cadena ligera de la SEC. ID. nº 6, y en la que dichos agentes terapéuticos son la dexametasona o la dexametasona y la talidomida.
8. Utilización según la reivindicación 7, en la que dicho anticuerpo se administra por vía intravenosa a una dosis desde aproximadamente 0, 5 mg/kg a aproximadamente 20 mg/kg.
9. Utilización según la reivindicación 7 ó 8, en la que dichos anticuerpo y uno o dos agentes terapéuticos provocan una respuesta completa, definiéndose una respuesta completa como la ausencia de proteína M detectada en el suero o la orina por inmunofijación durante un mínimo de 6 semanas y menos de 5% de células plasmáticas en la médula ósea.
10. Utilización según la reivindicación 7 u 8, en la que dichos anticuerpo y uno o dos agentes terapéuticos provocan una disminución superior a 90% de la proteína M.
11. Utilización según la reivindicación 7 u 8, en la que dichos anticuerpo y uno o dos agentes terapéuticos provocan una reducción superior a 50% de la concentración de proteína M sérica y/o la reducción de 90% de la excreción de cadena ligera libre en la orina o una reducción a menos de 200 mg/24 h durante 6 semanas.
12. Utilización según la reivindicación 7 u 8, en la que dichos anticuerpo y uno o dos agentes terapéuticos provocan una reducción de 25 a 49% de la concentración de proteína M sérica y/o una reducción de 50 a 89% de la excreción de cadena ligera libre en la orina que supera todavía 200 mg/24 h durante 6 semanas.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]