Amplificación y detección de múltiplex.
Un procedimiento para ensayar una muestra para uno o más ácidos nucleicos diana,
comprendiendo dichoprocedimiento:
(a) poner en contacto una muestra que comprende uno o más ácidos nucleicos diana con una mezcla de reacciónde amplificación que comprende:
(i) uno o más pares de cebadores de oligonucleótidos directos/inversos, en el que los pares de cebadores puedenamplificar uno o más ácidos nucleicos diana, si están presentes en la muestra,
(ii) dos o más sondas, en el que cada sonda comprende:un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de unácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a lasegunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar unaporción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/puedenproducir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre elprimer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes conespectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre elprimer y segundo oligonucleótidos de cada una de tales sondas son diferentes;
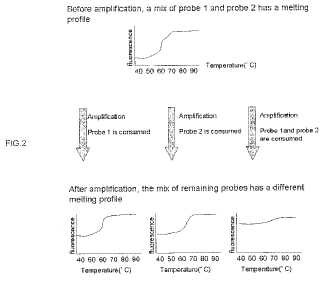
(b) realizar una reacción de amplificación en la muestra/mezcla de reacción bajo condiciones de amplificación, en elque, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de sondas que sonsustancialmente complementarios a parte de ese ácido nucleico diana se hibridan con el ácido nucleico diana,consumiéndose así, en el que los oligonucleótidos consumidos de sondas ya no pueden participar más en formar laporción bicatenaria (el dúplex) de la sonda; y
(c) medir, al menos una vez, el perfil de fusión de las porciones bicatenarias entre el primer y segundooligonucleótidos de sondas sin consumir en la mezcla de reacción detectando la(s) señal(es) de las marcas enaquellas sondas en función de la temperatura,
en el que el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana está presente o no endicha muestra,
en el que una primera sonda de dichas al menos dos de las sondas tiene una temperatura de fusión Tm1 en términosde su porción bicatenaria,
en el que una segunda sonda de dichas al menos dos de las sondas tiene una temperatura de fusión Tm2 entérminos de su porción bicatenaria,
en el que Tm1>Tm2,
en el que las mismas marcas están independientemente unidas a las primera y segunda sondas, en el que unareducción de cualquier pico de fusión en Tm1 y/o Tm2 proporciona indicación de consumo de la primera y/o segundasonda(s).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2009/001897.
Solicitante: OXITEC LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 71 Milton Park, Abingdon / Oxfordshire OX14 4RX.
Inventor/es: FU,GUOLIANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2396044_T3.pdf
Fragmento de la descripción:
Amplificación y detección de múltiplex
La presente invención se refiere al campo de la detección de múltiplex. En particular, la invención se refiere a procedimientos para ensayar una muestra para una o más dianas de ácido nucleico en una única reacción basada en las distintas temperaturas de fusión o perfiles de fusión de sondas. La invención también proporciona sondas y kits para su uso en tales procedimientos.
La PCR de múltiplex, que usa múltiples pares de cebadores para amplificar simultáneamente múltiples secuencias diana en una única reacción de PCR, es un enfoque más eficiente para la PCR que la PCR de pares de cebadores individuales convencional. La amplificación simultánea de diversas dianas reduce tanto el coste como el tiempo de devolución del análisis por PCR, minimiza variaciones experimentales y el riesgo de contaminación cruzada y aumenta la fiabilidad de resultados finales. La PCR de múltiplex se ha usado en muchas áreas de ensayo de ADN que incluyen identificación de microorganismos, análisis de expresión génica, análisis de mutación y polimorfismo, genotipado y análisis de matrices de ADN y detección de ARN.
La PCR en tiempo real ha sido desarrollada para cuantificar productos amplificados durante reacciones de PCR. La PCR en tiempo real se basa en los principios de que la emisión de fluorescencia de colorantes directa o indirectamente asociados a la formación de amplicones recientemente sintetizados o la hibridación de cebadores con moldes de ADN puede detectarse y es proporcional a la cantidad de amplicones en cada ciclo de PCR. La PCR en tiempo real se lleva a cabo en un formato de tubo cerrado y es cuantitativa. Actualmente están disponibles varios procedimientos para realizar la PCR en tiempo real, tales como utilizar sondas TaqMan (patentes de EE.UU. nº
5.210.015 y 5.487.972, y Lee y col., Nucleic Acids Res. 21:3761-6, 1993) , balizas moleculares (patentes de EE.UU. nº 5.925.517 y 6.103.476, y Tyagi y Kramer, Nat. Biotechnol. 14:303-8, 1996) , amplicones auto-sondantes (escorpiones) (patente de EE.UU. nº 6.326.145, y Whitcombe y col., Nat. Biotechnol. 17:804-7, 1999) , Amplisensor (Chen y col., Appl. Environ. Microbiol. 64:4210-6, 1998) , Amplifluor (patente de EE.UU. nº 6.117.635 y Nazarenko y col., Nucleic Acids Res. 25:2516-21, 1997, sondas de hibridación de desplazamiento (Li y col., Nucleic Acids Res. 30:E5, 2002) ; DzyNA-PCR (Todd y col., Clin. Chem. 46:625-30, 2000) , detección de enzimas de restricción fluorescentes (Cairns y col. Biochem. Biophys. Res. Commun. 318:684-90, 2004) y sondas de hibridación adyacentes (patente de EE.UU. nº 6.174.670 y Wittwer y col., Biotechniques 22:130-1, 134-8, 1997) . La mayoría de estas sondas consisten en un par de colorantes (un colorante indicador y un colorante aceptor) que participan en transferencia de energía por resonancia de fluorescencia (FRET) , por lo cual el colorante aceptor extingue la emisión del colorante indicador. En general, las sondas marcadas con fluorescencia aumentan la especificidad de la cuantificación de amplicones.
Otra forma de sonda usada en PCR es una sonda lineal bicatenaria que tiene dos oligonucleótidos complementarios. Las sondas descritas en la técnica anterior han sido de igual longitud, actuando al menos uno de los oligonucleótidos de sonda para una secuencia diana en una conformación monocatenaria. El extremo 5' de uno de los oligonucleótidos se marca con un fluoróforo y el extremo 3' del otro oligonucleótido se marca con un extintor, por ejemplo, un fluoróforo aceptor, o viceversa. Cuando estos dos oligonucleótidos se hibridan entre sí, las dos marcas están próximas la una a la otra, extinguiendo así la fluorescencia. Sin embargo, los ácidos nucleicos diana compiten por la unión a la sonda, produciendo un aumento inferior al proporcional de la fluorescencia de la sonda con concentración de ácido nucleico diana creciente (Morrison L. y col., Anal. Biochem., vol. 183, páginas 231-244 (1989) ; documento US 5.928.862) .
Las sondas lineales bicatenarias modificadas por acortamiento de uno de los dos oligonucleótidos complementarios por algunas bases para preparar una sonda lineal parcialmente bicatenaria también se conocen en la técnica. En tales sondas lineales bicatenarias en la técnica anterior, el oligonucleótido más largo se ha marcado en el extremo con un fluoróforo y el oligonucleótido ligeramente más corto se ha marcado en el extremo con un extintor. En la forma bicatenaria, la sonda es menos fluorescente debido a la estrecha proximidad del fluoróforo y el extintor. Sin embargo, en presencia de una diana, el oligonucleótido del extintor más corto es desplazado por la diana. Como resultado, el oligonucleótido más largo (en forma de híbrido de sonda-diana) se vuelve sustancialmente más fluorescente (Li y col., Nucleic Acids Research, vol. 30, nº 2, e5 (2002) ) .
El documento US 2005/0227257 describe una sonda de ácido nucleico lineal bicatenaria ligeramente modificada. La sonda descrita en la presente solicitud de patente se modifica acortando uno de los dos oligonucleótidos complementarios por más bases, en comparación con el anterior, para preparar una sonda lineal parcialmente bicatenaria.
Las sondas de hibridación fluorescentes también se han usado en otros campos. Por ejemplo, se han descrito procedimientos para el genotipado de múltiplex usando sondas de hibridación fluorescentes (por ejemplo, documento US 6.140.054) que usan la temperatura de fusión de sondas de hibridación fluorescentes que se hibridan con una región elegida como diana amplificada por PCR de secuencia de genoma/ácidos nucleicos para identificar mutaciones y polimorfismos.
Luk y col. (Journal of Virological Methods 144:1-11, 2007) describe sondas de ADN lineales parcialmente bicatenarias para la detección de dianas genéticamente polimórficas.
Huang y col. (Nucleic Acids Res. 35 (16) :E101, 2007) describe sondas de ADN lineales parcialmente bicatenarias termodinámicamente moduladas para PCR en tiempo real homólogo.
La aparición de pruebas genéticas de alta resolución ha necesitado análisis tanto cualitativo como cuantitativo de múltiples genes y ha conducido a la convergencia de la PCR de múltiplex y PCR en tiempo real en la PCR de múltiplex en tiempo real. Como los colorantes intercalantes de ADN bicatenario no son adecuados para la multiplexación debido a su no especificidad, las sondas marcadas con fluorescencia han hecho que sea posible la PCR de múltiplex en tiempo real. Sin embargo, la PCR de múltiplex en tiempo real está limitada por la disponibilidad de combinaciones de colorantes de fluorescencia. Actualmente, sólo pueden detectarse y cuantificarse hasta cuatro o cinco colorantes de fluorescencia simultáneamente en PCR en tiempo real.
El documento US2005/0053950 describe un protocolo para cuantificar reacciones en cadena de la polimerasa (PCR) en tiempo real de múltiplex. Los procedimientos cuantifican múltiples productos de PCR o amplicones en una única reacción de PCR en tiempo real basándose en las diferentes temperaturas de fusión (Tm) de cada amplicón y los cambios de emisión de colorantes de ADN bicatenarios tales como SYBR Green I cuando los amplicones están en dúplex o en separación. Para un amplicón específico con una Tm, la diferencia de emisión entre la lectura de emisión tomada a una temperatura por debajo de Tm y la lectura de emisión a una temperatura por encima de Tm se corresponde con el valor de emisión del amplicón en el dúplex. Por consiguiente, la diferencia de emisión de cada amplicón en una única reacción de PCR puede usarse para cuantificar cada amplicón. Sin embargo, la multiplexidad y sensibilidad de tales procedimientos puede ser relativamente baja. Por ejemplo, la diferencia en las temperaturas de fusión entre amplicones del orden de 100-150 nucleótidos de longitud es pequeña. Por tanto, estas técnicas requieren el uso de amplicones con grandes diferencias en sus tamaños con el fin de poder distinguir entre ellas.
Sin embargo, existe la necesidad de desarrollar otros procedimientos de amplificación y cuantificación de múltiples secuencias diana en una única reacción de PCR para PCR en tiempo real de múltiplex con mayores niveles de multiplexidad y sensibilidad.
El procedimiento de la presente invención se diferencia de las tecnologías de la técnica anterior. En primer lugar, el procedimiento se basa en las diferentes propiedades de fusión (Tm o perfil de fusión) de cada sonda y los cambios de emisión de marcas con respecto a la sonda cuando las porciones bicatenarias internas de la sonda están en dúplex o en separación. La sonda usada en la presente invención comprende una porción bicatenaria que puede formarse por un primer... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para ensayar una muestra para uno o más ácidos nucleicos diana, comprendiendo dicho procedimiento:
(a) poner en contacto una muestra que comprende uno o más ácidos nucleicos diana con una mezcla de reacción de amplificación que comprende:
(i) uno o más pares de cebadores de oligonucleótidos directos/inversos, en el que los pares de cebadores pueden amplificar uno o más ácidos nucleicos diana, si están presentes en la muestra,
(ii) dos o más sondas, en el que cada sonda comprende:
un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes;
(b) realizar una reacción de amplificación en la muestra/mezcla de reacción bajo condiciones de amplificación, en el que, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de sondas que son sustancialmente complementarios a parte de ese ácido nucleico diana se hibridan con el ácido nucleico diana, consumiéndose así, en el que los oligonucleótidos consumidos de sondas ya no pueden participar más en formar la porción bicatenaria (el dúplex) de la sonda; y
(c) medir, al menos una vez, el perfil de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de sondas sin consumir en la mezcla de reacción detectando la (s) señal (es) de las marcas en aquellas sondas en función de la temperatura,
en el que el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana está presente o no en dicha muestra,
en el que una primera sonda de dichas al menos dos de las sondas tiene una temperatura de fusión Tm1 en términos de su porción bicatenaria,
en el que una segunda sonda de dichas al menos dos de las sondas tiene una temperatura de fusión Tm2 en términos de su porción bicatenaria,
en el que Tm1>Tm2,
en el que las mismas marcas están independientemente unidas a las primera y segunda sondas, en el que una reducción de cualquier pico de fusión en Tm1 y/o Tm2 proporciona indicación de consumo de la primera y/o segunda sonda (s) .
2. Un procedimiento según la reivindicación 1, en el que:
(A) dicho perfil de fusión se mide antes de que tenga lugar la reacción/amplificación (perfil de fusión de preamplificación) , y/o se mide después de completarse la reacción/amplificación (perfil de fusión de post-amplificación) , y/o se mide durante la reacción/amplificación en cada ciclo o ciclos seleccionados (perfil de fusión de semiamplificación) ,
(i) comparar al menos dos perfiles de fusión obtenidos en (c)
(ii) comparar un perfil de fusión obtenido en la etapa (c)
en el que dicho procedimiento comprende adicionalmente la etapa (d)
y/o con un perfil de fusión previamente obtenido de las mismas sondas o con un perfil de fusión de las mismas sondas obtenido en paralelo al mismo tiempo en reacciones de control, o con un perfil de fusión teórico de las mismas sondas en el que un cambio en el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana está presente o no en dicha muestra/mezcla de reacción,
en el que dicho perfil de fusión de pre-amplificación se mide en el mismo recipiente de reacción antes del inicio de la reacción/amplificación, o se mide en un recipiente de reacción separado cuando no tiene lugar la amplificación debido a que esa mezcla de reacción carece de uno o más componentes necesarios para la reacción/amplificación,
en el que en la etapa (d) el perfil de fusión de post-amplificación o semi-amplificación se compara con el perfil de fusión de pre-amplificación del dúplex de sondas para determinar si una sonda particular se consume, siendo esto indicativo de la presencia de la diana correspondiente en la muestra,
preferentemente (A1) en el que al menos una marca detectable es una marca fluorescente, en el que la etapa (b) comprende además la etapa (b1) obtener emisiones de fluorescencia (EF) ciclo por ciclo a diversas temperaturas de medición (TM) , en el que dichas emisiones de fluorescencia (EF) es una fluorescencia corregida con el nivel inicial (dR) ,
más preferentemente (A1a) en el que cuando dicha mezcla de reacción de amplificación comprende “n” sondas para la detección de múltiplex de “n” dianas de ácido nucleico, en el que la primera sonda tiene una temperatura de fusión Tm1, la segunda sonda tiene una temperatura de fusión Tm2, la tercera sonda tiene una temperatura de fusión de Tm3, la n sonda tiene una temperatura de fusión Tmn, en el que Tm1>Tm2>Tm3 ... >Tmn, los porcentajes de la forma bicatenaria de cada sonda a una temperatura particular o temperaturas diferentes se determinan experimentalmente
en el que el cálculo de cantidad consumida real (CCR) usa la siguiente fórmula:
a la temperatura de medición TMa, la emisión de fluorescencia total será:
EFa = (CCR1) * (ds1a) % + (CCR2) * (ds2a) % + (CCR3) * (ds3a) %... + (CCRn) * (dsna) %
a la temperatura de medición TMb, la emisión de fluorescencia total será
EFb = (CCR1) * (ds1b) % + (CCR2) * (ds2b) % + (CCR3) * (ds3b) %... + (CCRn) * (dsna) %
a la temperatura de medición TMc, la emisión de fluorescencia total será
EFc = (CCR1) * (ds1c) % + (CCR2) * (ds2c) % + (CCR3) * (ds3c) %... + (CCRn) * (dsna) %
y así sucesivamente, en el que la CCR para cada sonda puede calcularse a partir de las fórmulas anteriores, en las que “*” denota “multiplicar por”, “k” es un número entero positivo, 1 CkCn, y “n” es el número de sondas,
particularmente preferentemente en el que la cantidad consumida real de la emisión de fluorescencia de cada sonda se obtiene mediante un programa informático que realiza el cálculo a cada temperatura de medición en cada ciclo, o en el que:
(B) dicha amplificación es una amplificación isotérmica o una reacción de amplificación de ciclado térmico que comprende dos o más etapas de desnaturalización, hibridación y extensión de cebador.
3. Un procedimiento para ensayar una muestra para uno o más ácidos nucleicos diana, comprendiendo dicho procedimiento:
(a) poner en contacto una muestra que comprende uno o más ácidos nucleicos diana con una mezcla de reacción que comprende:
dos o más sondas, en el que cada sonda comprende:
un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión (temperatura de fusión Tm) de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes, y son distinguibles en un análisis de perfiles de fusión;
(b) realizar la reacción en la muestra/mezcla de reacción, en el que la reacción es una reacción de extensión de cebador bajo condiciones de extensión, en el que, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de la sonda correspondiente que son cebadores extensibles se hibridan con ácido nucleico diana, consumiéndose así durante la reacción de extensión de cebador, en el que los oligonucleótidos consumidos de sondas ya no pueden participar más en formar la porción bicatenaria (el dúplex) de la sonda; y
(c) medir, al menos una vez, el perfil de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de las sondas sin consumir en la mezcla de reacción detectando la (s) señal (es) de las marcas en aquellas sondas en función de la temperatura,
en el que el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana está presente o no en dicha muestra.
4. Un procedimiento para ensayar una muestra para uno o más ácidos nucleicos diana, comprendiendo dicho procedimiento:
(a) poner en contacto una muestra que comprende uno o más ácidos nucleicos diana con una mezcla de reacción de hibridación que comprende:
dos o más sondas, en el que cada sonda comprende:
un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes y son distinguibles en un análisis de perfiles de fusión;
(b) realizar la reacción de hibridación en la muestra/mezcla de reacción bajo condiciones de hibridación, en el que, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de sondas que son sustancialmente
complementarios a parte de ese ácido nucleico diana se hibridan con ácido nucleico diana, consumiéndose así durante la reacción, en el que los oligonucleótidos consumidos de sondas ya no pueden participar más en formar la porción bicatenaria (el dúplex) de la sonda; y
(c) medir, al menos una vez, el perfil de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de sondas sin consumir en la mezcla de reacción detectando la (s) señal (es) de las marcas en aquellas sondas en función de la temperatura,
en el que el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana está presente o no en dicha muestra.
5. Un procedimiento para monitorizar una amplificación por PCR de al menos dos dianas de ácido nucleico, comprendiendo dicho procedimiento:
(a) poner en contacto una muestra que comprende uno o más ácidos nucleicos diana con una mezcla de reacción de amplificación que comprende:
(i) uno o más pares de cebadores de oligonucleótidos directos/inversos, en el que los pares de cebadores pueden amplificar uno o más ácidos nucleicos diana, si están presentes en la muestra,
(ii) dos o más sondas, en el que cada sonda comprende:
un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a una segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca fluorescente o par de marca fluorescente/extintor que puede producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes;
(b) realizar una reacción de amplificación que comprende el ciclado térmico de la muestra/mezcla de reacción de amplificación,
en el que, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de sondas que son sustancialmente complementarios a parte de ese ácido nucleico diana son consumidos durante la reacción de amplificación; y
en el que la etapa (b) comprende además la etapa (b1) obtener emisiones de fluorescencia (EF) ciclo por ciclo a diversas temperaturas de medición (TM) , en el que dichas emisiones de fluorescencia (EF) es fluorescencia corregida con el nivel inicial (dR) ,
en el que cuando dicha mezcla de reacción de amplificación comprende “n” sondas para la detección de múltiplex de “n” dianas de ácido nucleico, en el que la primera sonda tiene una temperatura de fusión de Tm1, la segunda sonda tiene una temperatura de fusión de Tm2, la tercera sonda tiene una temperatura de fusión de Tm3, la n sonda tiene una temperatura de fusión de Tmn, en el que Tm1 >Tm2>Tm3 ... >Tmn, en el que los porcentajes de la forma bicatenaria de cada sonda a una temperatura particular o temperaturas diferentes se determinan experimentalmente o se calculan en teoría por un programa informático, en el que una primera emisión de fluorescencia EFa se obtiene a una temperatura de medición TMa, a la que más del 50% de la primera sonda está en forma de dúplex, la segunda emisión de fluorescencia EFb se obtiene a una temperatura de medición TMb, a la que más del 50% de segunda sonda está en forma de dúplex, la n-1 emisión de fluorescencia EF (n-1) se obtiene a una temperatura de medición TM (n-1) , a la que más del 50% de la (n-1) sonda está en forma de dúplex, la n emisión de fluorescencia EFn se obtiene a una temperatura de medición TMn, a la que más del 80% de la n sonda está en forma de dúplex, y opcionalmente una emisión de fluorescencia EF0 se obtiene a una temperatura de medición TM0, a la que no más del 10% de la primera sonda está en forma de dúplex, en el que n es un número entero positivo y n 2,
en el que la etapa (b) comprende además la etapa (b2) determinar la cantidad consumida real ciclo por ciclo de la emisión de fluorescencia para cada sonda, en el que la cantidad consumida real de la emisión de fluorescencia de la k sonda se representa como CCRk, en el que a una temperatura de medición particular (TMa) dicha k sonda tiene el porcentaje (dska) % en forma ds (bicatenaria) , la emisión de fluorescencia EFa a esta temperatura de medición TMa contribuida por la k sonda será el (dska) % * (CCRk) , la contribuida por la n sonda será el (dsna) % * (CCRn) , en el que el cálculo de cantidad consumida real (CCR) usa la siguiente fórmula:
a la temperatura de medición TMa, la emisión de fluorescencia total será
EFa = (CCR1) * (ds1a) % + (CCR2) * (ds2a) % + (CCR3) * (ds3a) %... + (CCRn) * (dsna) %
a la temperatura de medición TMb, la emisión de fluorescencia total será
EFb = (CCR1) * (ds1b) % + (CCR2) * (ds2b) % + (CCR3) * (ds3b) %... + (CCRn) * (dsna) %
a la temperatura de medición TMc, la emisión de fluorescencia total será
EFc = (CCR1) * (ds1c) % + (CCR2) * (ds2c) % + (CCR3) * (ds3c) %... + (CCRn) * (dsna) %
y así sucesivamente, en el que la CCR individual puede calcularse a partir de las fórmulas anteriores, en las que “*” denota “multiplicar por”, “k” es un número entero positivo, 1 CkCn, y “n” es el número de sondas,
en el que la cantidad consumida real de la emisión de fluorescencia de cada sonda se obtiene mediante un programa que realiza el cálculo a cada temperatura de medición en cada ciclo, y
en el que la cantidad consumida real de la emisión de fluorescencia de cada sonda está relacionada con el grado de amplificación del ácido nucleico diana con el que se une el primer oligonucleótido de esa sonda.
6. Un procedimiento según cualquiera de las reivindicaciones anteriores, en el que:
(A) dicho consumo de sondas se logra mediante hibridación del primer oligonucleótido de la sonda con la secuencia diana, que va seguido de la incorporación del primer oligonucleótido de la sonda en el producto amplificado, en el que cuando el primer oligonucleótido de la sonda puede incorporarse en el producto amplificado, el primer oligonucleótido es cebador extensible o es uno del par de cebadores de oligonucleótidos directos/inversos, o
(B) dicho consumo de sondas se logra mediante hibridación del primer oligonucleótido de la sonda con la secuencia diana, que va seguido de degradación del primer y/o segundo oligonucleótido de la sonda, en el que cuando el primer oligonucleótido de la sonda se degrada durante la reacción, la mezcla de reacción comprende actividad de nucleasa dependiente de bicatenaria.
7. Un procedimiento según cualquiera de las reivindicaciones anteriores, en el que la sonda comprende una primera marca y una segunda marca, en el que la primera marca es un fluoróforo y la segunda marca es un extintor, o viceversa, preferentemente en el que:
(A) la primera marca está unida al primer oligonucleótido y la segunda marca está unida al segundo oligonucleótido de forma que dicha primera marca y segunda marca están en estrecha proximidad cuando el dúplex interno de la sonda se forma, o en el que
(B) las marcas están sobre un oligonucleótido de la sonda, tanto el primer oligonucleótido como el segundo oligonucleótido,
preferentemente (B1) en el que el primer oligonucleótido de la sonda no comprende una marca, y el segundo oligonucleótido de la sonda comprende al menos una, preferentemente dos, marcas, en el que el segundo oligonucleótido comprende una primera marca y una segunda marca, estando la primera marca unida o próxima a un extremo del segundo oligonucleótido y la segunda marca está unida o próxima al otro extremo del segundo oligonucleótido, por lo cual cuando el segundo oligonucleótido no se hibrida con el primer oligonucleótido, el segundo oligonucleótido está en una estructura de espiral al azar o de tallo-bucle que pone la primera marca y segunda marca en estrecha proximidad, o (B2) en el que el primer oligonucleótido no comprende una marca y el segundo oligonucleótido comprende una marca en el que, cuando el segundo oligonucleótido se hibrida con el primer oligonucleótido para formar la porción bicatenaria de la sonda, la marca puede cambiar la emisión de señal con respecto a la emisión de la forma monocatenaria del segundo oligonucleótido, o (B3) en el que el primer oligonucleótido de la sonda no comprende una marca y en el que la sonda comprende dos segundos oligonucleótidos que pueden hibridarse adyacentemente o sustancialmente adyacentemente con diferentes partes de la segunda región del primer oligonucleótido, en el que uno de los segundos oligonucleótidos está unido a una primera marca, y el otro segundo oligonucleótido está unido a una segunda marca, de forma que cuando los dos segundos oligonucleótidos se hibridan con el primer oligonucleótido, las dos marcas se ponen en estrecha proximidad y una marca afecta a la señal del otro, o (C) en el que el primer y segundo oligonucleótidos de una sonda están unidos por un resto de ligador que comprende nucleótidos o un ligador químico de no nucleótidos, permitiendo que el primer oligonucleótido y el segundo oligonucleótido formen una estructura de tallo-bucle, en el que el primer y segundo oligonucleótidos se marcan con una primera y segunda marca, respectivamente, de forma que, cuando la sonda forma una estructura de tallo-bucle interno, las marcas se ponen en estrecha proximidad y una marca afecta a la señal de la otra.
8. Un procedimiento según cualquiera de las reivindicaciones anteriores:
(A) en el que dicha primera región de dicho primer oligonucleótido no está solapándose sustancialmente con la segunda región de dicho primer oligonucleótido, o
(B) en el que dicha primera región de dicho primer oligonucleótido está solapándose sustancialmente con la segunda región de dicho primer oligonucleótido o la segunda región está incorporada en la primera región, en el que la Tm del dúplex de dicho primer oligonucleótido hibridado con la secuencia diana es superior a la Tm del dúplex de dicho primer oligonucleótido hibridado con el segundo oligonucleótido de forma que si una diana está presente, el primer oligonucleótido forma híbridos más fuertes con la diana y, por consiguiente, funde a una mayor temperatura que el dúplex de primer/segundo oligonucleótido; o
(C) en el que dicho primer oligonucleótido comprende una tercera región que es idéntica o sustancialmente idéntica a la secuencia de un cebador que se usa en la reacción de amplificación; o
(D) en el que tanto el primer como el segundo oligonucleótidos de sondas pueden consumirse durante la amplificación; o
(E) en el que dicho primer oligonucleótido se bloquea en el extremo 3', y en el que dicho segundo oligonucleótido se bloquea en el 3' extremo; o
(F) en el que múltiples primeros oligonucleótidos de diferentes sondas se hibridan con diferentes sitios de la misma cadena de una secuencia diana.
9. Un procedimiento para ensayar una muestra para uno o más nucleótidos de variante sobre los ácidos nucleicos diana, comprendiendo dicho procedimiento:
(a) poner en contacto una muestra que comprende ácidos nucleicos diana con mezcla de reacción que comprende:
(i) uno o más pares de cebadores de oligonucleótidos directos/inversos, en el que los pares de cebadores pueden amplificar uno o más ácidos nucleicos diana, si están presentes en la muestra,
(ii) al menos un par de sondas, en el que la primera sonda en el par comprende la secuencia complementaria a la secuencia de ácidos nucleicos diana natural, la segunda sonda en el par comprende la secuencia complementaria a la secuencia de ácidos nucleicos diana que contiene nucleótidos de variante, en el que cada sonda en el par comprende:
un primer oligonucleótido que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y
al menos un segundo oligonucleótido que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda en el par comprende el mismo segundo oligonucleótido, en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda, y
en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes;
(b) realizar una reacción de amplificación en la muestra/mezcla de reacción de amplificación en la que, cuando un ácido nucleico diana está presente, los primeros oligonucleótidos de sondas que son sustancialmente complementarios a parte de ese ácido nucleico diana son consumidos durante la reacción de amplificación; y
(c) medir, al menos una vez, el perfil de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de sondas sin consumir detectando la (s) señal (es) de las marcas en aquellas sondas en función de la temperatura,
en el que el perfil de fusión proporciona una indicación de si al menos un ácido nucleico diana ha sido amplificado o no en dicha muestra/mezcla de reacción de amplificación.
10. Un kit para ensayar una o más dianas de ácido nucleico que comprende dos o más sondas, comprendiendo cada sonda:
un primer oligonucleótido de 15-150 nucleótidos que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y al menos un segundo oligonucleótido de 4-150 nucleótidos que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda,
y en el que:
(a) el primer oligonucleótido de la sonda no comprende una marca, el segundo oligonucleótido comprende una primera marca y una segunda marca, en el que la primera marca está unida o próxima a un extremo del segundo oligonucleótido y la segunda marca está unida o próxima al otro extremo del segundo oligonucleótido, por lo cual cuando el segundo oligonucleótido no se hibrida con el primer oligonucleótido, el segundo oligonucleótido está en una estructura de espiral al azar o de tallo-bucle que pone la primera marca y segunda marca en estrecha proximidad y en el que cuando el segundo oligonucleótido se hibrida con el primer oligonucleótido, las dos marcas se mantienen alejadas entre sí; o
(b) el primer oligonucleótido no comprende una marca y el segundo oligonucleótido comprende una marca, en el que cuando el segundo oligonucleótido se hibrida con el primer oligonucleótido para formar la porción bicatenaria de la sonda, la marca puede cambiar su emisión de señal detectable con respecto a la emisión de la marca cuando está en la forma monocatenaria del segundo oligonucleótido; o
(c) el primer oligonucleótido de la sonda no comprende una marca, la sonda comprende dos segundos oligonucleótidos que pueden hibridarse adyacentemente o sustancialmente adyacentemente con diferentes partes de la segunda región del primer oligonucleótido, en el que uno de los segundos oligonucleótidos está unido a una primera marca, y el otro segundo oligonucleótido está unido a una segunda marca, de forma que cuando los dos segundos oligonucleótidos se hibridan con el primer oligonucleótido, las dos marcas se ponen en estrecha proximidad y una marca afecta a la señal de la otra,
y en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes.
11. Un kit para ensayar una o más dianas de ácido nucleico que comprende una mezcla de sondas que contiene dos o más sondas, en el que cada sonda comprende:
un primer oligonucleótido de 15-150 nucleótidos que comprende una primera región que es sustancialmente complementaria a parte de un ácido nucleico diana y una segunda región, y al menos un segundo oligonucleótido de 4-150 nucleótidos que comprende una región que es sustancialmente complementaria a la segunda región del primer oligonucleótido, de forma que el primer y segundo oligonucleótidos pueden formar una porción bicatenaria,
en el que cada sonda comprende una marca detectable o combinación detectable de marcas que puede/pueden producir una señal variable que es característica de la presencia o ausencia de una porción bicatenaria entre el primer y segundo oligonucleótidos de esa sonda,
y en el que:
(a) la primera marca está unida a la segunda región del primer oligonucleótido y la segunda marca está unida a la región del segundo oligonucleótido que es complementaria a la segunda región del primer oligonucleótido de forma que la primera y segunda marcas se ponen en estrecha proximidad tras la formación del dúplex interno de la sonda; o
(b) el primer oligonucleótido de la sonda no comprende una marca, el segundo oligonucleótido comprende una primera marca y una segunda marca, en el que la primera marca está unida o próxima a un extremo del segundo oligonucleótido y la segunda marca está unida o próxima al otro extremo del segundo oligonucleótido, por lo cual cuando el segundo oligonucleótido no se hibrida con el primer oligonucleótido, el segundo oligonucleótido está en una estructura de espiral al azar o de lazo-bucle que pone la primera marca y segunda marca en estrecha proximidad y en el que cuando el segundo oligonucleótido se hibrida con el primer oligonucleótido, las dos marcas
se mantienen alejadas entre sí; o
(c) el primer oligonucleótido no comprende una marca y el segundo oligonucleótido comprende una marca, en el que cuando el segundo oligonucleótido se hibrida con el primer oligonucleótido para formar la porción bicatenaria de la sonda, la marca puede cambiar su emisión de señal detectable con respecto a la emisión de la marca cuando está en la forma monocatenaria del segundo oligonucleótido; o
(d) el primer oligonucleótido de la sonda no comprende una marca, la sonda comprende dos segundos oligonucleótidos que pueden hibridarse adyacentemente o sustancialmente adyacentemente con diferentes partes de la segunda región del primer oligonucleótido, en el que uno de los segundos oligonucleótidos está unido a una primera marca, y el otro segundo oligonucleótido está unido a una segunda marca, de forma que cuando los dos segundos oligonucleótidos se hibridan con el primer oligonucleótido, las dos marcas se ponen en estrecha proximidad y una marca afecta a la señal de la otra; o
(e) el primer y segundo oligonucleótidos de una sonda están unidos por un resto de ligador que comprende nucleótidos o un ligador químico de no nucleótidos, permitiendo que el primer oligonucleótido y el segundo oligonucleótido formen una estructura de tallo-bucle, en el que el primer y el segundo oligonucleótidos se marcan con una primera y segunda marca, respectivamente, de forma que, cuando la sonda forma una estructura de tallobucle interno, las marcas se ponen en estrecha proximidad y una marca afecta a la señal de la otra;
y en el que al menos dos de las sondas comprenden la misma marca detectable o marcas detectables diferentes con espectros de emisión indistinguibles y en el que las características de fusión de las porciones bicatenarias entre el primer y segundo oligonucleótidos de cada una de tales sondas son diferentes.
12. Un kit según la reivindicación 10 o la reivindicación 11, en el que al menos una marca es una marca fluorescente; o
un kit según la reivindicación 10, partes (a) o (c) , o la reivindicación 11 partes (a) , (b) , (d) o (e) , en el que la sonda comprende una primera marca y una segunda marca, preferentemente en el que la primera marca es un fluoróforo y la segunda marca es un extintor, o viceversa.
13. Uso de una sonda como se define en cualquiera de las partes (a) - (c) de la reivindicación 10, o una mezcla de sondas como se define en la reivindicación 11, en un procedimiento como se define en cualquiera de las reivindicaciones 1-9.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]