MODELOS CELULARES DE CANCER DE PROSTATA.
Modelos celulares de cáncer de próstata.Líneas celulares, PC-3/S-luc y PC-3/M-luc,
derivadas de la línea de cáncer de próstata PC-3, modificadas de forma que expresan el gen luciferasa (luc) para el desarrollo de un modelo de cáncer, útil para el diagnóstico y/o pronóstico de cáncer, específicamente de próstata, determinando la diferente expresión génica de los marcadores biológicos de invasividad y metástasis. Así como, un método in vitro de búsqueda de agentes para tratamiento o prevención del cáncer
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200802841.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: BLANCO FERNANDEZ,JERONIMO, THOMSON OKATSU,TIMOTHY, MECA CORTES,OSCAR, RUBI VIDAL,NURIA, CELIA TERRASSA,ANTONI, VILALTA COLOMER,MARTA.
Fecha de Solicitud: 7 de Octubre de 2008.
Fecha de Publicación: .
Fecha de Concesión: 3 de Mayo de 2011.
Clasificación Internacional de Patentes:
- C12N15/85 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células animales.
- C12N5/06B30
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
Clasificación PCT:
- A61P35/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N5/07 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos animales.
- G01N33/574 G01N 33/00 […] › para el cáncer.
PDF original: ES-2341747_A1.pdf



Fragmento de la descripción:
Modelos celulares de cáncer de próstata.
La presente invención se encuentra dentro del campo de la biología, la biología molecular y la biotecnología, y específicamente se relaciona con la búsqueda de productos con potenciales aplicaciones terapéuticas. En particular, la invención se refiere a un método para la búsqueda de compuestos frente al cáncer y/o útiles en terapias adyuvantes al tratamiento de dicha enfermedad.
Estado de la técnica anterior
La progresión del cáncer a mayores niveles de malignidad está estrechamente unida a la emergencia de poblaciones de células madre (CSCs) dotadas de una capacidad de una autorrenovación ilimitada, supervivencia bajo estrés, y el establecimiento de metástasis distantes. Actualmente no está claro si una sola población adquiere todas las características necesarias de las células cancerosas para dar lugar a metástasis, o si varias poblaciones emergen secuencialmente o de forma paralela, cada una con funciones especializadas dentro del tumor.
Existen evidencias acumuladas que sustentan la noción de que el proceso de adquisición de características "agresivas" en el cáncer, o tumores malignos, es determinada tanto por mutaciones genéticas como por la imposición de modificaciones epigenética heredables sobre determinados genes. Dentro de un tumor, estos eventos genéticos y epigenéticos adquiridos de novo pueden, bien emerger secuencialmente en una sola línea, o pueden ocurrir en paralelo en múltiples linajes independientes. En cualquiera de los dos escenarios de evolución celular del cáncer, el resultado final es la coexistencia dentro de un tumor particular de subpoblaciones celulares, cada una dotada con fenotipos particulares (heterogeneidad intratumoral). Existen también evidencias recientes que muestran que la imposición de modificaciones epigenéticas que causan la reprogramación genética en células tumorales puede ser inducida, al menos en parte, en respuesta a estímulos medioambientales no tumorales, que incluye factores tales como TGF-β, PDGF (factor de crecimiento derivado de plaquetas) o EGF (factor de crecimiento epidérmico), hormonas, o estrés hipóxico. Por tanto, las células cancerosas dotadas con la capacidad de una autorrenovación indefinida (células madre cancerosas, CSCs), pero que retienen todavía una cierta capacidad para la diferenciación, podrían evolucionar a diferentes tipos celulares de cáncer, en respuesta a influencias medioambientales y a nuevas mutaciones. Al igual que en todo nicho ecológico, estas subpoblaciones podrían interaccionar entre sí, bien compitiendo por recursos comunes, o bien cooperando para beneficio mutuo. Estas poblaciones tumorales pueden interaccionar con, y usar para su beneficio, elementos no tumorales, como se ha mostrado de manera convincente en numerosos modelos de progresión tumoral y metástasis. Uno de los fenotipos en los que las CSCs se pueden diferenciar en respuesta a estímulos ambientales, es el fenotipo invasivo y el mótil, este último denominado generalmente transición epitelio-mesenquimal (TEM). Entre las influencias ambientales, la interacción de células tumorales con microambientes no tumorales o no cancerosos, puede contribuir a la inducción de marcadores restrictivos heredables epigenéticos que dirigen la evolución de subpoblaciones de células tumorales dotadas de distintas propiedades malignas. Los muy diferentes requerimientos de las células neoplásicas para adquirir fenotipos totalmente malignos, aunque componen un escenario complejo, proporcionan numerosas oportunidades para el desarrollo de terapias dirigidas a varios factores no solapados y vías involucradas en este proceso.
Además existen evidencias de que, más allá de la capacidad de invadir tejidos locales, la habilidad de las células tumorales de metastatizar a órganos distantes está asociada con su pluripotencia y su autorrenovación no restringida, características normalmente adscritas a las células madre. Se ha demostrado para varios tipos de tumores sólidos que tales células madre cancerosas (CSCs) pueden ser detectadas en un tumor primario, lo que explica porqué la expresión genética en tumores primarios puede ser un factor predictivo de riesgo para la metástasis. Aún no está claro si una única célula porta todas las anormalidades genéticas que facilitan tanto su invasividad y su capacidad para metastatizar, si distintas especies clonales portan mutaciones fenotípicas complementarias que cooperan de forma combinada para un comportamiento agresivo, o si una sola progenie clonal de células madre cancerosas retiene su capacidad para divisiones asimétricas dando lugar a al menos, dos poblaciones, una con características fibroblastoides que facilitan la invasión local de todas las poblaciones tumorales, y otra población con más características de células madre, incluyendo la autorrenovación y la capacidad de metastatizar. Hay evidencias que soportan tanto la hipótesis de evolución clonal como la hipótesis de células madre cancerosa, dos visiones de la evolución del tumor que no son necesariamente mutuamente excluyentes, y también hay evidencias que tanto los eventos genéticos como epigenéticos subyacen en la evolución fenotípica del tumor. Lo que aún no es conocido es si estos estados representan características estables o plásticas, o los moduladores que median la generación de tales subpoblaciones (heterogeneidad intratumoral).
Descripción de la invención
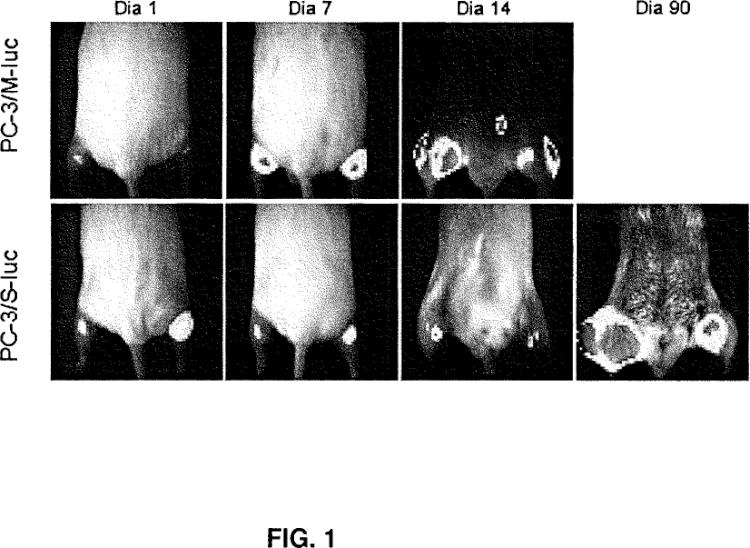
Los autores de la presente invención han generado y caracterizado un modelo celular de progresión de cáncer de próstata, en el que han identificado una subpoblación con características CSCs y otra población con características comúnmente asociadas con la transición epitelio-mesenquimal (TEM). Bajo condiciones de cultivo estándar, estas dos subpoblaciones fueron fenotípicamente estables y mostraron capacidades divergentes de invasión y clonogenicidad in vitro, y potencial metastático in vivo, reflejado en sus muy diferentes repertorios transcripcionales. Mediante la exposición de células fenotipadas como CSC a diferentes factores y moduladores, se ha podido inducir de forma reproducible un cambio hacia la adquisición de características TEM. Este cambio fenotípico fue acompañado con la reprogramación de los genes que determinan el estatus CSC o TEM, y fue asociado con la adquisición de marcadores de histona en los promotores correspondientes, lo que es característico del silenciamiento transcripcional. Estas evidencias sugieren que, en este modelo, CSC y TEM son alternativas diferentes, no estados solapados, y que factores medioambientales inducen a marcadores epigenéticos que dictan la evolución de CSCs hacia el establecimiento de distintas subpoblaciones solapadas dotadas de funciones especializadas dado un determinado tumor.
La presente invención proporciona un modelo para el estudio de los procesos invasivos, clonogénicos y metastásicos que tienen lugar en el desarrollo y progresión del cáncer.
Así, un primer aspecto de la invención se refiere a un modelo celular dual de cáncer, de ahora en adelante modelo celular de la invención, que comprende:
La línea celular PC-3/S se obtuvo mediante pases celulares in vitro a través de Matrigel, siendo seleccionadas por su invasividad, a partir de la línea celular PC-3 depositada en la autoridad internacional de depósito American Type Culture Collection (ATCC, Rockville, MD) con el número CRL-1435, tal y como se describe en Nithipatikom et al., 2002. (Eicosanoids and Other Bioactive Lipids in Cáncer, Inflammation and Radiation Injury, 5. Edited by Honn et al., Kluwer Academic/Plenum Publishers). De ahora en adelante, a la línea celular PC-3/S que expresa el gen de la luciferasa se la denominará PC-3/S-luc.
La línea celular PC-3/M es una sublínea de PC-3, obtenida a partir de la metástasis del hígado producida en un ratón nude tras la inyección intraesplénica de células de la línea PC-3 depositada en la autoridad internacional de depósito American Type Culture Collection (ATCC, Rockville, MD) con el número CRL-1435, y que fue seleccionada por sus características altamente metastásicas, tal y como se describe en Kozlowski et al., 1984. (Cáncer Research 44:3522-3529). De ahora en adelante, a la... [Seguir leyendo]
Reivindicaciones:
1. Modelo celular de cáncer que comprende:
2. Uso del modelo de cáncer según la reivindicación 1, para determinar la diferente expresión génica de los marcadores biológicos de invasividad y de metástasis.
3. Uso del modelo de cáncer según la reivindicación 2, para el diagnóstico del cáncer.
4. Uso del modelo de cáncer según la reivindicación 2, para el pronóstico del cáncer.
5. Uso del modelo de cáncer según cualquiera de las reivindicaciones 2-4, donde el cáncer es cáncer de próstata.
6. Método in vitro de búsqueda e identificación de agentes potencialmente útiles en el tratamiento o prevención del cáncer que comprende:
7. Uso del método según la reivindicación 6, para la selección de agentes útiles para el tratamiento del cáncer invasivo.
8. Uso del método según la reivindicación 6, para la selección de agentes útiles para el tratamiento del cáncer metastásico.
9. Uso del método según cualquiera de las reivindicaciones 6-8, donde el cáncer es cáncer de próstata.
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
 Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]