MÉTODO PARA LA PRODUCCIÓN DE ANTICUERPOS EN UN ANIMAL INMUNODEFICIENTE EN EL QUE SE HAN INYECTADO CÉLULAS MADRE DE HÍGADO FETAL HUMANO.
Método para la producción de un anticuerpo monoclonal humano de un animal no humano inmunodeficiente,
comprendiendo dicho método poner en contacto un animal no humano inmunodeficiente neonato con una célula madre de hígado fetal humano para generar un animal no humano transplantado inmune (animal reconstituido), poner en contacto seguidamente dicho animal reconstituido con un antígeno, recoger a partir de dicho animal reconstituido células humanas productoras de anticuerpos humanos contra dicho antígeno, y aislar dicho anticuerpo respecto de dichas células productoras de anticuerpos. Método según la reivindicación 1, caracterizado porque dicho animal no humano inmunorreconstituido es un roedor
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/004085.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124 4002 BASEL SUIZA.
Inventor/es: LIFKE,Alexander, LIFKE,Valeria, MUELLER-BECKMANN,Bernd, SCHNITZER,Tobias.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Mayo de 2007.
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/28H
- C07K16/32 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra productos de traducción de oncogenes.
- C12N5/06B11B
Clasificación PCT:
- C12N5/074 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células madre adultas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359585_T3.pdf



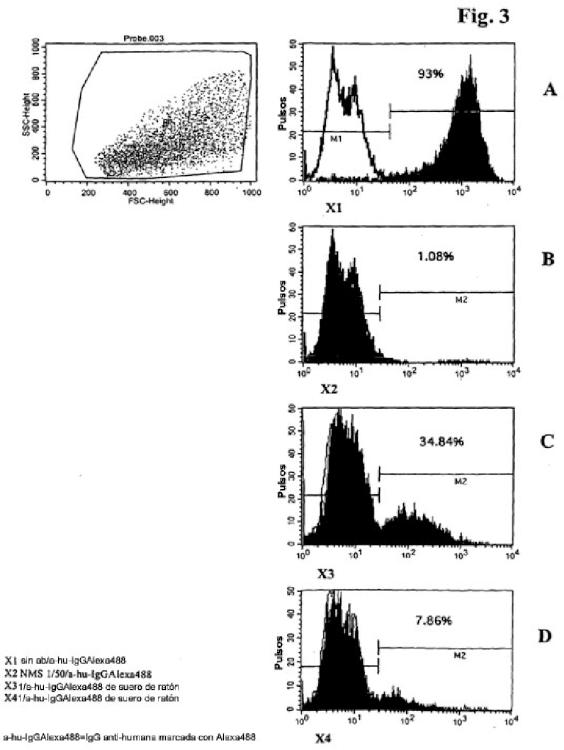
Fragmento de la descripción:
La presente invención se refiere a métodos para la producción de anticuerpos, a composiciones de células productoras de anticuerpos, a métodos para su producción y a usos de los mismos.
Antecedentes de la invención
Desde hace mucho tiempo los anticuerpos monoclonales (MAbs) han sido considerado "balas mágicas" en la inmunoterapia del cáncer, de la infección o de las enfermedad autoinmunológicas, etc. Sin embargo, la primera generación de anticuerpos murinos utilizada en el ser humano presentó relativamente poco éxito debido a las respuestas inmunológicas humanas anti-ratón.
Los anticuerpos humanos se han derivado mayoritariamente de ratones transgénicos que alojan un conjunto limitado de genes de Ig humana o de la selección de entre bibliotecas de gran tamaño de anticuerpos artificiales mediante expresión fágica, expresión en levaduras o mediante tecnologías recombinantes similares. Estas estrategias se han diseñado para eliminar cualquier reacción inmunológica contra el anticuerpo monoclonal en el fondo genético humano. Pueden producirse anticuerpos humanos en animales transgénicos (por ejemplo ratones) que son capaces, tras la inmunización, de producir anticuerpos humanos en ausencia de producción endógena de inmunoglobulinas. La transferencia del conjunto de genes de inmunoglobulina de la línea germinal humana en dichos ratones transgénicos de la línea germinal resulta en la producción de anticuerpos humanos tras el reto antigénico (ver, por ejemplo, van Dijk M.A. y van de Winkel J.G., Curr. Opin. Chem. Biol. 5:368-374, 2001; Jakobovits A. et al., Proc. Natl. Acad. Sci. USA 90:2551-2555, 1993; Jakobovits A. et al., Nature 362:255-258, 1993; Bruggemann M. et al., Year Immunol. 7 (1993) 33-40). También pueden producirse anticuerpos humanos en bibliotecas de expresión fágica (Hoogenboom H.R. y Winter G., J. Mol. Biol. 227:381-388, 1992; Marks J.D. et al., J. Mol. Biol. 222:581-597, 1991). Las técnicas de Cole et al. y de Boerner et al. también se encuentran disponibles para la preparación de anticuerpos monoclonales humanos (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, página 77, 1985; y Boerner, P. et al., J. Immunol. 147:86-95, 1991). Sin embargo, dichos ratones transgénicos únicamente son capaces de proporcionar anticuerpos con un conjunto limitado de genes de Ig humana, aquellos que resultan del conjunto génico de inmunoglobulinas que se ha transfectado.
Las metodologías basadas en ratones transgénicos para genes de inmunoglobulina humanos han permitido generar anticuerpos derivados de una secuencia de línea germinal humana, que se ha informa que han reducido la inmunogenicidad de los fármacos de anticuerpos resultantes en comparación con los anticuerpos murinos y quiméricos de ratón-humanos. Sin embargo, los anticuerpos humanos derivados de ratones transgénicos presentan una diversidad, afinidades y especificidades limitadas en comparación con los repertorios inmunológicos humanos naturales.
La patente EP nº 0322240 da a conocer la detección de IgG humanas en ratones SCID tras la inyección intravenosa de células de hígado fetal humano en ratones SCID, siendo de por lo menos aproximadamente 3 semanas de edad, en los que se ha implantado timo y nódulo linfático fetales humanos.
La patente EP nº 1645183 da a conocer un método para generar inmunoglobulinas específicas de antígeno producidas por células B trasplantadas tras el trasplante de células hematopoyéticas humanas obtenidas de sangre del cordón en ratones NOD/SCID/βM neonatos inmunodeficientes. Se generaron inmunoglobulinas humanas, aunque a niveles diferentes en NOD/SCID/IL2rg- y en NOD/IISCID/β2mnu.
De manera similar, una desventaja importante de los enfoques de biblioteca combinatorial basada en la expresión fágica o en levaduras es el apareamiento aleatorio de las cadenas pesadas y ligeras de anticuerpo. La disociación del apareamiento original entre cadenas pesadas y ligeras de anticuerpo, el apareamiento no afín, exige el cribado de un gran número de clones para identificar las parejas de cadena pesada y ligera de afinidad elevada. Además, dichas parejas no afines pueden mostrar reactividad cruzada no deseada con autoantígenos humanos. Finalmente, la diversidad genética de los anticuerpos específicos de diana identificados mediante selección y cribado de bibliotecas combinatoriales comúnmente se encuentra limitada a sesgos selectivos inherentes.
Traggai E. et al., Science 304:104-107, 2004, describen un método para el desarrollo de un sistema inmunológico humano en ratones Rag 2-/-yc-/- trasplantados con células sanguíneas de cordón humano, que pueda utilizarse como modelo preclínico para evaluar las respuestas a vacunas o patógenos infecciosos vivos y a compuestos farmacológicos que presentan como diana el sistema inmunológico humano. Se demostró que ratones reconstituidos y posteriormente vacunados con patógenos podían producir respuestas de anticuerpos específicas de toxoide tetánico a niveles bajos.
Descripción resumida de la invención
La invención comprende un método para la producción de un anticuerpo monoclonal humano de un animal no humano inmunodeficiente, comprendiendo dicho método poner en contacto un animal no humano inmunodeficiente neonato con una célula madre de hígado fetal humano (célula FL) para generar un animal no humano transplantado inmune (animal reconstituido), poner en contacto posteriormente dicho animal reconstituido con un antígeno, recoger a partir de dicho animal reconstituido células humanas productoras de anticuerpos humanos contra dicho antígeno, y aislar dicho anticuerpo respecto de dichas células productoras de anticuerpos.
La invención preferentemente comprende un método según la invención, caracterizado por el establecimiento a partir de dichas células productoras de anticuerpos, células inmortales productoras de anticuerpos, preferentemente mediante un método de transformación o un método de fusión celular. Preferentemente, dichas células inmortales son capaces de seguir siendo viables durante por lo menos 50 pases.
Preferentemente, dicho animal no humano es un roedor, y más preferentemente es un ratón, rata o conejo. Resulta adicionalmente preferente que el ratón sea un ratón Rag2-/-γc-/-, Rag 2-/-desnudo, NOD ("NOD" se refiere según la invención preferentemente a NOD.Cg-Rag1tm1Mom Prf1tm1Sdz/SzJ) o SCID beige, y la rata es una rata desnuda.
La invención comprende un método según la invención, caracterizado porque dicha célula FL es una célula madre hematopoyética de hígado fetal humano (célula HFL), preferentemente CD133+, CD117+, CD31+ y/o CD34+.
En una realización adicional, el método preferentemente se caracteriza porque dicha célula FL es una combinación de una célula HFL y una célula madre no hematopoyética de hígado fetal humano.
La invención comprende un método según la invención, caracterizado porque dichas células productoras de anticuerpos son células B humanas.
La invención comprende un método según la invención, caracterizado porque dichas células FL está destinado a la puesta en contacto de células inyectadas i.p., s.c. o intrahepáticamente en el animal.
La invención comprende un método según la invención, caracterizado porque el antígeno es un polipéptido, un complejo de MHC/péptido o ADN.
La invención comprende un método según la invención, caracterizado porque el antígeno se pone en contacto con el animal reconstituido a modo de antígeno, fragmento de antígeno, ADN codificante de antígeno y/o célula portadora de antígeno.
La invención comprende un método según la invención, caracterizado porque el animal no humano inmunodeficiente se irradia subletamente antes de ponerlo en contacto con las células FL.
La invención comprende un método según la invención, caracterizado porque el ratón se pone en contacto en primer lugar con el antígeno 5 a 18 semanas después de poner en contacto dicho ratón con dichas células FL.
La invención comprende un método según la invención, caracterizado porque el ratón se pone en contacto hasta diez veces con el antígeno.
La invención comprende un método según la invención, caracterizado porque dichas células recogidas son células CD19+ o CD22+ humanas.
La invención comprende un método según la invención, caracterizado porque dicha célula se establece... [Seguir leyendo]
Reivindicaciones:
1. Método para la producción de un anticuerpo monoclonal humano de un animal no humano inmunodeficiente, comprendiendo dicho método poner en contacto un animal no humano inmunodeficiente neonato con una célula madre de hígado fetal humano para generar un animal no humano transplantado inmune (animal reconstituido), poner en contacto seguidamente dicho animal reconstituido con un antígeno, recoger a partir de dicho animal reconstituido células humanas productoras de anticuerpos humanos contra dicho antígeno, y aislar dicho anticuerpo respecto de dichas células productoras de anticuerpos. Método según la reivindicación 1, caracterizado porque dicho animal no humano inmunorreconstituido es un roedor.
2. Método según la reivindicación 1 ó 2, caracterizado porque dicho animal no humano reconstituido es un ratón o una rata.
3. Método según las reivindicaciones 1 a 3, caracterizado porque dicho ratón reconstituido es un ratón Rag2-/-γc-/-, Rag2-/- desnudo, NOD o SCID beige.
4. Método según las reivindicaciones 1 a 4, caracterizado porque dichas células madre de hígado fetal son células madre hematopoyéticas de hígado fetal humano.
5. Método según las reivindicaciones 1 a 5, caracterizado porque dichas células madre de hígado fetal es una combinación de células madre hematopoyéticas de hígado fetal humano y células madre no hematopoyéticas de hígado fetal humano.
6. Método según las reivindicaciones 1 a 6, caracterizado porque dichas células productoras de anticuerpos son células B humanas.
7. Método según las reivindicaciones 1 a 7, caracterizado porque el antígeno es un polipéptido.
8. Método según las reivindicaciones 1 a 8, caracterizado porque el antígeno se pone en contacto con el animal reconstituido como antígeno, fragmento de antígeno, complejo de MHC/péptido, ADN codificante de antígeno y/o célula portadora de antígeno.
9. Método según las reivindicaciones 1 ó 9, caracterizado porque el animal no humano reconstituido se irradia subletalmente antes de ponerse en contacto con las células madre de hígado fetal humano.
10. Método según las reivindicaciones 1 a 10, caracterizado porque el ratón se pone en contacto en primer lugar con el antígeno 5 a 18 semanas después de poner en contacto dicho ratón con dichas células madres de hígado fetal humano.
11. Método según las reivindicaciones 1 a 11, caracterizado porque el ratón se pone en contacto hasta diez veces con el antígeno.
12. Método según las reivindicaciones 1 a 12, caracterizado porque dichas células recogidas son células humanas CD19+ o CD22+.
13. Método según las reivindicaciones 1 a 13, caracterizado porque dichas células se establecen mediante tecnología del hibridoma.
14. Método según las reivindicaciones 1 a 14, caracterizado porque la línea celular de pareja de fusión es una línea celular MFP-2, HK-128, K6H6/B5 ó Karpas 707.
15. Método para la producción de una pluralidad de células B humanas productoras de una pluralidad de anticuerpos humanos contra un antígeno, estando caracterizado dicho método por la puesta en contacto de un animal no humano inmunodeficiente neonato con células madre de hígado fetal humano, para generar un animal inmunorreconstituido, poniendo en contacto seguidamente dicho animal reconstituido con un antígeno, recogiendo dicha pluralidad de células B humanas productoras de anticuerpos a partir de dicho animal no humano.
16. Método para la producción recombinante de un anticuerpo, caracterizado por la puesta en contacto de un animal no humano inmunodeficiente neonato con células madre de hígado fetal humano, seguidamente poniendo en contacto dicho animal no humano con un antígeno, recogiendo a partir de dicho animal no humano unas células humanas productoras de anticuerpos humanos contra dicho antígeno, y aislando dicho anticuerpo, secuenciando las regiones variables, construyendo uno o más vectores de expresión codificantes de por lo menos las CDRs de las cadenas pesadas y/o ligeras, en combinación con una cadena constante humana,
expresando dicho vector o vectores en una o más células huésped apropiadas, y aislando dicho anticuerpo (proteína inmunorreactiva) de dicha célula o células huésped o sobrenadante de fermentación.
17. Método para la producción recombinante de un anticuerpo, caracterizado por la puesta en contacto de un
5 animal no humano inmunodeficiente neonato con unas células madre de hígado fetal humano, seguidamente poniendo en contacto dicho animal no humano con un antígeno, recogiendo a partir de dicho animal no humano unas células humanas que producen anticuerpos humanos contra dicho antígeno, y aislando ARNm de dichas células humanas productoras de anticuerpos humanos, generando ADNc específico de anticuerpo (por ejemplo mediante la utilización de cebadores específicos de inmunoglobulina), construyendo uno o más vectores de expresión codificantes de por lo menos las CDRs de las cadenas pesadas y/o ligeras, en combinación con una cadena constante humana, expresando dicho vector o vectores en una o más células huésped apropiadas, y aislando dicho anticuerpo (proteína inmunorreactiva) de dicha célula o células huésped o sobrenadante de fermentación.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]