PROCEDIMIENTO PARA LA PRODUCCION DE ANTICUERPOS HUMANIZADOS MEDIANTE MUTAGÉNESIS ALEATORIA.
Procedimiento para producir e identificar mutaciones en la región estructural que mejora la unión de anticuerpos humanizados con sus antígenos afines,
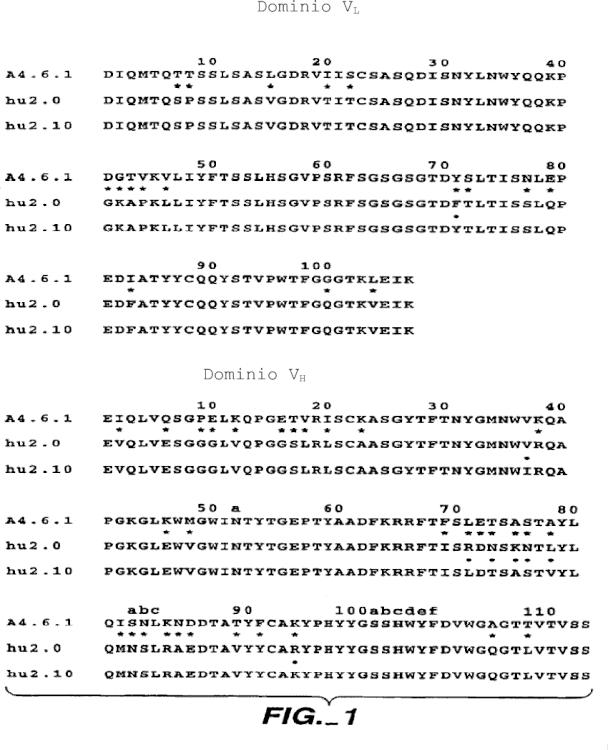
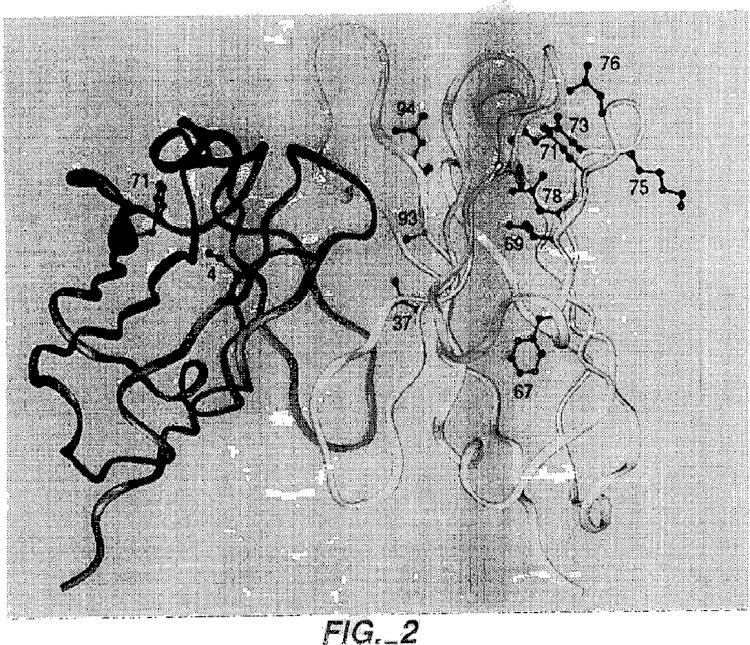
comprendiendo el método: (a) injertar regiones determinantes de complementariedad (CDR) no humanas en una región estructural humana que comprende VLκ subgrupo I (VLκI) y VH subgrupo III (VHIII); (b) mutagenizar aleatoriamente residuos de la región estructural de un grupo de trece posiciones críticas de la región estructural; (c) expresar de forma monovalente la biblioteca resultante de moléculas de anticuerpo en la superficie del fago filamentoso; (d) identificar las secuencias óptimas de la región estructural mediante selección basada en afinidad; y (e) opcionalmente mutar adicionalmente anticuerpos seleccionados mediante la sustitución de residuos vernier que se sitúan en el interfaz VL-VH por residuos que se emparejan con el anticuerpo parental no humano, donde los residuos críticos de la región estructural de la etapa (b) son los residuos 4 y 71 de VL y los residuos 24, 37, 67, 69, 71, 73, 75, 76, 78, 93 y 94 (numeración de Kabat) de VH
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05077948.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY SOUTH SAN FRANCISCO, CA 94080-4990 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BACA, MANUEL, WELLS, JAMES, A., PRESTA, LEONARD, G..
Fecha de Publicación: .
Fecha Solicitud PCT: 3 de Abril de 1998.
Clasificación Internacional de Patentes:
- C07K16/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/00 C07K […] › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
- C12N15/73 C12N 15/00 […] › Sistemas de expresión que utilizan secuencias reguladoras del fago l.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2361267_T3.pdf
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
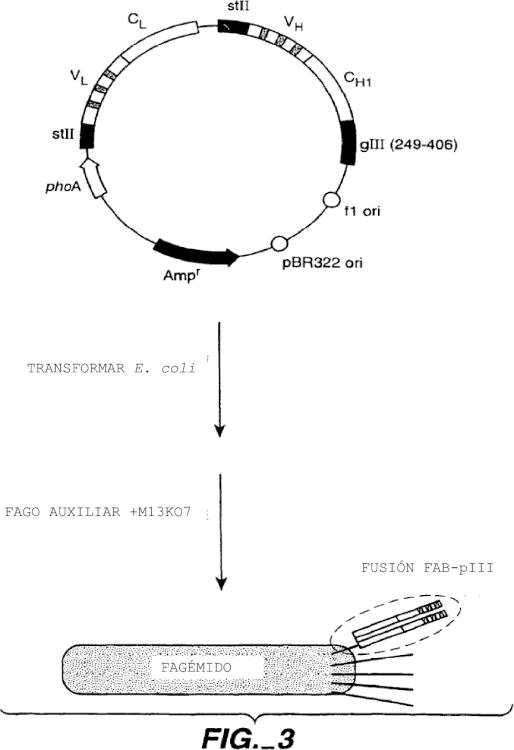
La presente invención está dirigida a procedimientos para preparar anticuerpos humanos. En particular, la presente invención está dirigida a procedimientos para preparar anticuerpos humanizados usando un sistema de presentación en fagos monovalente y de mutantes de anticuerpos producidos por mutagénesis aleatoria de un pequeño grupo de residuos estructurales críticos realizados en una sola región estructural humana. Más particularmente, esta invención está dirigida a la humanización de un anticuerpo murino que se une al factor de crecimiento del endotelio vascular (VEGF).
ANTECEDENTES DE LA INVENCIÓN
Los anticuerpos monoclonales (mAbs) tienen un potencial enorme como agentes terapéuticos, particularmente cuando se usan para regular sistemas definidos. Por ejemplo, en algunas circunstancias se podría desear regular un sistema, como por ejemplo la angiogénesis, en la que se forman vasos capilares nuevos a partir de las paredes de los vasos pequeños existentes. La angiogénesis generalmente es importante después de la aparición de una herida o de una infección ya que en los tejidos adyacentes a la lesión se puede estimular la inducción de crecimiento capilar. Sin embargo, la angiogénesis también es importante en el crecimiento tumoral, ya que, para un crecimiento continuado, un tumor debe inducir la formación de una red capilar que invada la masa tumoral.
Se han identificado determinados factores de crecimiento que regulan la angiogénesis. De particular interés es el factor de crecimiento del endotelio vascular (VEGF), que parece ser el agente por el cual algunos tumores adquieren su gran irrigación sanguínea. Molecular Biology of the Cell, 3rd Ed., Alberts et al., Garland Publishing, págs. 1154 (1994). Por lo tanto, los mAbs anti VEGF, por ejemplo, pueden ser útiles por un variedad de razones, incluyendo su uso en la regulación de la angiogénesis y más particularmente, como un agente antitumoral. Previamente se ha descrito un mAB A4.6.1 murino anti VEGF que bloquea la unión al receptor de VEGF. Se ha demostrado que este anticuerpo inhibe la señalización mitogénica. Kim y col., Growth Factors 7, 53 (1992); Kim y col., Nature 362, 841 (1993).
La mayoría de mABs incluyendo el anti VEGF descrito anteriormente tienen un origen murino y otras fuentes no humanas, lo que limita la eficacia clínica. En particular, el cuerpo a menudo reacciona con una respuesta inmunogénica frente a los anticuerpos no humanos, en la que se elimina rápidamente el anticuerpo del sistema antes de que se produzca su efecto terapéutico. Además de la inmunogenicidad de los mAbs no humanos, que aparece cuando se administran a humanos, existen limitaciones adicionales debidas a la débil incorporación de función efectora.
Para sortear estas deficiencias, se pueden conferir las propiedades de unión antigénica de los mAbs no humanos a los anticuerpos humanos a través de un procedimiento conocido como “humanización” del anticuerpo. Un anticuerpo humanizado contiene la secuencia aminoacídica de seis regiones determinantes de complementariedad (CDR) (el centro de unión al antígeno de la molécula de anticuerpo) del mAb no humano parental o correspondiente, injertado en la región estructural de un anticuerpo humano. Por lo tanto, la humanización de anticuerpos no humanos se conoce generalmente como injertos de CDR. El bajo contenido de secuencia no humana en tales anticuerpos humanizados (~5%) tiene una eficacia demostrada en la reducción de la inmunogenicidad y en la prolongación de la vida media sérica de los anticuerpos administrados a los humanos. Entre otros, los anticuerpos monoclonales humanizados (“inmunoglobulinas quiméricas”) se describen en la patente de EE.UU. Nº 4.816.567.
Desafortunadamente, la simple inserción de secuencias de CDR a menudo produce anticuerpos humanizados que se unen al antígeno de modo mucho más débil que el mAb parental no humano. Para restaurar la alta afinidad de unión, el anticuerpo debe atravesar procesos adicionales para ajustar la estructura de las hélices de unión al antígeno. Esto se logra reemplazando residuos clave en las regiones estructurales del los dominios variables del anticuerpo con la secuencia que encaje con la del anticuerpo murino parental. Estos residuos estructurales normalmente están implicados en el mantenimiento de la conformación de las hélices de CDR, aunque algunos residuos estructurales pueden contactar directamente con el antígeno. Se han realizado estudios que han evidenciado la importancia de determinados residuos estructurales para la conformación de las CDR y se ha recopilado una exhaustiva lista de todos los residuos estructurales que puedan afectar a la unión al antígeno.
**(Ver fórmula)**
Chothia et al., J. Mol. Biol. 224, 487 (1992); Foote et al., J. Mol. Biol. 224, 489 (1992). La lista exhaustiva incluye unos treinta residuos “vernier” que pueden potencialmente contribuir a la estructura de las CDR. Aunque probablemente se produciría una mayor afinidad de unión al antígeno al cambiar todo el conjunto de residuos vernier de un anticuerpo humanizado de modo que encajara con la secuencia no humana parental correspondiente, esto no sería generalmente deseable debido a un aumento del riesgo de inmunogenicidad impuesta al añadir elementos adicionales de secuencia no humana. Así, desde un punto de vista terapéutico, es preferible limitar los cambios estructurales a un conjunto mínimo para obtener un anticuerpo humanizado de alta afinidad.
Por lo tanto, es deseable identificar un pequeño grupo de cambios que sean suficientes para optimizar la unión, sin embargo, se espera que los cambios requeridos difieran de un anticuerpo humanizado a otro. Para lograr el resultado deseado, un enfoque ha sido identificar la combinación adecuada de mutaciones construyendo un panel de mutaciones que tengan residuos estructurales “candidatos” reemplazados por sus homólogos murinos. Estas variantes se forman individualmente y se prueban con antígenos y después se combinan con otras variantes que tienen afinidades de unión favorables. Sin embargo, este procedimiento implica ciclos de mutagénesis dirigida individual, aislamiento y análisis y por lo tanto no es deseable ya que es una labor muy costosa y tediosa.
Para simplificar la humanización de anticuerpos, se han desarrollado varios enfoques diferentes. Véase, por ejemplo, Queen y col., PNASUSA 86, 10029(1989); Kettleborough et al., Protein Eng. 4,773(1991); Tempest et al., Biotechnology 9, 266 (1991); Padlan, Mol. Immunol. 28, 489 (1991); Roguska et al., PNAS USA 91, 969 (1994); Studnicka et al., Protein Eng. 7, 805 (1994); Allen et al., J. Immunol. 135, 368 (1985); Carter et al., PNAS USA 89,4285 (1992); Presta et al., J. Immunol. 151, 2623 (1993); Eigenbrot et al., Proteins 18, 49 (1994); Shalaby et al., J.Exp. Med. 175, 217 (1992); Kabat et al., Sequences of Proteins of Immunological Interest, (5th), Public Health Service,NIH, Bethesda, MD (1991); Rosok et al., J. Biol. Chem. 271, 22611 (1996); WO-A-92/22653, GB-A-2 268 744, y WO 94/04679. El documento WO-A-92/22653 incluye una lista de sitios de mutación preferentes. Es un objeto de la presente invención el proporcionar medios generales para seleccionar rápidamente mutaciones estructurales que mejoren la unión de anticuerpos humanizados a sus antígenos cognados en donde se eliminan los procedimientos actuales de optimización estructural basados en ciclos de mutagénesis dirigida individual y análisis.
Es además un objeto el proporcionar procedimientos rápidos de anticuerpos humanizantes que proporcionen anticuerpos con una baja inmunogenicidad y que utilicen una sola región estructural como respaldo.
DESCRIPCIÓN RESUMIDA DE LA INVENCIÓN
El anticuerpo humanizado inicial anti VEGF tiene una región estructural que deriva de secuencias de consenso para las subclases humanas más abundantes, a saber, Vκ subgrupo I (VκI) y Vsubgrupo III (VIII) en
LIH H
las que se injertan CDR de anticuerpos no humanos anti VEGF. La mutagénesis aleatoria de los residuos estructurales críticos en la construcción inicial produjo el anticuerpo humanizado anti VEGF descrito en la presente memoria descriptiva que tiene una afinidad por el antígeno 125 veces mayor en relación con el anticuerpo humanizado inicial sin cambios estructurales. Una sola mutación adicional produjo una mejora de seis veces en la unión. Este anticuerpo anti VEGF humanizado se puede reproducir por el procedimiento descrito en la presente memoria... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para producir e identificar mutaciones en la región estructural que mejora la unión de anticuerpos humanizados con sus antígenos afines, comprendiendo el método:
(a) injertar regiones determinantes de complementariedad (CDR) no humanas en una región estructural humana que comprende VLκ subgrupo I (VLκI) y VH subgrupo III (VHIII);
(b) mutagenizar aleatoriamente residuos de la región estructural de un grupo de trece posiciones críticas de la región estructural;
(c) expresar de forma monovalente la biblioteca resultante de moléculas de anticuerpo en la superficie del fago filamentoso;
(d) identificar las secuencias óptimas de la región estructural mediante selección basada en afinidad; y
(e) opcionalmente mutar adicionalmente anticuerpos seleccionados mediante la sustitución de residuos vernier que se sitúan en el interfaz VL-VH por residuos que se emparejan con el anticuerpo parental no humano,
donde los residuos críticos de la región estructural de la etapa (b) son los residuos 4 y 71 de VL y los residuos 24, 37, 67, 69, 71, 73, 75, 76, 78, 93 y 94 (numeración de Kabat) de VH.
2. Procedimiento según la reivindicación 1, en el que los residuos críticos de la región estructural son parcialmente aleatorios para permitir la selección de una secuencia de la región estructural murina, la secuencia de la región estructural consenso VLκI-VHIII humana, o las secuencias de la región estructural halladas generalmente en otras regiones estructurales humanas y murinas.
3. Procedimiento según cualquiera de las reivindicaciones 1 a 2, en el que el anticuerpo humanizado es un anticuerpo anti-VEGF.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Método para el tratamiento de la osteoporosis, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina que comprende una CDR-H1 de la SEQ ID NO: 245, una CDR-H2 de la SEQ ID NO: 246, una CDR-H3 de la SEQ ID NO: 247, […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
 Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Método para tratar la pérdida de hueso alveolar mediante el uso de anticuerpos antiesclerostina, del 3 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina para su uso en un método para aumentar la altura del hueso alveolar en un sujeto que padece pérdida de hueso alveolar, donde […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]