PROCEDIMIENTO PARA LA GENERACIÓN DE LÍNEAS CELULARES QUE PRODUCEN VIRUS Y LÍNEAS CELULARES.
Método para la generación de una línea celular que produce virus que comprende las siguientes etapas:
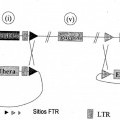
a.) introducir en una línea celular productora madre un constructo de nucleótidos que comprende un casete de nucleótidos de interés (NOI) que comprende: i) al menos un NOI operativamente unido a un promotor; ii) repeticiones terminales largas (LTR) ubicadas en el sentido de 5' y en el sentido de 3' de la secuencia de NOI, respectivamente; iii) un fragmento de marcador de selección no funcional Ia ubicado en el sentido de 3' de la LTR en 3' que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento de marcador complementario Ib presente en la línea celular productora madre; y iv) secuencias que permiten la integración específica de sitio del casete NOI en un primer casete de expresión presente en dicha línea celular productora madre, dichas secuencias flanquean el casete NOI en ambos sitios de dicho casete; e b.) introducir en la línea celular productora de células madre un constructo de nucleótidos que comprende un casete de expresión env que comprende i) secuencia(s) del/de los gen(es) env operativamente unida(s) a un promotor; ii) un fragmento de marcador de selección no funcional IIa que permite la formación de un marcador de selección funcional II que puede ser idéntico o diferente del marcador de selección funcional I cuando se combina con el fragmento de marcador complementario IIb presente en la línea celular productora madre, estando dicho fragmento de marcador de selección no funcional IIa ubicado en el sentido de 3' de la(s) secuencia(s) del/de los gen(es) env; iii) secuencias que permiten la integración específica de sitio de dicho casete env en un segundo casete de expresión etiquetado presente en dicha línea celular productora madre, dichas secuencias flanquean el casete env en ambos sitios de dicho casete; c.) iniciar el reemplazo del casete NOI y/o el casete env por el casete de expresión correspondiente presente en la línea celular productora madre; d.) seleccionar líneas celulares que han integrado de manera estable el casete NOI y/o el casete env basándose en el/los marcador(es) de selección funcional(es); en el que no se determina el orden de la etapa a.) y b.) y en el que las etapas c.) y d.) pueden llevarse a cabo tras cada una de las etapas a.) y b.) o tras llevar a cabo las etapas a.) y b.); con la condición de que la línea celular productora madre usada en a.) y b.), respectivamente, pueda obtenerse I) integrando de manera estable un casete de expresión en el genoma de una célula huésped o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3': i) una primera secuencia que permite la integración específica de sitio; ii) un promotor; iii) una secuencia que codifica para un marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii); iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i); v) un fragmento de marcador de selección no funcional Ib que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento complementario Ia presente en el casete NOI; II) seleccionando una línea celular transducida en la que el casete de expresión de (I) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de I); III) integrando de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3': i) una primera secuencia que permite la integración específica de sitio; ii) un promotor; iii) una secuencia que codifica para un marcador de selección B que es diferente del marcador de selección A, dicha secuencia esta operativamente unida con el promotor de ii); iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i); v) un fragmento de marcador de selección no funcional IIb que permite la formación de un marcador de selección funcional II cuando se combina con el fragmento complementario IIa presente en el casete de expresión env que puede ser igual o puede ser diferente al fragmento de marcador de selección Ib; en el que las secuencias que permiten la integración específica de sitio pueden ser idénticas o pueden ser diferentes a dichas secuencias del casete de expresión de I); IV) seleccionando una línea celular transducida en la que el casete de expresión de (III) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de (III); V) integrando de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que contiene un promotor operativamente unido a una secuencia que codifica para gag/pol; VI) seleccionando una línea celular transducida en la que el casete de expresión de (V) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de V; y en el que no se determina el orden de la integración de los diferentes casetes de expresión según (I), (III) y (V) y en el que el marcador de selección I y II son diferentes de A o B
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/011667.
Solicitante: HELMHOLTZ-ZENTRUM FUR INFEKTIONSFORSCHUNG GMBH.
Nacionalidad solicitante: Alemania.
Dirección: INHOFFENSTRASSE 7 38124 BRAUNSCHWEIG ALEMANIA.
Inventor/es: HAUSER, HANSJORG, WIRTH, DAGMAR, DR., SCHUCHT,Roland.
Fecha de Publicación: .
Fecha Solicitud PCT: 1 de Noviembre de 2005.
Clasificación Internacional de Patentes:
- C12N15/867 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores retrovirales.
Clasificación PCT:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/867 C12N 15/00 […] › Vectores retrovirales.
- C12N15/90 C12N 15/00 […] › Introducción estable de ADN extraño en el cromosoma.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N7/01 C12N […] › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Virus, p. ej. Bacteriófagos, modificados por la introducción de material genético externo (vectores C12N 15/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2356553_T3.pdf



Fragmento de la descripción:
La presente invención se refiere a un procedimiento para generar líneas celulares que producen virus y líneas celulares productoras madre. En particular, la presente invención se refiere a métodos que permiten la producción de líneas celulares que producen virus y líneas celulares productoras madre sin llevar a cabo un trabajo de selección laborioso. Además, la presente invención se refiere a líneas celulares que producen virus obtenidas con los métodos según la presente invención así como a virus obtenidos usando dichas líneas celulares.
Antecedentes de la invención
Recientes éxitos en ensayos clínicos de terapia génica han demostrado el alto potencial del uso de la terapia génica para curar y ralentizar una gran variedad de enfermedades. Sin embargo, la introducción eficaz de genes terapéuticos en células o tejidos humanos sigue siendo el principal problema que ha de solucionarse.
Se han sugerido diversos métodos para introducir los nucleótidos o genes terapéuticos en las células o el tejido incluyendo el uso de vectores virales. Generalmente, en las células se expresan genes auxiliares virales (las denominadas funciones auxiliares) para empaquetar específicamente el gen terapéutico de interés en partículas virales y para transducir el mismo en las células o tejidos diana. Se usan frecuentemente vectores adenovirales dado que las partículas son robustas, pueden producirse fácilmente en altos títulos e infectar eficazmente un amplio espectro de células. Los retrovirus, en particular los géneros de retrovirus y lentivirus de tipo C de mamíferos representan el tipo de virus ampliamente usado para la transferencia génica estable y la expresión del producto génico. Se han desarrollado sistemas de vectores altamente sofisticados para fines especializados. El conocimiento de la técnica anterior se basa principalmente en virus de tipo C de mamíferos. Por consiguiente, la mayoría de los ensayos de terapia génica se basan en este sistema de transferencia de virus. Estos métodos de administración génica retroviral recombinante se han usado exhaustivamente en vista de las siguientes ventajas: i.) la entrada eficaz del material genético en las células; ii.) un proceso eficaz, activo de entrada en el núcleo de la célula diana; iii.) niveles relativamente altos de expresión génica; iv.) el potencial para seleccionar como diana subtipos celulares mediante el control de la unión vector-célula diana y el control específico de tejido de la expresión; v.) una falta general de inmunidad preexistente del huésped; y vi.) conocimiento sustancial y experiencia clínica que se ha obtenido con tales vectores.
En la actualidad, se usan satisfactoriamente retrovirus para la transducción ex vivo en experimentos de terapia génica. Sin embargo, la tecnología de producción para vectores retrovirales está en un estado temprano. Las terapias se ven dificultadas por i) la inestabilidad inherente de las partículas virales infecciosas, ii) la dificultad para producir grandes cantidades de virus, y iii) la amplia gama de huéspedes de las envueltas virales disponibles actualmente y la sensibilidad al ataque por el complemento humano. Por tanto, tanto para aplicaciones ex vivo como in vivo, sus desarrollos significativos impiden una aplicación extendida de la terapia génica retroviral. En la actualidad, uno de los principales obstáculos es la producción de un gran número de virus estables. Dicho proceso de producción comprende la generación de virus, por ejemplo vectores retrovirales, con líneas celulares que producen virus.
Los retrovirus recombinantes para su uso en terapia génica transducen un vector retroviral que codifica para el gen efector (terapéutico) o secuencia de nucleótidos terapéutica en las células o tejidos diana. En la actualidad, se producen tras la transfección del vector en las denominadas líneas celulares de empaquetamiento que expresan de manera estable las proteínas virales gag/pol y env. Este principio se aplica para los vectores clásicos basados en virus de la leucemia murina de Moloney (VLM). Los lentivirus se producen principalmente a partir de sistemas de expresión transitoria dado que la toxicidad de los genes auxiliares, en particular, de la proteína VSV-G (véase a continuación) requiere una expresión restringida en el tiempo.
La construcción de células de empaquetamiento para vectores retrovirales es un procedimiento tedioso. Se necesitan la transfección secuencial de constructos de expresión de gag/pol y env apropiados y procedimientos de selección que requieren mucho tiempo para lograr una expresión equilibrada y de alto nivel de todos los componentes. La heterogeneidad en la expresión mediante clones celulares individuales se debe a i.) la integración al azar de los genes auxiliares en el ADN cromosómico de la célula huésped y ii.) números de copias variables de los constructos transfectados. En la actualidad, se aplica la subclonación y el examen de subclones individuales para aislar células de empaquetamiento adecuadas.
Las proteínas de la envuelta exterior (env) son ligandos para receptores celulares que median la entrada viral y definen la gama de huéspedes del virus. Los retrovirus permiten la sustitución de sus env y se derivan partículas retrovirales mixtas mediante esta técnica denominada pseudotipado. Para este fin, se usan proteínas env que se han aislado de virus no murinos que se producen de manera natural (por ejemplo GALV, virus de la leucemia del simio gibón y VEV G (virus de la estomatitis vesicular, proteína G). Además, se ha creado un gran número de nuevas proteínas env mediante técnicas recombinantes principalmente con el objetivo de especificar la gama de huéspedes, logrando de ese modo el direccionamiento del virus a tipos de células específicas, y confiriendo resistencia al complemento humano. Desarrollos adicionales en las proteínas env prometen terapias mejoradas. Esto también es importante en vista de la inestabilidad de los retrovirus inherente conocida que se debe en gran medida a las proteínas env. La inestabilidad de los retrovirus durante el proceso de producción, almacenamiento o durante los procedimientos de purificación es una limitación importante para la mayoría de las aplicaciones. En la actualidad, la única manera de mejorar significativamente la estabilidad retroviral es reemplazando la proteína env por la proteína VEV G, dando como resultado partículas que pueden concentrarse y almacenarse durante un periodo de tiempo prolongado. A pesar de su ventaja en el uso de VEV G para pseudotipar retrovirus, la expresión de VEV G es tóxica para las células productoras. Hasta la fecha se producen partículas de virus seudotipados con VEV G en sistemas de transfección transitoria o mediante la expresión inducible de la proteína VEV G, lo que limita, por tanto, la aplicabilidad del sistema.
El uso de las proteínas env novedosas para fines terapéuticos se ve actualmente dificultado por el hecho de que para cada una de las diferentes proteínas env, ha de construirse una línea celular de empaquetamiento individual. Cada una de estas líneas celulares ha de establecerse de nuevo según los procedimientos descritos anteriormente dado que aún no se han desarrollado métodos más económicos.
Los problemas descritos anteriormente se aplican, cambiando lo que se deba cambiar, a otro sistema viral, como el sistema de lentivirus, el sistema de adenovirus y el de virus asociados a adenovirus.
Por tanto, para la producción eficaz de retrovirus, deben expresarse los genes auxiliares virales (gag/pol y env) así como el vector terapéutico en una denominada razón “equilibrada” en líneas celulares productoras. Según el estado de la técnica, se establecen líneas celulares de empaquetamiento como precursores mediante integración al azar de los genes auxiliares virales en el genoma de la célula huésped. Dado que el sitio de integración influye de manera drástica en la expresión del gen recombinante y su estabilidad, se requiere una selección intensiva para aislar clones celulares de empaquetamiento óptimos. Este procedimiento ha de seguirse independientemente para cualquier gen env. Incluso una vez que se establezca esta línea celular de empaquetamiento, ha de realizarse una segunda ronda de selección para la preparación de las partículas de virus terapéuticos. Para el establecimiento de las células de empaquetamiento que producen retrovirus terapéuticos, es decir, líneas celulares que producen virus, las células de empaquetamiento han de transfectarse con un vector terapéutico. La naturaleza del sitio de integración elegido de manera aleatoria así... [Seguir leyendo]
Reivindicaciones:
1. Método para la generación de una línea celular que produce virus que comprende las siguientes etapas:
a.) introducir en una línea celular productora madre un constructo de nucleótidos que comprende un casete de nucleótidos de interés (NOI) que comprende:
i) al menos un NOI operativamente unido a un promotor;
ii) repeticiones terminales largas (LTR) ubicadas en el sentido de 5' y en el sentido de 3' de la secuencia de NOI, respectivamente;
iii) un fragmento de marcador de selección no funcional Ia ubicado en el sentido de 3' de la LTR en 3' que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento de marcador complementario Ib presente en la línea celular productora madre; y
iv) secuencias que permiten la integración específica de sitio del casete NOI en un primer casete de expresión presente en dicha línea celular productora madre, dichas secuencias flanquean el casete NOI en ambos sitios de dicho casete; e
b.) introducir en la línea celular productora de células madre un constructo de nucleótidos que comprende un casete de expresión env que comprende
i) secuencia(s) del/de los gen(es) env operativamente unida(s) a un promotor;
ii) un fragmento de marcador de selección no funcional IIa que permite la formación de un marcador de selección funcional II que puede ser idéntico o diferente del marcador de selección funcional I cuando se combina con el fragmento de marcador complementario IIb presente en la línea celular productora madre, estando dicho fragmento de marcador de selección no funcional IIa ubicado en el sentido de 3' de la(s) secuencia(s) del/de los gen(es) env;
iii) secuencias que permiten la integración específica de sitio de dicho casete env en un segundo casete de expresión etiquetado presente en dicha línea celular productora madre, dichas secuencias flanquean el casete env en ambos sitios de dicho casete;
c.) iniciar el reemplazo del casete NOI y/o el casete env por el casete de expresión correspondiente presente en la línea celular productora madre;
d.) seleccionar líneas celulares que han integrado de manera estable el casete NOI y/o el casete env basándose en el/los marcador(es) de selección funcional(es);
en el que no se determina el orden de la etapa a.) y b.) y en el que las etapas c.) y d.) pueden llevarse a cabo tras cada una de las etapas a.) y b.) o tras llevar a cabo las etapas a.) y b.);
con la condición de que la línea celular productora madre usada en a.) y b.), respectivamente, pueda obtenerse
I) integrando de manera estable un casete de expresión en el genoma de una célula huésped o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional Ib que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento complementario Ia presente en el casete NOI;
II) seleccionando una línea celular transducida en la que el casete de expresión de (I) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de I);
III) integrando de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección B que es diferente del marcador de selección A, dicha secuencia esta operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional IIb que permite la formación de un marcador de selección funcional II cuando se combina con el fragmento complementario IIa presente en el casete de expresión env que puede ser igual o puede ser diferente al fragmento de marcador de selección Ib;
en el que las secuencias que permiten la integración específica de sitio pueden ser idénticas o pueden ser diferentes a dichas secuencias del casete de expresión de I);
IV) seleccionando una línea celular transducida en la que el casete de expresión de (III) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de (III);
V) integrando de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que contiene un promotor operativamente unido a una secuencia que codifica para gag/pol;
VI) seleccionando una línea celular transducida en la que el casete de expresión de (V) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de V;
y en el que no se determina el orden de la integración de los diferentes casetes de expresión según (I), (III) y (V) y en el que el marcador de selección I y II son diferentes de A o B.
2. Método para la generación de una línea celular que produce virus que comprende las siguientes etapas:
a.) introducir en una línea celular productora madre un constructo de nucleótidos que comprende un casete de nucleótidos de interés (NOI) que comprende:
i) al menos un NOI operativamente unido a un promotor;
ii) repeticiones terminales largas (LTR) ubicadas en el sentido de 5' y en el sentido de 3' de la secuencia de NOI, respectivamente;
iii) un fragmento de selección no funcional Ia ubicado en el sentido de 3' de la LTR en 3' que permite la formación de un dominio de selección funcional I cuando se combina con el fragmento complementario Ib presente en la línea celular productora madre; y
iv) secuencias que permiten la integración específica de sitio del casete NOI en un primer casete de expresión presente en dicha línea celular productora madre, dichas secuencias flanquean el casete NOI en ambos sitios de dicho casete; y opcionalmente
b.) introducir en la línea celular productora de células madre un constructo de nucleótidos que comprende un casete de expresión env que comprende
i) secuencia(s) de gen(es) env operativamente unida(s) a un promotor;
ii) un fragmento de marcador de selección no funcional IIa que permite la formación de un marcador de selección funcional II que puede ser igual o diferente del marcador de selección funcional I cuando se combina con el fragmento de marcador complementario IIb presente en la línea celular productora madre, estando dicho fragmento de marcador de selección no funcional IIa ubicado en el sentido de 3' de la(s) secuencia(s) de gen(es) env;
iii) secuencias que permiten la integración específica de sitio de dicho casete env en un casete de expresión env presente en dicha línea celular productora madre, dichas secuencias flanquean el casete env en ambos sitios de dicho casete;
c.) iniciar el reemplazo del casete NOI y/o el casete env por el casete de expresión correspondiente presente en la línea celular productora madre;
d.) seleccionar líneas celulares que han integrado de manera estable el casete NOI y/o el casete env basándose en el/los dominio(s) de selección funcional(es);
en el que no se determina el orden de la etapa a.) y opcionalmente b.) y en el que la etapa c.) y d.) pueden llevarse a cabo tras cada una de las etapas a.) y b.) o tras llevar a cabo las etapas a.) y b.);
con la condición de que la línea celular productora madre usada en a.) y b.), respectivamente, pueda obtenerse
I) integrando de manera estable un casete de expresión en el genoma de una célula huésped o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional Ib que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento complementario Ia presente en el casete NOI;
II) seleccionando una línea celular transducida en la que el casete de expresión de (I) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de I);
III) integrando de manera estable un casete de expresión env en el genoma de dicha célula o línea celular, dicho casete de expresión env comprende un constructo de nucleótidos que comprende:
i) opcionalmente una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) secuencia(s) de gen(es) env operativamente unida(s) al promotor de ii);
iv) opcionalmente una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) opcionalmente un fragmento de marcador de selección no funcional IIb que permite la formación de un marcador de selección funcional II cuando se combina con el fragmento complementario IIa presente en el casete de expresión env que puede ser igual
o puede ser diferente al fragmento de marcador de selección Ib;
en el que las secuencias que permiten la integración específica de sitio pueden ser idénticas o pueden ser diferentes a dichas secuencias del casete de expresión de I);
(IV) seleccionando una línea celular transducida en la que el casete de expresión de (III) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de (III);
(V) integrando de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que contiene un promotor operativamente unido a una secuencia que codifica para gag/pol;
(VI) seleccionando una línea celular transducida en la que el casete de expresión de (V) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de V;
y en el que no se determina el orden de la integración de los diferentes casetes de expresión según (I), (III) y (V) y en el que el marcador de selección I y II son diferentes al marcador de selección A o B.
3. Método para la generación de una línea celular productora madre que comprende las etapas de I) integrar de manera estable un casete de expresión en el genoma de una célula huésped o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional Ib que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento complementario Ia presente en el casete NOI;
II) seleccionar una línea celular transducida en la que el casete de expresión de (I) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de I);
III) integrar de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección B que es diferente del marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional IIb que permite la formación de un marcador de selección funcional II cuando se combina con el fragmento complementario IIa presente en el casete de expresión env que puede ser igual o puede ser diferente al fragmento de marcador de selección Ib;
en el que las secuencias que permiten la integración específica de sitio pueden ser idénticas o pueden ser diferentes a dichas secuencias del casete de expresión de I);
IV) seleccionar una línea celular transducida en la que el casete de expresión de (III) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de (III);
V) integrar de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que contiene un promotor operativamente unido a una secuencia que codifica para gag/pol;
VI) seleccionar una línea celular transducida en la que el casete de expresión de (V) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de V;
y en el que no se determina el orden de la integración de los diferentes casetes de expresión según (I), (III) y (V).
4. Método para la generación de una línea celular productora madre que comprende las etapas de:
I) integrar de manera estable un casete de expresión en el genoma de una célula huésped o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que comprende desde el extremo 5' hasta el extremo 3':
i) una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) una secuencia que codifica para un marcador de selección A, dicha secuencia está operativamente unida con el promotor de ii);
iv) una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
v) un fragmento de marcador de selección no funcional Ib que permite la formación de un marcador de selección funcional I cuando se combina con el fragmento complementario Ia presente en el casete NOI;
II) seleccionar una línea celular transducida en la que el casete de expresión de (I) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de I);
III) integrar de manera estable un casete de expresión env en el genoma de dicha célula o línea celular, dicho casete de expresión env comprende un constructo de nucleótidos que comprende:
i) opcionalmente una primera secuencia que permite la integración específica de sitio;
ii) un promotor;
iii) secuencia(s) de gen(es) env operativamente unida(s) al promotor de ii);
iv) opcionalmente una segunda secuencia que permite la integración específica de sitio, dicha secuencia es diferente de la primera secuencia de i);
vi) opcionalmente un fragmento de marcador de selección no funcional IIb que permite la formación de un marcador de selección funcional II cuando se combinan con el fragmento complementario IIa presente en el casete de expresión env que
puede igual o puede ser diferente al fragmento de marcador de selección Ib;
en el que las secuencias que permiten la integración específica de sitio pueden ser idénticas o pueden ser diferentes a dichas secuencias del casete de expresión de I);
(IV) seleccionar una línea celular transducida en la que el casete de expresión de (III) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de (III);
(V) integrar de manera estable un casete de expresión diferente en el genoma de la célula o línea celular, dicho casete de expresión comprende un constructo de nucleótidos que contiene un promotor operativamente unido a una secuencia que codifica para gag/pol;
(VI) seleccionar una línea celular transducida en la que el casete de expresión de (V) está integrado de manera estable en el genoma del huésped dando como resultado una línea celular transducida etiquetada con el casete de expresión de V;
y en el que el no se determina el orden de la integración de los diferentes casetes de expresión según (I),
(III) y (V).
5. Método según una cualquiera de las reivindicaciones 1 a 4, en el que los casetes de expresión de (I) y/o
(III) contienen adicionalmente una LTR en 5' y en 3'.
6. Método según una cualquiera de las reivindicaciones 1 a 5, en el que la introducción del/de los constructo(s) de nucleótidos se realiza mediante transfección o una infección.
7. Método según una cualquiera de las reivindicaciones 1, 2, 5, 6, en el que la integración de los casetes se efectúa mediante un sistema de recombinasa y/o mediante enzimas de restricción.
8. Método según la reivindicación 7, en el que el sistema de recombinasa son los sitios de reconocimiento recombinasa Cre/loxP del bacteriófago P1 o la recombinasa FLP específica de sitio de S. cerevisae.
9. Método según la reivindicación 1 ó 2, en el que el sistema de recombinación para la integración específica de sitio es el sistema FLP que usa diferentes variantes de dianas de reconocimiento de FLP (FRT) en el que las secuencias que flanquean el casete NOI y el casete env en ambos sitios y que permiten la recombinación específica de sitio son secuencias que no interaccionan siendo diferentes entre si.
10. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 9, en el que el fragmento de marcador de selección no funcional presente en el casete NOI y/o el casete env contiene un promotor o un elemento IRES operativamente unido a una secuencia de codón de iniciación que permite la expresión de un marcador de selección diferente al marcador de selección A o B cuando se complementa con el fragmento de marcador de selección no funcional complementario.
11. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 10, en el que el fragmento de marcador de selección no funcional presente en el casete NOI y/o el casete env contiene sólo un promotor que activa un marcador de selección silencioso pero funcional integrado tras la etapa de etiquetado.
12. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 11, en el que el fragmento de marcador de selección no funcional presente en el casete NOI y/o el casete env contienen una señal de corte y empalme que permite la traducción del marcador de selección.
13. Método según la reivindicación 1 ó 2, en el que el NOI codifica para una molécula seleccionada del grupo que consiste en proteínas, péptidos, secuencias de ácido nucleico antisentido, ribozimas y ARNip.
14. Método según la reivindicación 1, 2 ó 13, en el que el NOI es una molécula terapéuticamente útil.
15. Método según una cualquiera de las reivindicaciones 1, 3, 5 a 14, en el que los marcadores de selección A y/o B se seleccionan del grupo que consiste en marcadores de resistencia a antibióticos, de resistencia a fármacos, de expresión celular y extracelular.
16. Método según la reivindicación 15, en el que los marcadores de selección A y/o B se seleccionan del grupo que consiste en GFP, -galactosidasa, fosfatasa alcalina secretada y marcadores de superficie celular.
17. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 16, en el que el promotor al que el NOI y/o el gen env está operativamente unido según a.) i) o b.) i) es una LTR ubicada en el sentido de 5' del NOI y/o el gen env, respectivamente.
18. Método según una cualquiera de las reivindicaciones anteriores, en el que al menos un casete contiene un promotor adicional operativamente unido a las secuencias que van a transcribirse.
19. Método según la reivindicación 18, en el que el promotor adicional se selecciona del grupo que consiste en promotores constitutivos y promotores para la expresión controlada o restringida en el tiempo.
20. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 19, en el que se introduce la recombinasa en la célula de empaquetamiento mediante transfección o infección.
21. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 19, en el que se introduce la recombinasa en el sistema proporcionando directamente la enzima a las células.
22. Método según una cualquiera de las reivindicaciones 1, 2, 5 a 19, en el que el gen que codifica para la recombinasa está integrado de manera estable en el genoma del huésped operativamente unido con un promotor inducible.
23. Método según una cualquiera de las reivindicaciones anteriores, en el que el virus está pseudotipado.
24. Línea celular que produce virus que puede obtenerse con un método según una cualquiera de las reivindicaciones 1, 2, y 5 a 23.
25. Línea celular productora madre que puede obtenerse con un método según una cualquiera de las reivindicaciones 3 a 22.
26. Uso de la línea celular que produce virus según la reivindicación 24 o la línea celular productora madre según la reivindicación 25 para la producción de virus.
27. Uso según la reivindicación 26 para la producción de una preparación terapéutica que contiene un virus o una partícula de virus para terapia génica.
Patentes similares o relacionadas:
Integración estable de los vectores de transferencia lentivirales SIN, del 20 de Mayo de 2020, de MOLMED SPA: Un sistema para la integracion estable de un vector de transferencia lentiviral autoinactivable (SIN) en una linea celular de empaquetamiento en donde […]
Polipéptidos para la ingeniería de proteínas integrasas quiméricas y su uso en terapia génica, del 12 de Febrero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un polipéptido que consiste en la secuencia de aminoácidos seleccionada del grupo consistente en la SEQ ID NO:2 a la SEQ ID NO:12.
Aislador para mejorar vectores de transferencia génica, del 1 de Enero de 2020, de FUNDACIÓN PÚBLICA ANDALUZA PROGRESO Y SALUD: Molécula de ácido nucleico que comprende: a. la SEQ ID No 1 y la SEQ ID No 2, o una secuencia complementaria de las mismas; o b. una molécula […]
Vector retroviral que tiene actividad inmunoestimuladora, del 25 de Diciembre de 2019, de Tocagen Inc: Un vector retroviral gamma competente para la replicación recombinante que comprende: una proteína retroviral GAG; una proteína retroviral POL; una cubierta […]
Compuestos y métodos para incrementar la transferencia génica viral en células hematopoyéticas humanas, del 6 de Noviembre de 2019, de UNIVERSITE DE MONTREAL: Un método para transducir un vector viral en células, y dicho método comprende poner en contacto dichas células in vitro con un compuesto de […]
Vectores lentivirales pseudotipados, del 16 de Octubre de 2019, de Sirion Biotech GmbH: Partícula de vector lentiviral pseudotipada con (a) una proteína de fusión de glicoproteína de la envuelta del virus de la estomatitis vesicular (VSV-G) […]
Purificación de virus, del 16 de Octubre de 2019, de Oxford BioMedica (UK) Limited: Un proceso para producir una formulación de vector retroviral adecuada para la administración a un paciente, que comprende una etapa de esterilización por filtrado y una […]
Vector dual para la inhibición del virus de la inmunodeficiencia humana, del 16 de Octubre de 2019, de Calimmune Inc: Una célula hospedadora preparada transduciendo una célula hematopoyética con un vector de expresión lentiviral, comprendiendo el vector de expresión lentiviral una primera […]