DETECCIÓN HOMOGÉNEA DE ANALITOS.
Un par de unión que comprende: un primer miembro de unión que comprende una primera molécula de especificidad acoplada al extremo 5' de un primer ácido nucleico;
y un segundo miembro de unión que comprende una segunda molécula de especificidad acoplada al extremo 3' de un segundo ácido nucleico, en el que los ácidos nucleicos primero y segundo forman un dúplex de estabilidad definida y limitada, en el que la primera molécula de especificidad es un primer anticuerpo y la segunda molécula de especificidad es un segundo anticuerpo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/040133.
Solicitante: IRIS MOLECULAR DIAGNOSTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9172 ETON AVENUE CHATSWORTH CA 91311 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ADAMS,THOMAS, JABLONSKI,EDWARD.
Fecha de Publicación: .
Fecha Solicitud PCT: 3 de Noviembre de 2005.
Fecha Concesión Europea: 8 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C07K16/30P
- C12N15/10C12
- C12Q1/68A2
- C12Q1/68B8
- G01N33/542 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con inhibición estérica o modificación de la señal, p. ej. extinción de fluorescencia.
Clasificación PCT:
- C12N15/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a procedimientos, composiciones y kit para determinar la presencia o concentración de un analito en una muestra.
ANTECEDENTES DE LA INVENCIÓN
Existe un deseo en el campo de la química clínica de determinar las concentraciones de proteínas, fármacos, organismos y otros analitos en los fluidos biológicos con el fin de diagnosticar y monitorizar enfermedades. Por ejemplo, durante el infarto de miocardio el corazón libera proteínas. La detección de la presencia, concentración y curso en el tiempo de la liberación de dichas proteínas puede ayudar a diagnosticar un ataque cardíaco.
Las proteínas más clínicamente relevantes que actualmente se detectan en los fluidos biológicos están presentes a concentraciones superiores a 1 picogramo/ml. Por ejemplo, el antígeno específico de la próstata (PSA) es una proteína sérica útil en la detección de enfermedad prostática que normalmente está presente en varones a concentraciones aproximadamente de 0-4 ng/ml. Los niveles de PSA superiores a 4 ng/ml indican sospecha de enfermedad prostática, particularmente cáncer de próstata. Este intervalo de concentración se detecta con facilidad mediante tecnología de inmunoensayo convencional. No obstante, tras la extirpación de la próstata, la concentración de PSA cae a niveles que son indetectables mediante tecnología convencional. El incremento de los niveles de PSA en pacientes de cáncer sometidos a la extirpación de la próstata es indicativo de recaída. Se requiere un ensayo con sensibilidad en femtogramos/ml para monitorizar a estos pacientes.
Se ha estimado que hay aproximadamente 35.000 genes y hasta 500.000 proteínas en la especie humana. La mayor diversidad de proteínas frente a los genes puede justificarse por las modificaciones postranscripcionales (p. ej., corte y empalme) y postraduccionales (p. ej., fosforilación, glicosilación). Dichas modificaciones pueden alterar de forma significativa la función de las proteínas. Por tanto, incluso sutiles diferencias pueden ser clínicamente relevantes. Sólo se han identificado 290 proteínas en el plasma humano, aunque hay miles de manchas que se observan en los geles en 2D. El proteoma plasmático humano puede contener cientos de miles de proteínas que están presentes a concentraciones demasiado bajas como para que se puedan detectar con la tecnología actual. Actualmente no se dispone de procedimientos para detectar la mayoría de estas proteínas.
La dificultad de detectar concentraciones bajas de ciertos analitos se mezcla con los tamaños relativamente pequeños de las muestras que se pueden utilizar en un ensayo clínico. Por tanto, la mayoría de los inmunoensayos para los analitos proteicos dependen de la metodología heterogénea, como ELISA (ENSAYO de inmunoabsorción ligado a enzimas), en los que el analito unido al anticuerpo se separa físicamente del analito no unido. Los procedimientos de detección heterogénea son complicados y requieren múltiples etapas (p. ej., unido a una fase sólida y repetidas etapas de lavado) para separar el analito unido del no unido. Estas etapas conducen a unión inespecífica y menor sensibilidad; pueden ser costosos y requerir tiempo. Por tanto, existe la necesidad de un ensayo homogéneo de alta sensibilidad que evite la unión inespecífica.
Los inmunoensayos homogéneos (aquéllos que no requieren una separación física de las especies unidas y las especies libres) se han descrito para moléculas pequeñas, tales como fármacos. Estos ensayos incluyen ensayo SYVA's FRAT®, ensayo EMIT®, inmunoensayo de canalización enzimática e inmunoensayo de transferencia de energía de fluorescencia (FETI) ((Dade Behring, Deerfield, Illinois); inmunoensayos de inhibidores de enzimas (Hoffman LaRoche y Abbott Laboratories): inmunoensayo de polarización de fluorescencia (Dandlicker), entre otros. Todos estos procedimientos tienen un sensibilidad limitada y sólo algunos, incluido el FETI y la canalización enzimática, son adecuados para analitos multiepitópicos grandes. Por tanto, existe una necesidad de un procedimiento homogéneo sensible para la detección de analitos grandes y/o complejos presentes en muestras biológicas y clínicas.
SUMARIO DE LA INVENCIÓN
La presente invención proporciona un par de unión que tiene un primer miembro de unión que comprende una primera molécula de especificidad acoplada al extremo 5' de un primer ácido nucleico, y un segundo miembro de unión que comprende una segunda molécula de especificidad acoplada al extremo 3' de un segundo ácido nucleico, en los que los ácidos nucleicos primero y segundo forman un dúplex de estabilidad definida y limitada, en los que la primera molécula de especificidad es un primer anticuerpo y la segunda molécula de especificidad es un segundo anticuerpo.
Las moléculas de especificidad pueden ser idénticas o diferentes entre sí. En una forma de realización, las moléculas de especificidad de la presente invención interaccionan con dos receptores en una única célula. En otra forma de realización, tanto la primera como la segunda moléculas de especificidad son anticuerpos monoclonales que pueden interaccionar con diferentes epítopos sobre el mismo antígeno y, de este modo, comprenden un par de tipo sándwich.
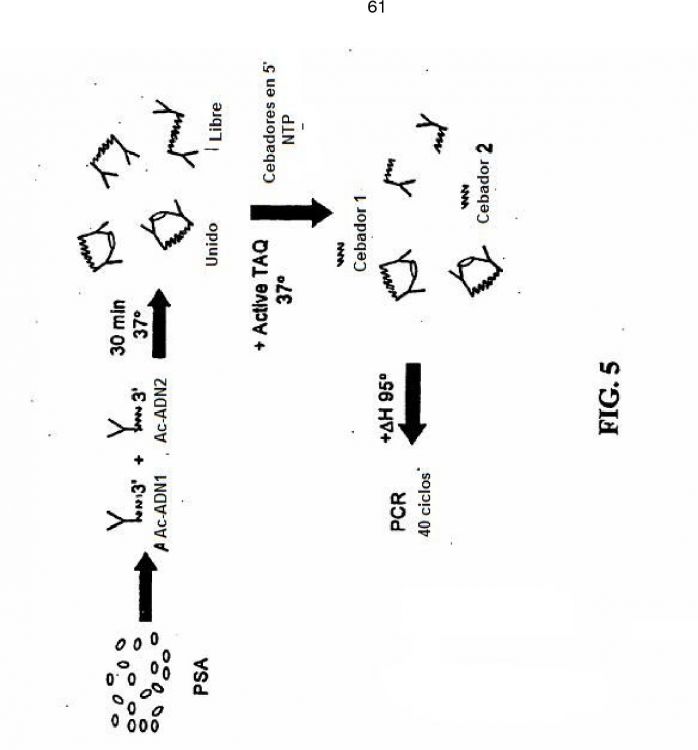
Normalmente, los ácidos nucleicos primero y segundo de los pares de unión son ácidos nucleicos monocatenarios que pueden ser ADN, ARN o APN, pero pueden ser ácidos nucleicos parcialmente bicatenarios o análogos de los mismos. En ciertas formas de realización de la invención, al menos uno de los ácidos nucleicos es una molécula de ADN/ARN quimérico. El dúplex entre los ácidos nucleicos puede formarse entre extremos terminales de los ácidos nucleicos o pueden comprender una secuencia de ácido nucleico interno. En una forma de realización preferida, el ácido nucleico es adecuado para amplificar mediante PCR, LCR, SDA o TMA.
La presente invención también proporciona procedimientos para detectar un analito usando miembros de unión. De acuerdo con una forma de realización, un par de unión, como se ha descrito en lo que antecede, se pone en contacto con un analito para formar un complejo. El ácido nucleico del par de unión se disocia y después se reasocia. Tras la extensión de los extremos 3' del dúplex reformado, que se encuentra predominantemente en los pares de unión unidos al analito, el dúplex reformado puede detectarse, normalmente mediante amplificación de un ácido nucleico que comprende el dúplex mediante PCR. Los restos de fondo se pueden reducir de forma significativa cuando los cebadores de PCR sólo se unen a los sitios generados mediante extensión de los extremos 3' del dúplex reformado pero no a los ácidos nucleicos de los propios miembros de unión.
Los productos de amplificación se pueden detectar mediante uno cualquiera de una variedad de procedimientos, incluidos tinción con bromuro de etidio, tinción de plata, autorradiografía, transferencia por manchas, transferencia por ranuras, transferencia de tipo southern e incorporación de una molécula fluorescente, una molécula inactivadora de fluorescencia, un compuesto quimioluminiscente, una molécula inactivadora de quimioluminiscencia, un compuesto bioluminiscente o un nucleótido fluorescente.
En una forma de realización de la invención, uno de los ácidos nucleicos del par de unión es una molécula de ADN/ARN quimérico y el otro es una molécula de ADN, en la que el dúplex formado entre los dos ácidos nucleicos tiene una corta región híbrida de ADN/ADN y una región híbrida más larga de ADN/ARN. El dúplex intacto de esta forma de realización es estable pero se puede desestabilizar mediante digestión con ARNasa, que además reduce los restos de fondo debido a los miembros de unión que no se unen al analito.
Las diversas formas de realización de la invención se pueden combinar para crear un ensayo homogéneo para la detección de proteínas, virus y células clínicamente relevantes que sea tanto específico como altamente sensible.
BREVE DESCRIPCIÓN DE LAS FIGURAS
La FIG. 1 ilustra el contenido, la conformación y el esquema de unión general de pares de unión. La FIG. 2 proporciona un esquema general de la formación de dúplex, extensión en 3' y amplificación por PCR de un par de ácido nucleico, que comprende la SEC ID Nº 1 yla SEC IDNº 2. La FIG. 3 proporciona un esquema general de la formación de dúplex, extensión en 3' y amplificación por PCR de un par de ácido nucleico, que comprende la SEC ID Nº 1 yla SEC IDNº...
Reivindicaciones:
1. Un par de unión que comprende:
un primer miembro de unión que comprende una primera molécula de especificidad acoplada al extremo 5' de un primer ácido nucleico; y un segundo miembro de unión que comprende una segunda molécula de especificidad acoplada al extremo 3' de un segundo ácido nucleico, en el que los ácidos nucleicos primero y segundo forman un dúplex de estabilidad definida y limitada, en el que la primera molécula de especificidad es un primer anticuerpo y la segunda molécula de especificidad es un segundo anticuerpo.
2. El par de unión de la reivindicación 1, en el que la primera y la segunda moléculas de especificidad interaccionan con diferentes moléculas.
3. El par de unión de la reivindicación 2, en el que las diferentes moléculas son dos receptores en una única célula.
4. El par de unión de cualquier reivindicación precedente, en el que los anticuerpos primero y segundo son anticuerpos monoclonales.
5. El par de unión de la reivindicación 4, en el que los anticuerpos primero y segundo interaccionan de forma independiente con epítopos sobre el mismo antígeno.
6. El par de unión de la reivindicación 4 o la reivindicación 5, en el que los anticuerpos primero y segundo comprenden un par de tipo sándwich.
7. El par de unión de cualquier reivindicación precedente, en el que los ácidos nucleicos primero y segundo son ácidos nucleicos monocatenarios.
8. El par de unión de cualquier reivindicación precedente, en el que el primer ácido nucleico comprende la SEC ID Nº 1 y el segundo ácido nucleico comprende la SEC ID Nº 2 o la SECIDNº 3.
9. El par de unión de cualquiera de las reivindicaciones 1 a 7, en el que los ácidos nucleicos primero y segundo se seleccionan, cada uno de forma independiente, de ADN, ARN y PNA.
10. El par de unión de cualquiera de las reivindicaciones 1 a 7, en el que al menos uno de los ácidos nucleicos primero y segundo es una molécula de ADN/ARN quimérica.
11. El par de unión de cualquier reivindicación precedente, en el que el dúplex está formado entre el extremo 3' terminal del primer ácido nucleico y la secuencia interna del segundo ácido nucleico.
12. El par de unión de cualquier reivindicación precedente, en el que el híbrido de ácido nucleico es adecuado para amplificación por PCR, LCR, SDA o TMA.
13. Un procedimiento para detectar un analito, que comprende: a) poner en contacto un par de unión que comprende:
un primer miembro de unión que comprende una primera molécula de especificidad acoplada a un primer ácido nucleico; y un segundo miembro de unión que comprende una segunda molécula de especificidad acoplada a un segundo ácido nucleico, en el que los ácidos nucleicos primero y segundo forman un dúplex de estabilidad definida y limitada con un analito para formar un complejo.
b) disociación del dúplex; c) dejar que los ácidos nucleicos primero y segundo se reasocien, de modo que se
genera un dúplex reformado; d) extensión de los extremos 3' del dúplex reformado; y e) detección del dúplex reformado; de modo que se detecta el analito.
14. El procedimiento de la reivindicación 13, en el que la etapa (b) comprende calentar el complejo hasta una temperatura en exceso de la temperatura de fusión del dúplex y, opcionalmente, además comprende diluir el complejo.
15. El procedimiento de la reivindicación 13 o la reivindicación 14, en el que el complejo está formado en una solución acuosa que comprende una sal y la etapa (b) comprende disminuir la concentración en sal de la solución acuosa.
16. El procedimiento de cualquiera de las reivindicaciones 13 a 15, en el que la etapa (e) comprende una amplificación de una molécula de ácido nucleico que comprende los dúplex reformados y detectar un producto de la amplificación en el que, opcionalmente, la amplificación se consigue mediante PCR, LCR, SDA, o TMA.
17. El procedimiento de la reivindicación 16, en el que la amplificación se consigue mediante PCR, usando cebadores que sólo se unen a sitios generados mediante extensión de los extremos 3' del dúplex reformado en la etapa (d).
18. El procedimiento de la reivindicación 16 o la reivindicación 17, en el que el producto de la amplificación se detecta mediante el procedimiento seleccionado a partir de: tinción con bromuro de etidio, tinción de plata, autorradiografía, transferencia por manchas, transferencia por ranuras, transferencia de tipo southern
19. El procedimiento de cualquiera de las reivindicaciones 13 a 18, en el que la detección del dúplex reformado se consigue mediante la incorporación de una molécula de detección en al menos uno de: el primer ácido nucleico monocatenario, el segundo ácido nucleico monocatenario, la región dúplex del par de unión y el producto de amplificación.
20. El procedimiento de acuerdo con la reivindicación 19, en el que la molécula de detección está seleccionada de: una molécula fluorescente, una molécula inactivadora de fluorescencia, un compuesto quimioluminiscente, una molécula inactivadora de quimioluminiscencia, una molécula bioluminiscente, una molécula radioactiva y un nucleótido fluorescente.
21. El procedimiento de cualquiera de las reivindicaciones 13 a 20, en el que al menos uno de los ácidos nucleicos primero y segundo es una molécula de ADN/ARN quimérico y el complejo de la etapa (a) se digiere con ARNasa antes de disociar el dúplex en la etapa (b).
22. Un procedimiento para la detección de PSA, dicho procedimiento comprende:
a) proporcionar un primer miembro de unión que comprende un anticuerpo monoclonal dirigido a un primer epítopo sobre el antígeno específico de la próstata acoplado a un primer ácido nucleico monocatenario y un segundo miembro de unión que comprende un anticuerpo monoclonal dirigido a un segundo epítopo sobre el antígeno específico acoplado a un segundo ácido nucleico monocatenario, en el que el primer ácido nucleico monocatenario hibrida con el segundo ácido nucleico monocatenario, de modo que se forma un par de unión unido a través de un dúplex de ácido nucleico;
b) poner en contacto el par de unión con una muestra, en el que la muestra comprende PSA en una solución de modo que se forma un complejo de par de unión-PSA.
c) calentar el complejo de par de unión-PSA para disociar los dúplex de ácido nucleico;
d) incubar el complejo de par de unión-PSA en condiciones que permitan la reasociación de los miembros de unión unidos a PSA, pero que no permitan la reasociación sustancial del exceso de miembros de unión libres en la solución; y
e) detección de los dúplex de par de unión, de modo que se detecta el PSA.
23. El procedimiento de la reivindicación 22, en el que los anticuerpos primero y segundo juntos forman un par de tipo sándwich de anticuerpos monoclonales frente a PSA.
24. El procedimiento de la reivindicación 22 o de la reivindicación 23, en el que la muestra está seleccionada de una muestra de sangre, una muestra de suero, una muestra de plasma o una muestra de tejido.
25. El procedimiento de cualquiera de las reivindicaciones 22 a 24, en el que el primer ácido nucleico monocatenario comprende la SEC ID Nº 1 y el segundo ácido nucleico monocatenario comprende la SEC ID Nº 2 ó 3.
26. El procedimiento de cualquiera de las reivindicaciones 22 a 25, en el que la etapa (c ) se realiza a 45ºC y la etapa (d) se realiza a temperatura ambiente.
27. El procedimiento de cualquiera de las reivindicaciones 22 a 26, en el que la etapa de detección comprende amplificar la región dúplex, en el que opcionalmente la amplificación comprende las etapas de:
a) extender los extremos 3' del dúplex con una ADN polimerasa, en el que la extensión genera al menos un sitio de unión al cebador; y
b) realizar la reacción en cadena de la polimerasa del dúplex extendido usando al menos un cebador complementario al al menos un sitio de unión al cebador de la etapa (a).
28. Un procedimiento para la detección de una célula, que comprende:
a) proporcionar una muestra que comprende al menos una célula;
b) proporcionar un primer miembro de unión que comprende un anticuerpo dirigido a un epítopo sobre la célula acoplado a un primer ácido nucleico monocatenario y un segundo miembro de unión que comprende un anticuerpo dirigido a un la célula acoplado a un segundo ácido nucleico monocatenario, en el que el primer ácido nucleico monocatenario hibrida con el segundo ácido nucleico monocatenario, de modo que se forma un par de unión unido a través de un dúplex de ácido nucleico;
c) poner en contacto el par de unión con una muestra, de modo que se forma
un complejo par de unión-célula d) disociar el dúplex de ácido nucleico; e) incubar el dúplex en condiciones que permitan la reasociación de los
miembros de unión unidos a la célula, pero que no permitan la reasociación
sustancial del exceso de miembros de unión libres, de modo que se genera un dúplex reformado. f) detectar un ácido nucleico que contiene el dúplex reformado, de modo que se detecta la célula.
29. El procedimiento de la reivindicación 28, en el que la célula está seleccionada de células bacterianas, animales, vegetales, de insectos y fúngicas, en el que, opcionalmente, la célula es una célula humana, y más opcionalmente, la célula humana está enferma.
30. El procedimiento de la reivindicación 28 o la reivindicación 29, en el que el primer ácido nucleico comprende la SEC ID Nº 1 y el segundo ácido nucleico comprende la SEC ID Nº 2 o 3.
31. El procedimiento de cualquiera de las reivindicaciones 28 a 30, en el que los anticuerpos primero y segundo son anticuerpos policlonales, en el que, opcionalmente, los anticuerpos primero y segundo son alícuotas del mismo anticuerpo policlonal.
32. El procedimiento de cualquiera de las reivindicaciones 28 a 31, en el que la etapa (d) comprende calentar la solución, en el que opcionalmente el calentamiento se realiza a aproximadamente 45ºC y, además opcionalmente, el calentamiento se realiza a la temperatura por encima de la temperatura de fusión del dúplex.
33. El procedimiento de cualquiera de las reivindicaciones 28 a 32, en el que la etapa (e) comprende diluir el complejo; e incubar el complejo diluido a temperatura ambiente, en el que opcionalmente el complejo está diluido al menos 10 veces y además opcionalmente, el complejo está diluido al menos 100 veces.
34. El procedimiento de cualquiera de las reivindicaciones 28 a 33, en el que la etapa (f) comprende amplificar un ácido nucleico que comprende el dúplex reformado, en el que la amplificación comprende opcionalmente las etapas de:
a) extender los extremos 3' del dúplex con una polimerasa, en el que la extensión genera al menos un sitio de unión al cebador; y
b) realizar la reacción en cadena de la polimerasa del dúplex extendido usando al menos un cebador complementario al sitio de unión al cebador generado e la etapa (a).
35. El procedimiento de la reivindicación 34 en el que al menos un cebador comprende la SEC ID Nº 4 ó 5.
36. EL procedimiento de cualquiera de las reivindicaciones 28 a 35, en el primer ácido nucleico está acoplado al primer anticuerpo a través de su extremo 3' y el segundo ácido nucleico está acoplado al segundo anticuerpo a través de su extremo 5', y en el que opcionalmente al menos uno de los ácidos nucleicos primero y segundo está unido a su correspondiente anticuerpo a través de un espaciador.
37. Un procedimiento para detectar un analito, en el que el procedimiento comprende las etapas de:
a) proporcionar una muestra que comprende un analito;
b) proporcionar un primer miembro de unión que comprende un anticuerpo que interacciona con el analito acoplado con un primer ácido nucleico monocatenario, en el que el primer ácido nucleico monocatenario comprende una secuencia de ADN 5' y una secuencia ARN 3', en el que el primer ácido nucleico monocatenario está acoplado con el miembro de unión a través de su extremo 5'.
c) proporcionar un segundo miembro de unión que comprende un anticuerpo que interacciona con el analito acoplado con un segundo ácido nucleico monocatenario, en el que el segundo ácido nucleico monocatenario comprende ADN acoplado con el miembro de unión a través de su extremo 3', en el que el segundo ácido nucleico monocatenario hibrida con el primer ácido nucleico monocatenario, de modo que se forma un par de unión que está unido a través de un dúplex de ácido nucleico compuesto por regiones de híbrido ADN-ADN e híbrido ADN-ARN.
d) poner en contacto el par de unión con una muestra, de modo que se forma
un complejo par de unión-analito
e) digestión del complejo con ARNasa;
f) disociar el dúplex de ácido nucleico;
g) Incubar la solución en condiciones que permitan la reasociación de los
miembros de unión unidos al analito, pero que no permitan la reasociación sustancial del exceso de miembros de unión libres, de modo que se genera un dúplex reformado.
h) extensión de los extremos 3' del dúplex reformado en el que la extensión genera al menos un sitio de unión al cebador para PCR
56 i) amplificar un ácido nucleico que comprende el dúplex reformado mediante PCR usando al menos un cebador que se une a al menos un sitio de unión al cebador para PCR generado en la etapa (h); y j) detectar el ácido nucleico amplificado de la etapa (i), por lo que se detecta 5 la célula.
Patentes similares o relacionadas:
Novedosos conjugados de anticuerpos adecuados para su uso en inmunoensayos aislados de desplazamiento de la inactivación de la fluorescencia, del 11 de Marzo de 2020, de Life Science Inkubator Sachsen GmbH & Co. KG: Un conjugado para inmunoensayos de inactivación de la fluorescencia que comprende un anticuerpo unido a un conector, caracterizado por que en su extremo […]
Partículas de transducción no replicativas y sistemas indicadores basados en partículas de transducción, del 22 de Enero de 2020, de Geneweave Biosciences Inc: Un sistema de empaquetamiento de célula bacteriana para empaquetar una molécula de ácido nucleico indicadora en una partícula de transducción no […]
Método para determinar perfiles cinéticos en el descubrimiento de fármacos, del 8 de Enero de 2020, de Enzymlogic, S.L: Método para calcular el perfil cinético de un compuesto de interés frente a una proteína o poliproteína diana, que comprende las siguientes etapas: […]
Procedimientos de medición de la actividad del factor D y la potencia de los inhibidores del factor D, del 11 de Diciembre de 2019, de F. HOFFMANN-LA ROCHE AG: Un procedimiento de medición de la actividad del factor D en una muestra, que comprende realizar un ensayo de medición basado en proximidad, en el que el […]
Biosensor basado en una partícula anclada, del 3 de Julio de 2019, de TECHNISCHE UNIVERSITEIT EINDHOVEN: Un método para detectar un analito mediante el movimiento de partículas ancladas, comprendiendo el método: poner una matriz que contiene el analito en contacto con […]
 Cribado de alto rendimiento para compuestos que modulan los niveles de macromoléculas celulares, del 26 de Junio de 2019, de THE SCRIPPS RESEARCH INSTITUTE: Un procedimiento de identificación y cuantificación de una molécula diana específica en una muestra que comprende:
probar y seleccionar un primer […]
Cribado de alto rendimiento para compuestos que modulan los niveles de macromoléculas celulares, del 26 de Junio de 2019, de THE SCRIPPS RESEARCH INSTITUTE: Un procedimiento de identificación y cuantificación de una molécula diana específica en una muestra que comprende:
probar y seleccionar un primer […]
 Método para la detección temprana de enfermedad y lesión renal, del 26 de Junio de 2019, de The Children's Hospital Medical Center: Un método para la detección de aparición temprana de lesión de células tubulares renales (LCTR) que comprende detectar en muestras de suero sanguíneo tomadas de un paciente […]
Método para la detección temprana de enfermedad y lesión renal, del 26 de Junio de 2019, de The Children's Hospital Medical Center: Un método para la detección de aparición temprana de lesión de células tubulares renales (LCTR) que comprende detectar en muestras de suero sanguíneo tomadas de un paciente […]
Inmunoensayo de canalización de oxígeno luminiscente utilizando tres anticuerpos y métodos de producción y uso de los mismos, del 21 de Mayo de 2019, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un kit que contiene un sistema de detección quimioluminiscente para un analito específico, comprendiendo el kit: (a) una primera composición que […]