SINTESIS DE EPOTILONAS, SUS INTERMEDIOS, ANALOGOS Y USOS.
Un procedimiento para preparar un compuesto de fórmula:
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06026750.
Solicitante: SLOAN-KETTERING INSTITUTE FOR CANCER RESEARCH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1275 YORK AVENUE,NEW YORK, NEW YORK 10021.
Inventor/es: DANISHEFSKY, SAMUEL J., RIVKIN,ALEXEY, YOSHIMURA,FUMIHIKO, GABARDA ORTEGA,ANA ESTHER, CHO,YOUNG,SHIN, CHOU,TING-CHAO, DONG,HUAJIN.
Fecha de Publicación: .
Fecha Solicitud PCT: 22 de Agosto de 2003.
Fecha Concesión Europea: 2 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D417/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 417/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y azufre como únicos heteroátomos del ciclo, no previstos por el C07D 415/00. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
- C07D493/04 C07D […] › C07D 493/00 Compuestos heterocíclicos que contienen átomos de oxígeno como únicos heteroátomos del ciclo en el sistema condensado. › Sistemas orto-condensados.
Clasificación PCT:
- A61K31/425 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Tiazoles.
- C07D277/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de tiazol-1,3 o tiazol-1,3 hidrogenado.
- C07D303/00 C07D […] › Compuestos que contienen ciclos de tres miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo.
- C07D313/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de más de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo.
- C07D413/06 C07D […] › C07D 413/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
- C07D417/06 C07D 417/00 […] › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
- C07D419/06 C07D […] › C07D 419/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno, oxígeno y azufre como únicos heteroátomos del ciclo. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
- C07D493/04 C07D 493/00 […] › Sistemas orto-condensados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Síntesis de epotilonas, sus intermedios, análogos y usos.
Antecedentes de la invención
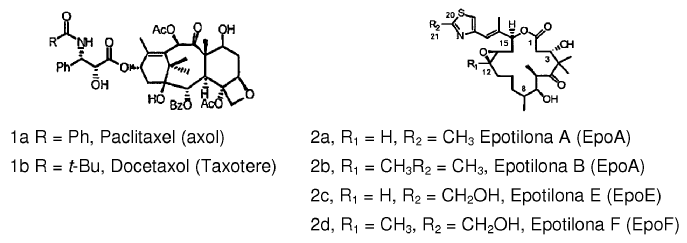
Las epotilonas A y B (2a y 2b, Esquema 1) son macrólidos citotóxicos de origen natural aisladas de una micobacteria degradante de celulosa, Sorangium cellulosum (Höfle y col. Angew. Chem., Int. Ed. Engl. 1996, 35, 1567 y J. Antibiot. 1996, 49, 560; cada uno de los cuales se incorpora en el presente por referencia). A pesar de sus estructuras enormemente diferentes, las epotilonas A y B comparten el mismo mecanismo de acción que el paclitaxel (Taxol®) que implica la inhibición del crecimiento de células tumorales por polimerización de la tubulina y estabilización de ensamblajes microtubulares (Bollag y col. Cancer Res. 1995, 55, 2325; incorporado como referencia). A pesar de su valor clínico incuestionable como un agente terapéutico de primera línea, el Taxol® está lejos de ser un fármaco ideal. Su hidrosolubilidad marginal requiere recurrir a la formulación de vehículos tales como Cremophores que plantean sus riesgos y asuntos de gestión propios (Essayan y col. J. Allergy Clin. Immunol. 1996, 97, 42; incorporado en el presente documento por referencia). Además, el Taxol® es vulnerable a la desactivación por resistencia múltiple a fármacos (MDR) (Giannakakou y col. J. Biol. Chem. 1997, 272, 17118; incorporado en el presente documento por referencia). Sin embargo, también se ha demostrado que las epotilonas A y B conservan potencia notable frente a células tumorales MDR (Kowalski y col. Mol. Biol. Cell 1995, 6, 2137; incorporado en el presente documento por referencia). Adicionalmente, la hidrosolubilidad aumentada en comparación con paclitaxel puede ser útil para poder formular las epotilonas. Aunque el compuesto de origen natural, epotilona B (2b, EpoB, en el Esquema 1), es un potente miembro de la familia de epotilona de productos naturales, posee desafortunadamente, al menos en ratones con xenotrasplanteinjerto, un índice terapéutico preocupantemente estrecho (Su y col. Angew. Chem. Int. Ed. Engl. 1997, 36,1093; Harris y col. J. Org. Chem. 1999, 64, 8434; cada uno de los cuales se incorpora en el presente documento por referencia).
Esquema 1
Taxoides y Epotilonas
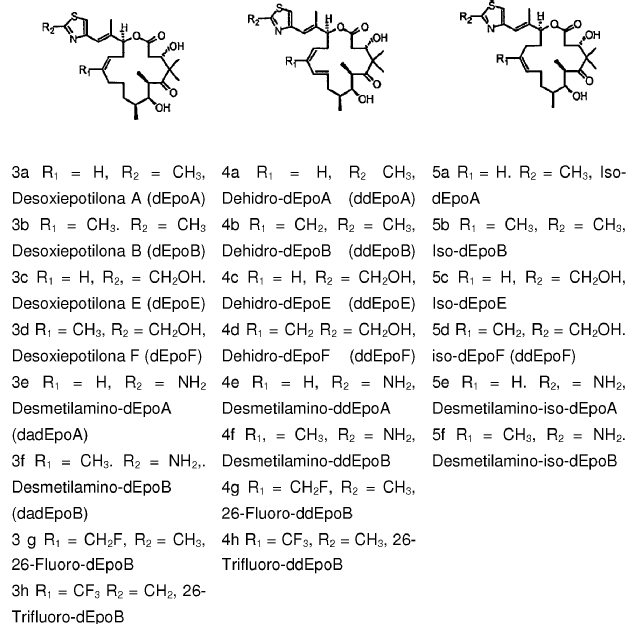
Dado el índice terapéutico limitado de EpoB, otros análogos de epotilona, en particular las 12,13 desoxiepotilonas, se investigaron para estudiar su capacidad para proporcionar un perfil terapéutico mejorado (véanse, las Patentes de Estados Unidos Nº 6.242.469, 6.284.781, 6.300.355, 6.369.234, 6.204.388, 6.316.630; cada uno de las cuales se incorpora en el presente documento por referencia). Experimentos realizados in vivo en diversos modelos de ratón demostraron que la 12,13-desoxiepotilona B (3b, dEpoB en el Esquema 2) posee potencial terapéutico frente a diversos tumores humanos sensibles y resistentes en xenotrasplantes de ratones (Chou y col. Proc. Natl. Acad. Sci. U.S.A. 1998, 95, 9642 y 15798; incorporado en el presente documento por referencia). Recientemente, la superioridad terapéutica de estas desoxiepotilonas sobre otros agentes anticancerosos se ha demostrado de manera concluyente mediante estudios comparativos (Chou y col. Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 8113; incorporado en el presente documento por referencia). Debido a su impresionante perfil in vivo, la dEpoB se ha desarrollado a través de evaluaciones toxicológicas en perros y se encuentra actualmente en ensayos humanos como un fármaco anticanceroso.
Esquema 2
Diversos Análogos de Desoxiepotilona
A la luz de la prometedora utilidad terapéutica de las 12,13 desoxiepotilonas, sería deseable investigar análogos adicionales así como metodologías sintéticas adicionales para la síntesis de epotilonas y desoxiepotilonas existentes y análogos de las mismas así como análogos nuevos de las mismas. En particular, dado el interés en la utilidad terapéutica de este tipo de compuestos, también sería deseable desarrollar metodologías capaces de proporcionar cantidades significativas de cualquiera de las epotilonas o desoxiepotilonas previamente descritas, o las descritas en el presente documento, para ensayos clínicos y para la preparación a gran escala.
Descripción de los dibujos
La Figura 1 es una tabla de valores de CI50 de epotilonas frente al crecimiento celular de CCRF-CEM, CCRF-CEM/VBL y CCRF-CEM/Taxol. La inhibición del crecimiento celular se midió por ensayo XTT tetrazonio después de 72 horas de incubación para el crecimiento celular como se ha descrito anteriormente (Scudiero y col. Cancer Res. 46: 4827-4833, 1988; incorporado en el presente documento por referencia). Los valores de CI50 se determinaron de la relación efecto-dosis a seis o siete concentraciones de cada fármaco, usando un programa de ordenador (Chou y col. Adv. Enzyme Regul. 22: 27-55, 1984; Chou y col. CalcuSyn for Windows (Biosoft, Cambridge, UK), 1997; cada uno de los cuales se incorpora en el presente documento por referencia) como se ha descrito anteriormente (Chou y col. Proc. Natl. Acad. Sci. USA 95: 15798-15802, 1998; incorporado en el presente documento por referencia).
La Figura 2 es un espectro de RMN 1H de trans-9,10-dehidro-12,13-desoxiEpoB.
La Figura 3 es un espectro de RMN 13C de trans-9,10-dehidro-12,13-desoxiEpoB.
La Figura 4 muestra un esquema para la síntesis de epotilonas 11 -R y 14-R usando metátesis de olefinas con cierre de anillo - LACDAC, e ilustra determinadas sustituciones disponibles con estrategias sintéticas que pasan a través de una 9,10-dehidro epotilona.
La Figura 5 presenta datos de citotoxicidad relativa frente a células leucémicas humanas in vitro para una diversidad de compuestos y derivados de epotilona que incluyen determinados compuestos 9,10-dehidro (por ejemplo, el compuesto 7 en la Figura 5A y los compuestos 88 y 89 en la Figura 5B).
La Figura 6 representa estrategias sintéticas alternativas para preparar análogos de 9,10-dehidro epotilona. La Figura 6A ilustra una estrategia Macro-Stille, una estrategia de acoplamiento sp3-sp3 y una estrategia ß-Suzuki. La Figura 6B ilustra una estrategia de olefinación de Julia, una estrategia Wadsworth-Emmons y una estrategia Macro-Reformatosky. La Figura 6C ilustra una estrategia de acoplamiento McMurry y una síntesis de análogo de lactamo.
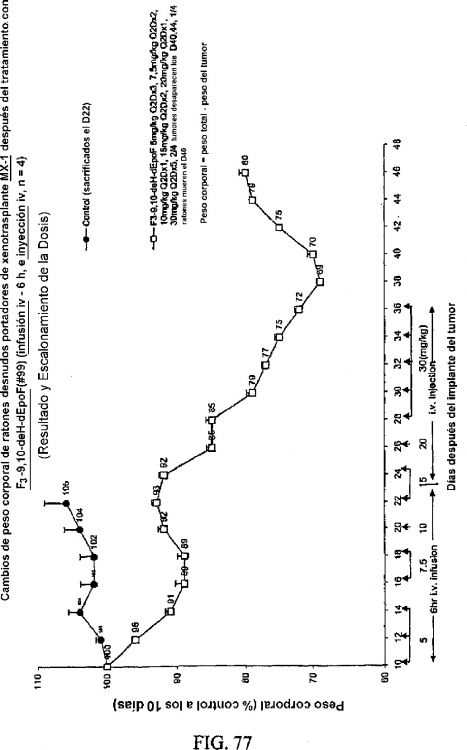
La Figura 7 muestra diversos análogos de 9,10-dehidro-12,13-desoxi EpoB.
La Figura 8 muestra el efecto terapéutico de 9,10-dehidro-dEpoB y dEpoB en ratones desnudos portadores de xenotrasplante MX-1 de carcinoma mamario humano (infusión iv, Q2Dx3).
La Figura 9 muestra la estabilidad de análogos de epotilona en plasma murino. Epo 1 es 12,13-desoxiEpoB, Epo 2 es 26-F3-12,13-desoxiEpoB, Epo 3 es (E)-9,10-dehidro-12,13-desoxiEpoB y Epo 4 es 26-F3-(E)-9,10-dehidro-12,13-desoxiEpoB.
La Figura 10 representa el efecto terapéutico de análogos de epotilona en ratones desnudos portadores de xenotrasplante HCT-116 (infusión iv, Q2Dx7, n=3). Las flechas indican la administración del fármaco. Epo 3 es (E)-9,10-dehidro-12,13-desoxiEpoB.
La Figura 11 muestra las potencias de diversos análogos de epotilona frente al crecimiento celular tumoral in vitro e índice terapéutico en comparación con paclitaxel y vinblastina.
La Figura 12 es una tabla que resume el efecto de dEpoB, Taxol y 26-triF-9,10-deH-dEpoB frente a xenotrasplante MX-1 en ratones desnudos.
La Figura 13 muestra el efecto terapéutico de 26-trifloro-9,10-dehidro-dEpoB y 9,10-dehidro-EpoB sobre el tamaño del tumor en ratones desnudos portadores de xenotrasplantes MX-1 (infusión iv de 6 horas, Q2Dx6 y Q2Dx9, respectivamente).
La Figura 14 muestra cambios de peso corporal de ratones desnudos portadores de xenotrasplante MX-1 de tumor de carcinoma mamario humano después del tratamiento con 26-trifluoro-9,10-dehidro-dEpoB y 9,10-dehidro-EpoB (infusión de 6 horas, Q2Dx6 y Q2Dx9, respectivamente).
La Figura 15 muestra el efecto terapéutico de 26-trifluoro-9,10-dehidro-dEpoB y 9,10-dehidroEpoB en tamaños de tumor en ratones desnudos portadores de xenotrasplantes MX1 (infusión iv de 6 horas, Q2Dx6 y Q2Dx9, respectivamente).
La...
Reivindicaciones:
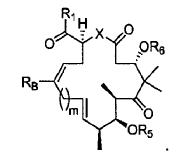
1. Un procedimiento para preparar un compuesto de fórmula:
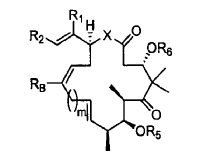
en la que
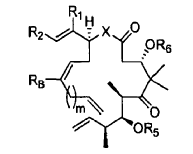
2. Un procedimiento para preparar un compuesto de fórmula:
en la que
3. El procedimiento de la reivindicación 1, en el que las condiciones de una reacción de metátesis con cierre de anillo incluyen un catalizador de Grubbs.
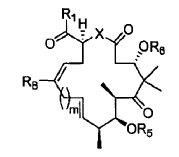
4. El procedimiento de la reivindicación 3, en el que el catalizador de Grubbs es cloruro de triciclohexilfosfina[1,3-bis(2,4,6-trimetilfenil)-4,5-dihidroimidazol-2-ilideno][bencilideno]rutenio (IV).
5. Un procedimiento para preparar un compuesto de fórmula.
en la que
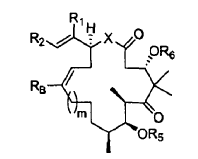
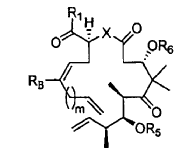
6. Un procedimiento para preparar un compuesto de fórmula:
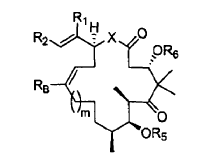
en la que
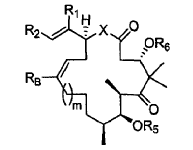
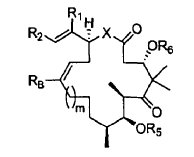
7. Un procedimiento para preparar un compuesto de fórmula:
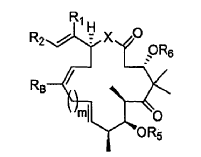
en la que
Patentes similares o relacionadas:
Moduladores heteroaromáticos del receptor NMDA y usos de los mismos, del 24 de Junio de 2020, de Cadent Therapeutics, Inc: Un compuesto representado por la Fórmula I **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en el que: los anillos A y B son un sistema heteroaromático […]
Compuestos de tienopirrol y usos de los mismos como inhibidores de luciferasas procedentes de Oplophorus, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un compuesto de fórmula (I), o una sal del mismo: **(Ver fórmula)** en la que: la línea discontinua representa la presencia o ausencia de un enlace; X es […]
Nuevos compuestos antibacterianos, del 1 de Abril de 2020, de AZIENDE CHIMICHE RIUNITE ANGELINI FRANCESCO A.C.R.A.F. S.P.A.: Compuesto de fórmula: : A-L1-Y-L2-R-B en el que: A es un grupo cíclico que presenta la fórmula (II) siguiente: **(Ver fórmula)** […]
Ester de ibuprofeno de filigenina, su procedimiento de preparación y aplicaciones del mismo, del 3 de Enero de 2020, de Fu, Li: Un compuesto de éster de ibuprofeno de filigenina con fórmula estructural general representada por la fórmula (I):**Fórmula**
Compuestos de biarilamida como inhibidores de cinasas, del 25 de Diciembre de 2019, de NOVARTIS AG: Un compuesto de formula (I): **(Ver fórmula)** o una sal farmaceuticamente aceptable de este, donde: Z1 es O, S, S(=O) o SO2; […]
Tricíclicos sustituidos y métodos de uso, del 18 de Diciembre de 2019, de AbbVie Overseas S.à r.l: Un compuesto de fórmula (I) o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** en donde R1 es H o alquilo C1-C3; X es la fórmula (a) […]
Modulación de receptores quimiosensoriales y ligandos asociados con los mismos, del 26 de Noviembre de 2019, de SENOMYX INC.: Un compuesto que tiene la fórmula estructural (IIIb1)**Fórmula** o una sal, tautómero, solvato o éster del mismo, en donde A es acilo, acilo sustituido, heteroalquilo, […]
Derivados de pirazol tricíclicos condensados útiles para modular los receptores farnesoide x, del 20 de Noviembre de 2019, de Recordati AG: Un compuesto de acuerdo con la Fórmula (II), **(Ver fórmula)** o una sal farmacéutica aceptable de esta, donde R0 es alquilo C1-6; haloalquilo C1-6; […]