SINTESIS CATALITICA ASIMETRICA DE PIRROLIDINAS POLISUSTITUIDAS OPTICAMENTE ACTIVAS.
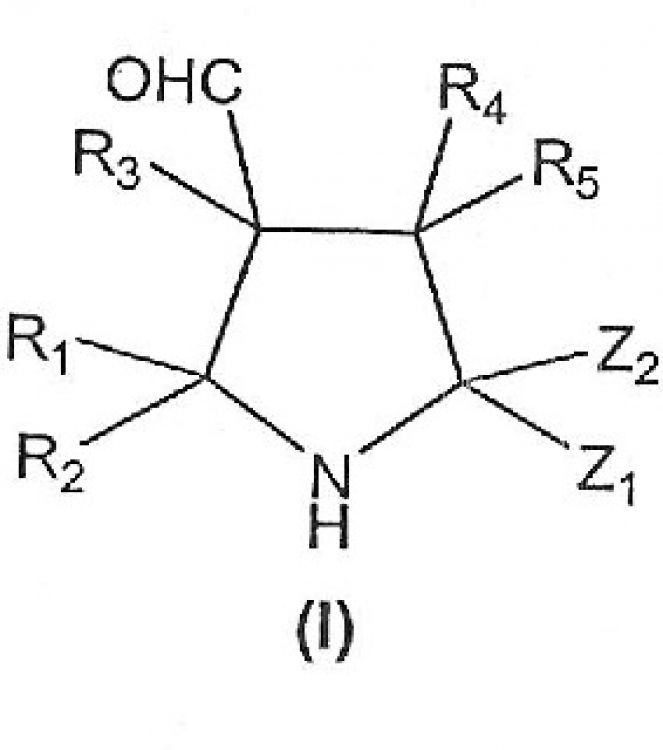
El procedimiento para la preparación de pirrolidinas (I), donde R{sub,
1}-R{sub,5} son independientemente hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, heterociclilo, arilo, aralquilo o éter de sililo, con la condición de que R{sub,1} a R{sub,5} se seleccionen de manera que el compuesto (I) sea quiral; y Z{sub,1} y Z{sub,2} son independientemente alcoxilo, ariloilo, heterocicloilo, ciano, nitro, COZR{sub,a} (donde Z es O, NH, S o Se y donde R{sub,a} es H o alquilo) o S(O){sub,n}R{sub,b} (donde n es 0, 1 ó 2 y R{sub,b} es H o alquilo), enantioméricamente enriquecidas de forma enantioselectiva comprende la cicloadición [3+2] de iluros de azometino derivados de N-alquiliminas y aldehídos {al},{be}-insaturados empleando como catalizadores moléculas orgánicas quirales que no contienen metales en su estructura
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200701196.
Solicitante: UNIVERSIDAD DEL PAIS VASCO.
Nacionalidad solicitante: España.
Provincia: VIZCAYA.
Inventor/es: VICARIO HERNANDO,JOSE LUIS, BADIA URRESTARAZU,MARIA DOLORES, CARRILLO FERNANDEZ,MARIA LUISA.
Fecha de Solicitud: 4 de Mayo de 2007.
Fecha de Publicación: .
Fecha de Concesión: 7 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07D207/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 207/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros no condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › Atomos de carbono teniendo tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo.
Clasificación PCT:
- C07D207/16 C07D 207/00 […] › Atomos de carbono teniendo tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo.
Fragmento de la descripción:
Síntesis catalítica asimétrica de pirrolidinas polisustituidas ópticamente activas.
Campo de la invención
La invención se refiere a un procedimiento para la preparación de pirrolidinas enantioméricamente enriquecidas de forma enantioselectiva mediante la cicloadición [3+2] de iluros de azometino derivados de N-alquiliminas y aldehídos a,ß-insaturados empleando como catalizadores moléculas orgánicas quirales que no contienen metales en su estructura.
Antecedentes de la invención
La reacción de cicloadición [3+2], también llamada cicloadición 1,3-dipolar es una de las herramientas sintéticas más poderosas para la formación de estructuras cíclicas de cinco miembros. Asimismo, si en dicha transformación se generan nuevos centros estereogénicos, la posibilidad de controlar la configuración en la que éstos se forman se convierte en uno de los requisitos más importantes a la hora de aplicar esta metodología a la síntesis de productos de interés. Esto es de particular relevancia en el caso de aquellos compuestos con actividad biológica, dada la conocida posibilidad de que dos estereoisómeros de un mismo compuesto bioactivo tengan propiedades diferentes, pudiendo ocurrir que mientras que uno de los isómeros posee la actividad deseada, el resto puedan ser inactivos o incluso tóxicos. En este contexto, los organismos oficiales encargados de regular la comercialización de nuevos productos en el sector farmacéutico, fitosanitario o agroalimentario, entre otros, establecen en estos casos la necesidad de comercializar el producto en cuestión de forma estereoisoméricamente pura, imponiéndose severos controles de calidad para asegurar el necesario grado de pureza. En este sentido, se han descrito diversas metodologías para llevar a cabo cicloadiciones [3+2] de manera estereocontrolada, siendo aquellas estrategias que permiten llevar a cabo la transformación empleando catalizadores quirales especialmente ventajosas sobre el resto, dada la mayor simplicidad operacional del proceso, así como las ventajas económicas en cuanto al empleo del inductor de quiralidad en cantidad subestequiométrica.
Entre las cicloadiciones [3+2] desarrolladas hasta el momento, cabe destacar aquellas en las que se emplean iluros de azometino como dipolos, ya que conducen a la formación del núcleo de pirrolidina, una unidad estructural ubicua en la naturaleza y por lo tanto presente en un elevado número de productos naturales y derivados sintéticos que muestran un extenso abanico de actividades biológicas de distintos tipos.
Las pirrolidinas quirales enantioméricamente puras forman una familia de compuestos cuya estructura se encuentra en un gran número de productos naturales y sintéticos con aplicaciones farmacológicas potenciales (más de 150000 estructuras conteniendo la unidad de pirrolidina en 2006 según datos del Chemical Abstracts Service). Como ejemplo, algunos miembros de esta familia muestran actividad antidepresiva, antihipertensiva, antiartrítica, antibacteriana, antitrombótica o analgésica entre otras, como describen WO 89/06534, JP-1996092207; WO 95/08534, US Pat. No. 5,665,754; Bioorg. Med. Chem. Lett. 1998, 8, 2833; U.S. Pat. No. 5,668,147, J. Pharm. Pharmacol. 1996, 48, 380, y U.S. Pat. No. 5,514,701. Además, recientes avances han identificado compuestos pirrolidínicos o derivados como candidatos potenciales como fármacos en la lucha contra el SIDA y frente a bacterias resistentes como mencionan, por ejemplo Bioorg. Med. Chem. Lett. 2001, 11, 2741; U.S. Pat. No. 6,166,037; WO 00/01714 y U.S. Pat. No. 6,399,629.
Los precedentes bibliográficos descritos en el estado de la técnica para esta reacción han sido revisados recientemente: (a) Pandey, G.; Banerjee, P.; Gadre, S. R. Chem. Rev. 2006, 106, 4484; (b) Nájera, C.; Sansano, J. M. Angew. Chem., Int. Ed. 2005, 44, 6272 y (c) Husinec, S.; Savic, V. Tetrahedron: Asymmetry 2005, 16, 2047. Sin embargo, es de destacar que en todos los casos descritos en los que la reacción se lleva a cabo bajo catálisis asimétrica, la especie catalítica es un complejo metálico que, además en muchos casos sólo es válido para la reacción en particular para la que fue diseñado.
De manera alternativa, en la última década se ha venido desarrollando una nueva metodología que supone el empleo de especies puramente orgánicas como catalizadores quirales de reacciones químicas que hasta el momento sólo se habían llevado a cabo de forma estereocontrolada mediante el empleo de complejos metálicos como catalizadores. Esta alternativa metodológica, bautizada con el término de organocatálisis, presenta ventajas evidentes con respecto al resto, derivadas fundamentalmente de la ausencia en el medio de reacción de reactivos metálicos contaminantes, así como de la mayor estabilidad térmica y química del catalizador, permitiendo conducir las reacciones en ausencia de condiciones anhidras o incluso en medios acuosos. Varios ejemplos en los que se emplea esta metodología incluyen: (a) Seayad, J.; List, B. Org. Biomol. Chem. 2005, 3, 719; (b) Dalko, P. I.; Moisan, L. Angew. Chem., Int. Ed. 2004, 43, 5138; (c) Volumen especial sobre organocatálisis Acc. Chem. Res. 2004, 37, 487; (d) Berkessel, A.; Groger, H. en Asymmetric Organocatalysis: From Biomimetic Concepts to Applications in Asymmetric Synthesis; Wiley-VCH: Weinheim, Germany, 2005.
Esta nueva aproximación metodológica se ha ensayado con éxito en ciertas cicloadiciones, observando que sales de amonio derivadas de moléculas orgánicas como la prolina X, imidazolidinonas Y u otras aminas secundarias de estructura general Z permiten llevar a cabo alguna de estas reacciones:

En concreto, en lo que se refiere a reacciones de cicloadición llevadas a cabo en condiciones de organocatálisis asimétrica, sólo se ha descrito únicamente las reacciones de Diels-Alder: (Ahrendt, K. A.; Borths, C. J.; MacMillan, D. W. C. J. Am. Chem. Soc. 2000, 122, 4243; Northrup, A. B.; MacMillan, D. W. C. J. Am. Chem. Soc. 2002, 124, 2458; Wilson, R. M.; Jen, W. S.; MacMillan, D. W. C. J. Am. Chem. Soc. 2005, 127, 11616; Ishihara, K., Nakano, K. J. Am. Chem. Soc. 2005, 127, 10504; Lemay, M.; Ogilvie, W. W. Org. Lett. 2005, 7, 4141; Selkálá, S. A.; Tois, J.; Pihko, P. M.; Koskinen, A. M. P. Adv. Synth. Cata. 2002, 344, 941; Jurcik, V.; Wilhelm, R. Org. Biomol. Chem. 2005, 3, 239; Macmillan, D. W. C.; PCT Int. Appl. WO 2003002491, 2003; MacMillan, D. W. C.; PCT Int. Appl. WO 2003047740); de cicloadición [3+2], empleando nitronas como 1,3-dipolos (Jen, W. S.; Wiener, J. J. M.; MacMillan, D. W. C. J. Am. Chem. Soc. 2000, 122, 9874; Karlsson, S.; Hogberg, H.-E. Eur. J. Org. Chem. 2003, 2782; Karlsson, S.; Hogberg, H.-E. Tetrahedron: Asymmetry 2002, 13, 923; MacMillan, D. W. C.; PCT Int. Appl. WO 2003002491, 2003) y la cicloadición [3+2] empleando sales de hidrazonio como 1,3-dipolos (Chen, W.; Yuan, X.-H.; Li, R.; Du, W.; Wu, Y.; Ding, L.-S.; Chen, Y.-C. Adv. Synth. Catal. 2006, 348, 1818).
En todos estos casos, el fundamento subyacente de la acción del catalizador es su interacción con un compuesto carbonílico a,ß-insaturado para formar de forma reversible una sal de iminio, en la que la energía del LUMO (orbital desocupado de mínima energía) se ve sustancialmente reducida con respecto al precursor carbonílico y por tanto queda activado para sufrir la reacción de cicloadición, por interacción con el HOMO (orbital ocupado de máxima energía) del dieno (en el caso de la reacción de Diels-Alder) o del 1,3-dipolo (en las cicloadiciones [3+2]). Así, la información quiral presente en el catalizador controla la aproximación del reactivo por una de sus caras, resultando en la formación preferente de un enantiómero u otro. Un ejemplo de la cicloadición [3+2] entre propenal y una nitrona catalizada por una imidazolidinona de tipo Y (descrita anteriormente) es:
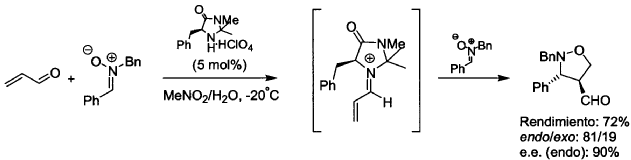
Así, mientras que ya se han descrito eficaces metodologías para llevar a cabo ciertas cicloadiciones [3+2] de forma organocatalítica y asimétrica, en ninguno...
Reivindicaciones:
1. Un procedimiento para la síntesis de pirrolidinas ópticamente activas de fórmula general (I):
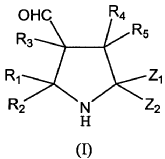
donde:
que comprende:
a) hacer reaccionar un compuesto de fórmula (II):
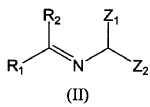
donde
con un aldehído a,ß-insaturado de fórmula (III):
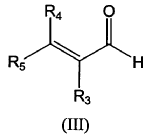
cuando en el compuesto de fórmula (I) a obtener, R3 no está unido a uno de R1 y R2 formando un ciclo, y cuando uno de Z1 y Z2 no está unido a uno de R4 o R5 formando un ciclo; o
b) hacer reaccionar un compuesto de fórmula (IV) de forma intramolecular:
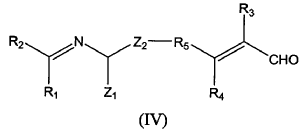
donde
cuando en el compuesto de fórmula (I) a obtener, Z2 está unido R5 formando un ciclo; o
c) hacer reaccionar un compuesto de fórmula (V) de forma intramolecular:
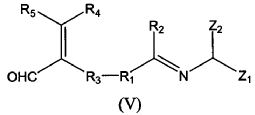
donde
cuando en el compuesto de fórmula (I) a obtener, R1 está unido R3 formando un ciclo;
en presencia de una cantidad subestequiométrica de un catalizador de fórmula (VI):
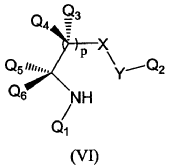
donde:
2. Procedimiento según reivindicación 1 para la síntesis de pirrolidinas ópticamente activas de fórmula general (I):
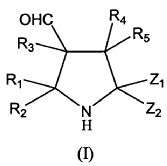
donde:
que comprende:
hacer reaccionar un compuesto de fórmula (II):
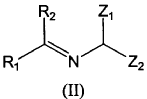
donde
con un aldehído a,ß-insaturado de fórmula (III):
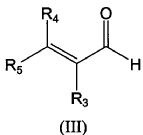
en presencia de una cantidad subestequiométrica de un catalizador de fórmula (VI) como se define en la reivindicación 1.
3. Procedimiento según reivindicación 1 en el que el catalizador es un compuesto de fórmula (VIa):
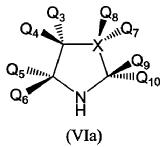
donde:
4. Procedimiento según reivindicación 3, donde X es CH2 o N(Q7), donde Q7 es hidrógeno o un grupo alquilo.
5. Procedimiento según reivindicaciones 3 o 4, donde Q3 y Q4 son hidrógeno, o uno de Q3 o Q4 es hidroxilo o un grupo protector del mismo, o Q3 y Q4 juntos representan un grupo carbonilo, o uno de Q3 o Q4 está unido a Q5 o Q6 formando una estructura cíclica.
6. Procedimiento según cualquiera de las reivindicaciones 3 a 5, donde Q5 y Q6 son hidrógeno, o uno de Q5 o Q6 está unido a Q3 o Q4 formando una estructura cíclica.
7. Procedimiento según cualquiera de las reivindicaciones 3 a 6, donde Q9 o Q10 es alquilo, arilo, alquenilo, alquinilo, cicloalquilo, heterociclilo, hidroxilo, alcoxilo, amino, éter de sililo, COORc (donde Rc es H, alquilo o amino) ariloilo, heterocicloilo, ciano, sulfonilo, sulfinilo o tiocarbonilo.
8. Procedimiento según reivindicación 7 en el que uno de Q9 o Q10 es hidrógeno y el otro es un grupo COORc (donde Rc es H, alquilo o amino) o un grupo alquilo C(R6)(R7)(R8), donde R6, R7 y R8 se seleccionan independientemente entre H, alquilo, arilo e hidroxilo.
9. Procedimiento según cualquiera de las reivindicaciones 1 a 8 en el que el catalizador de fórmula (VI) se selecciona entre los siguientes compuestos:
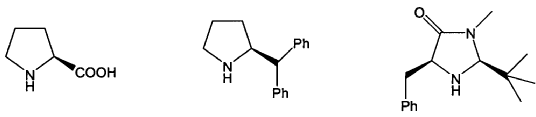
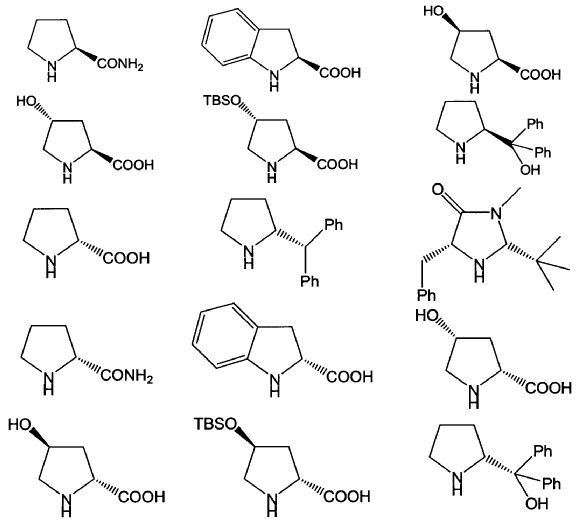
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9 en el que el compuesto de fórmula (I) es un compuesto de fórmula (Ia) o (Ib):
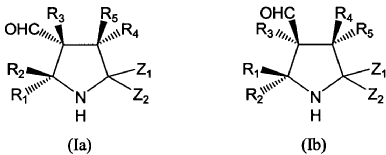
donde R1, R2, R3, R4, R5, Z1 y Z2 se definen como en la reivindicación 1.
11. Procedimiento según cualquiera de las reivindicaciones 1 a 10 en el que R1 es un grupo arilo, heterociclilo o alquenilo.
12. Procedimiento según cualquiera de las reivindicaciones 1 a 11 en el que R2 es hidrógeno.
13. Procedimiento según cualquiera de las reivindicaciones 1 a 12 en el que R3 es hidrógeno.
14. Procedimiento según cualquiera de las reivindicaciones 1 a 13 en el que R4 es hidrógeno.
15. Procedimiento según cualquiera de las reivindicaciones 1 a 14 en el que R5 es hidrógeno, un grupo alquilo, arilo o heterociclilo.
16. Procedimiento según reivindicación 15 en el que R5 es hidrógeno, alquilo o fenilo.
17. Procedimiento según cualquiera de las reivindicaciones 1 a 16 en el que Z1 y Z2 son ambos grupos alcoxicarbonilo, preferentemente son dietilcarboxilato.
18. Procedimiento según cualquiera de las reivindicaciones 1 a 17 en el que el compuesto de fórmula (I) se selecciona entre:
(3R,4R,5S)-5-fenil-4-formil-3-metilpirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-3-etil-5-fenil-4-formil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-fenil-4-formil-3-iso-propilpirrolidina-2,2-dicarboxilato de dietilo;
(3S,4R,5S)-3,5-difenil-4-formilpirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-4-formil-3-metil-5-(p-metoxifenil)-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-4-formil-5-(2-furil)-3-metil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-fenil-4-formil-3-propil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-3-butil-5-fenil-4-formil-pirrolidina-2,2-dicarboxilato de dietilo;
(3S,4R,5S)-5-fenil-4-formil-3-(p-nitrofenil)-pirrolidina-2,2-dicarboxilato de dietilo;
(3S,4R,5S)-5-fenil-4-formil-3-(p-metoxifenil)-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-fenil-4-formil-3-furil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-4-formil-3-metil-5-(3,4-metilendioxifenil)pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-(3,5-dimetoxifenil)-4-formil-3-metil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-(2-metoxifenil)-4-formil-3-metil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-(p-fluorofenil)-4-formil-3-metil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-5-(o-fluorofenil)-4-formil-3-metil-pirrolidina-2,2-dicarboxilato de dietilo;
(3R,4R,5S)-4-formil-3-metil-5-(o-tolil)-pirrolidina-2,2-dicarboxilato de dietilo; y
(3R,4R,5R,1'E)-4-formil-3-metil-5-(1-propenil)-pirrolidina-2,2-dicarboxilato de dietilo.
19. Procedimiento según cualquiera de las reivindicaciones 1 a 18 donde la reacción se lleva a cabo en un disolvente orgánico seleccionado entre dioxano, acetato de etilo, tetrahidrofurano, éter etílico, dimetilsulfóxido, dimetilformamida, cloroformo, diclorometano, nitrometano, acetonitrilo y una combinación de los mismos.
20. Procedimiento según reivindicación 19 donde el disolvente orgánico es tetrahidrofurano o dimetilformamida.
21. Procedimiento según cualquiera de las reivindicaciones 1 a 20 donde la temperatura de la reacción oscila entre -35ºC y 25ºC, preferentemente entre -30ºC y 5ºC.
22. Procedimiento según cualquiera de las reivindicaciones 1 a 21 que comprende además la adición a la reacción de entre 3 y 10 equivalentes de agua con respecto al aldehído a,ß-insaturado.
Patentes similares o relacionadas:
Compuestos heterocíclicos y métodos para su uso, del 8 de Abril de 2020, de NOVARTIS AG: Un compuesto de formula (I): **(Ver fórmula)** donde: X esta ausente e Y es -CHR3CH2-, -CH2CHR3-, -CHR3CHR4CH2-, -CH2CHR3CHR4-, -CH2CH2CHR3-, -CR3=CHCH2-, […]
Derivados de pirrolidina novedosos, del 1 de Enero de 2020, de F. HOFFMANN-LA ROCHE AG: Un compuesto de fórmula (1-ciano-ciclopropil)-amida del ácido (2S,4R)-4-[4-(5-metil-tetrazol-2-il)-2-trifluorometil-bencenosulfonil]-1-(1-trifluorometil-ciclopropanocarbonil)-pirrolidin-2-carboxílico […]
Lípidos y composiciones lipídicas para la administración de agentes activos, del 25 de Diciembre de 2019, de NOVARTIS AG: Un compuesto de fórmula (II) o una sal farmacéuticamente aceptable del mismo, en la que: **(Ver fórmula)** R1 se selecciona del grupo que consiste en: **(Ver […]
Inhibidores de benzimidazol del canal de sodio, del 18 de Diciembre de 2019, de Zalicus Pharmaceuticals Ltd: Un compuesto seleccionado del grupo que consiste en **(Ver fórmula)** o una sal o solvato farmacéuticamente aceptable del mismo.
Compuestos antivirales, del 4 de Septiembre de 2019, de Gilead Pharmasset LLC: Un compuesto de fórmula:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
N-Fenil-1-sulfonil-2-pirrolidinacarboxamidas para la identificación de actividad biológica y farmacológica, del 16 de Agosto de 2019, de INSTITUT UNIV. DE CIENCIA I TECNOLOGÍA, S.A: Un compuesto de fórmula (I) **(Ver fórmula)** y las sales y estereoisómeros del mismo, donde R1 es hidrógeno, halo, hidroxilo, nitro, ciano, […]
Agentes moduladores de S1p y/o ATX, del 31 de Julio de 2019, de Biogen MA Inc: Un compuesto representado por la fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo, donde X es O, S, S(O), -CH2-, o S(O)2; X1, X2, y X5 son […]
1-((3S,4R)-4-(3-fluorofenil)-1-(2-metoxietil)pirrolidín-3-il)-3-(4-metil-3-(2-metilpirimidín-5-il)-1-fenil-1H-pirazol-5- il)urea como un inhibidor de TrkA cinasa, del 10 de Julio de 2019, de ARRAY BIOPHARMA, INC.: Compuesto**Fórmula** 1-((3S,4R)-4-(3-fluorofenil)-1-(2-metoxietil)pirrolidín-3-il)-3-(4-metil-3-(2-metilpirimidín-5-il)-1-fenil-1H-pirazol-5- il)urea,…