PROCEDIMIENTO DE PREPARACION DE SALES DE 4-((5-((CICLOPROPILAMINO)CARBNIL)-2-METILFENIL)AMINO)-5-METIL-N-PROPILPIRROLO(2,1-F)(1,2,4)TRIAZINA-6-CARBOXAMIDA Y NUEVAS FORMAS ESTABLES PRODUCIDAS EN DICHO PROCEDIMIENTO.
Forma cristalina de
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/014504.
Solicitante: BRISTOL-MYERS SQUIBB COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ROUTE 206 AND PROVINCE LINE ROAD,PRINCETON, NJ 08543-4000.
Inventor/es: SHI, ZHONGPING, KIM,SOONJIN, MALLEY,MARY F.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D487/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
Clasificación PCT:
- A61K31/53 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con tres nitrógenos como únicos heteroátomos de un ciclo, p. ej. clorazanil, melamina, (melarsoprol A61K 31/555).
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- C07D487/04 C07D 487/00 […] › Sistemas condensados en orto.
Fragmento de la descripción:
Procedimiento de preparación de sales de 4-[[5-[(ciclopropilamino)carbonil]-2-metilfenil]amino]-5-metil-N-propilpirrolo[2,1-f][1,2,4]triazina-6-carboxamida y nuevas formas estables producidas en dicho procedimiento.
Referencia a otras solicitudes
La presente solicitud reivindica prioridad sobre la solicitud provisional U.S. No. 60/672.255 presentada el 18 de Abril, 2005, cuya divulgación se incorpora a la presente memoria por referencia.
Campo de la invención
La presente invención se refiere a un procedimiento para la preparación de nuevas formas de sales cristalinas estables, incluyendo las formas cristalinas Forma N-1 y Forma N-4 de la sal de monoclorhidrato de la base libre, y la forma cristalina Forma N-1 de la sal de ácido metanosulfónico de la base libre, del inhibidor de quinasa p38 4-[[5-[(ciclopropilamino)carbonil]-2-metilfenil]amino]-5-metil-N-propilpirrolo[2,1-f][1,2,4]triazina-6-carboxamida, a dichas nuevas formas cristalinas Forma N-1 y Forma N-4, a composiciones farmacéuticas que contienen dichas nuevas formas cristalinas Forma N-1 y Forma N-4, y a procedimientos de tratamiento de un mamífero para inhibir la actividad de la quinasa p38, y al tratamiento de afecciones asociadas a la quinasa p38, tales como artritis reumatoide, empleando dichas nuevas formas cristalinas N-1 (sal de ácido metanosulfónico y sal de ácido clorhídrico) y N-4 (sal de ácido clorhídrico).
Antededentes de la invención
Un gran número de citoquinas participan en la respuesta inflamatoria, incluyendo IL-1, IL-6, IL-8 y TNF-a. La sobreproducción de citoquinas, tales como IL-1 y TNF-a, está implicada en una amplia variedad de enfermedades, incluyendo enfermedad inflamatoria intestinal, artritis reumatoide, psoriasis, esclerosis múltiple, shock endotóxico, osteoporosis, enfermedad de Alzheimer, y fallo cardíaco congestivo, entre otras [Henry et al., Drugs Fut., 24:1345-1354 (1999); Salituro et al., Curr. Med. Chem., 6:807-823 (1999)]. La evidencia en pacientes humanos indica que las proteínas antagonistas de las citoquinas son efectivas en el tratamiento de enfermedades inflamatorias crónicas, tales como, por ejemplo, anticuerpo monoclonal a TNF-a (Enbrel) [Rankin et al., Br. J. Rheumatol., 34:334-342 (1995)], y proteína de fusión receptor-Tc TNF-a soluble (Etanercept) [Moreland et al., Ann. Intern. Med., 130: 478-486 (1999)].
La biosíntesis de TNF-a ocurre en muchos tipos de células en respuesta a un estímulo externo, tal como, por ejemplo, un mitógeno, un organismo infeccioso, o un trauma. Mediadores importantes de la producción de TNF-a son las quinasas de proteína activada por mitógeno (MAP), y particularmente, quinasa p38. Estas quinasas son activadas en respuesta a varios estímulos de tensión, incluyendo, pero no limitándose a, citoquinas proinflamatorias, endotoxina, luz ultravioleta y shock osmótico. La activación de p38 requiere fosforilación dual mediante quinasas quinasa MAP aguas arriba (MKK3 y MKK6) en treonina y tirosina dentro del motivo Thr-Gly-Tyr característico de las isozimas p38.
Hay cuatro isoformas conocidas de p38, es decir, p38-a, p38-ß, p38-? y p38d. Las isoformas a y ß son expresadas en células inflamatorias y son mediadores clave de la producción de TNF-a. La inhibición de las enzimas p38a y ß en las células resulta en niveles reducidos de expresión de TNF-a. También, administrando inhibidores de p38a y ß en modelos animales de enfermedad inflamatoria, se ha probado que dichos inhibidores son efectivos en el tratamiento de esas enfermedades. Por consiguiente, las enzimas p38 tienen un papel importante en los procesos inflamatorios mediados por IL-1 y TNF-a. Los compuestos de los que se ha informado que inhiben la quinasa p38 y citoquinas, tales como IL-1 y TNF-a, para su uso en el tratamiento de enfermedades inflamatorias, se divulgan en las patentes US Nos. 6.277.989 y 6.130.235 concedidas a Scios, Inc; patentes US Nos. 6.147.080 y 5.945.418 concedidas a Vertex Parmaceuticals Inc; las patentes US Nos. 6.251.914, 5.977.103 y 5.658.903 concedidas a Smith-Kline Beecham Corp; las patentes US Nos. 5.932.576 y 6.087.496 concedidas a G.D.Searle & Co; WO 00/56738 y WO 01/27089 concedidas a Astra Zeneca; WO 01/34605 concedida a Johnson & Johnson; WO 00/12497 (derivados de quinazolina como inhibidores de quinasa p38); WO 00/56738 (derivados de piridina y pirimidina para el mismo propósito); WO 00/12497 (expone la relación entre inhibidores de quinasa p38); y WO 00/12074 (compuestos de piperazina y piperidina útiles como inhibidores de p38).
La solicitud US No de serie 10/420.399, presentada el 22 de Abril, 2003 (en adelante, referenciada en esta memoria como solicitud 10/420.399) divulga compuestos que son inhibidores de quinasa p38, que pueden ser útiles para tratar afecciones asociadas con la quinasa p38, incluyendo artritis reumatoide, y cuyos compuestos tiene la fórmula (I)

sus enantiómeros, diastereómeros, sales y solvatos, en la que
Reivindicaciones:
1. Forma cristalina de

en la forma de una sal de la misma.
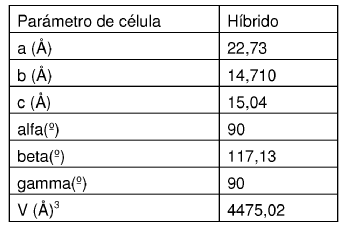
2. Forma N-1 de la sal de ácido clorhídrico cristalino de la base libre de la estructura

que está caracterizada por parámetros de célula unitaria sustancialmente iguales a los siguientes:
a = 22,50 (1) Å
b = 14,667 (8) Å
c = 14,96 (1) Å
a = 90º
ß = 116,78 (5)º
? = 90º
Grupo de espacio C2/c
Moléculas/unidad asimétrica 1
en la que dicha forma cristalina está a aproximadamente -50ºC.
Dimensiones de célula a partir de híbrido a temperatura ambiente
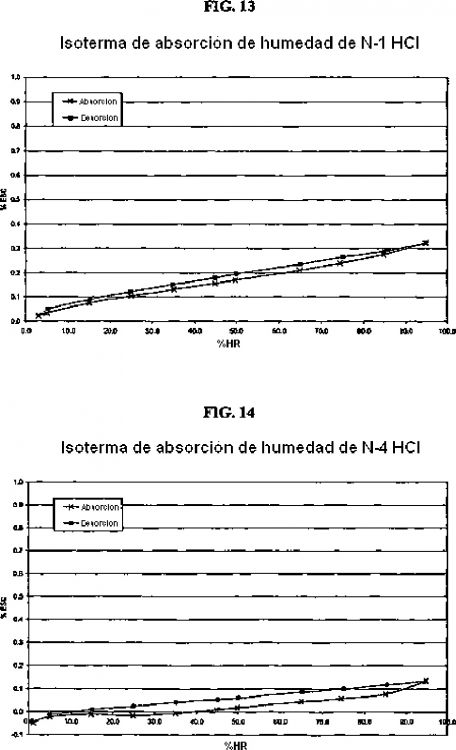
3. Forma cristalina según se ha definido en la reivindicación 2, según es caracterizada por un patrón de difracción de rayos X en polvo que comprende los valores 2? siguientes (CuKa ?= 1,5418 Å) 8,7
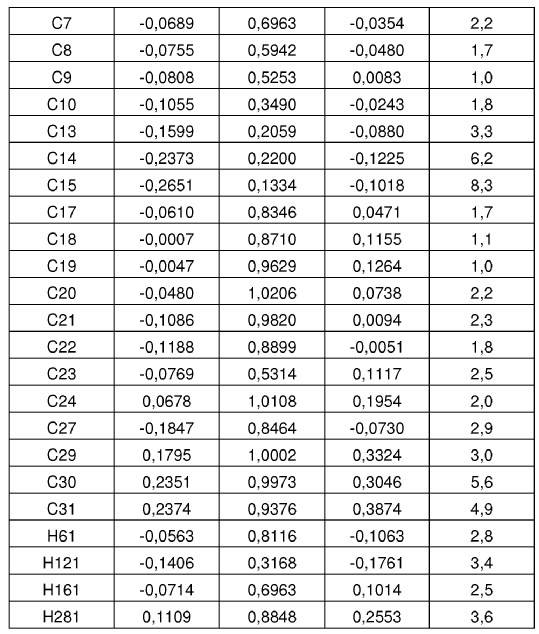
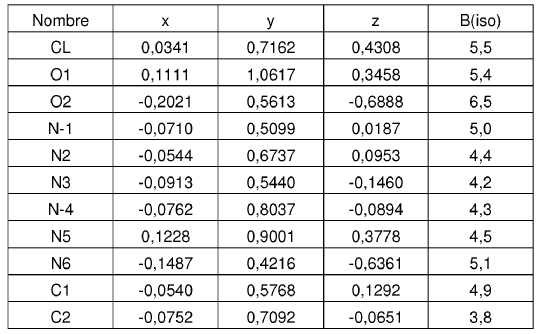
4. Forma cristalina según se ha definido en la reivindicación 2, caracterizada por coordenadas atómicas fraccionarias sustancialmente enumeradas en la tabla siguiente:
Parámetros posicionales y factores de temperatura isotrópica para la Forma N-1 de sal de HCl de la base libre I a -50ºC

5. Forma cristalina según se ha definido en la reivindicación 2, caracterizada por el patrón C-13 SSRMN de la Forma N-1 de la sal de HCl tal como se muestra en la Figura 4 y por los picos sustancialmente como se expone en la tabla siguiente:
Desplazamientos químicos Carbono-13 SSRMN

6. Forma cristalina según se ha definido en la reivindicación 2, caracterizada por un termograma de calorimetría diferencial de barrido sustancialmente según el mostrado en la Figura 7, que tiene una endoterma en el intervalo de aproximadamente 125 a aproximadamente 225ºC.
7. Forma cristalina según se ha definido en la reivindicación 2, caracterizada por una curva de análisis térmico gravimétrico según la mostrada en la Figura 10, que tiene una pérdida de peso despreciable hasta aproximadamente 100ºC, y una pérdida de peso de aproximadamente el 8,2% hasta aproximadamente 225ºC.
8. Forma N-1 de la sal de ácido metanosulfónico de la base libre de la estructura

que está caracterizada por parámetros de célula unitaria sustancialmente iguales a los siguientes:
Dimensiones de célula:
a = 9,818 (1) Å
b = 11,127 (1) Å
c = 13,004 (1) Å
a = 97,32 (1)º
ß = 110,17 (1)º
? = 111,48 (1)º
Grupo de espacio P-1
Moléculas/unidad asimétrica 1
en la que la forma cristalina está a aproximadamente +22ºC
9. Forma cristalina según se ha definido en la reivindicación 8, caracterizada por un patrón de difracción de rayos X en polvo que comprende los valores 2? siguientes (CuKa ?= 1,5418 Å) 10,7
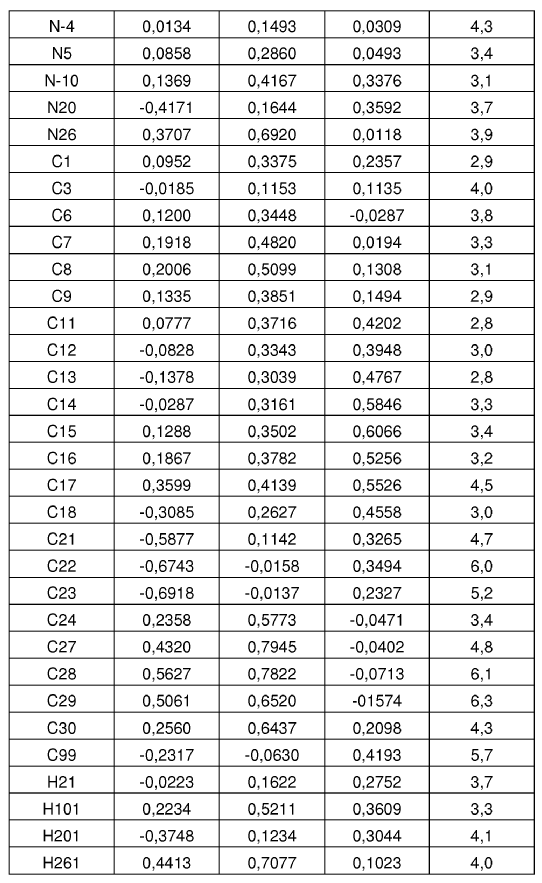
10. Forma cristalina según se ha definido en la reivindicación 8, caracterizada por coordenadas atómicas fraccionarias sustancialmente enumeradas en la tabla siguiente:
Parámetros posicionales y factores de temperatura isotrópica para la Forma N-1 de sal de MSA de la base libre I a temperatura ambiente

11. Forma cristalina según se ha definido en la reivindicación 8, caracterizada por un termograma de calorimetría diferencial de barrido sustancialmente según el mostrada en la Figura 9, que tiene una endoterma con establecimiento de pico a aproximadamente 216ºC.
12. Forma cristalina según se ha definido en la reivindicación 8, caracterizada por una curva de análisis térmico gravimétrico según la mostrada en la Figura 12, que tiene una pérdida de peso despreciable hasta aproximadamente 150ºC.
13. Forma cristalina según se ha definido en la reivindicación 8, caracterizada por el patrón C-13 SSRMN de la Forma N-1 de la sal de MSA de la base libre mostrada en la Figura 6 y por los picos sustancialmente como se expone en la tabla siguiente:
Desplazamientos químicos Carbono-13 SSRMN

14. Forma N-4 de sal de ácido clorhídrico de la base libre de la estructura

que está caracterizada por parámetros de célula unitaria sustancialmente iguales a los siguientes:
Dimensiones de célula:
a = 20,9498 (5) Å
b = 13,8719 (3) Å
c = 7,9133 (2) Å
a = 90º
ß = 100,052 (1)º
? = 90º
Grupo de espacio P21/n
Moléculas/unidad asimétrica I
en la que la forma cristalina está a aproximadamente +22ºC.
15. Forma cristalina según se ha definido en la reivindicación 14, caracterizada por coordenadas atómicas fraccionarias sustancialmente como se muestra en la tabla siguiente:
Parámetros posicionales y factores de temperatura isotrópica para la Forma N-4 de sal de HCl de la base libre I a temperatura ambiente

16. Forma cristalina según se ha definido en la reivindicación 14, que tiene una difracción de rayos X en polvo que comprende los valores 2? siguientes (CuKa ?= 1,5418 Å) 8,6
17. Forma cristalina según se ha definido en la reivindicación 14, caracterizada por un termograma de calorimetría diferencial de barrido sustancialmente según el mostrado en la Figura 8, que tiene una endoterma en el intervalo de aproximadamente 130 a aproximadamente 220ºC (variable).
18. Forma cristalina según se ha definido en la reivindicación 14, caracterizada por una curva de análisis térmico gravimétrico según la mostrada en la Figura 11 que tiene una pérdida de peso despreciable hasta aproximadamente 125ºC.
19. Forma cristalina según la reivindicación 14, caracterizada por el patrón C-13 SSRMN de la Forma N-4 de se ha definido en la base libre mostrado en la Figura 5 y por los picos sustancialmente enumerados en la tabla siguiente:
Desplazamientos químicos Carbono-13 SSRMN para cada una de las Formas

20. Forma cristalina según se ha definido en la reivindicación 14, que tiene una distribución de tamaño de partícula medio de 95% < 60 µm.
21. Procedimiento de preparación de la sal de ácido clorhídrico de
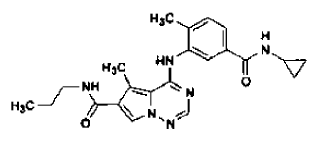
en forma de cristales de la Forma N-1 según la reivindicación 2, que comprende
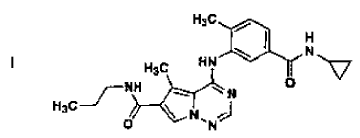
22. Procedimiento según se ha definido en la reivindicación 21, en el que la base libre es mezclada con:
23. Procedimiento según se ha definido en la reivindicación 22, en el que las semillas de cristales de la Forma N-1 de la sal de clorhidrato se preparan:
24. Procedimiento de preparación de la Forma N-1 de sal de ácido metanosulfónico de un compuesto que tiene la estructura
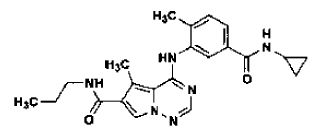
según la reivindicación 8, que comprende

25. Procedimiento según se ha definido en la reivindicación 24, en el que el solvente orgánico es N,N-dimetilformamida, alcohol de isopropilo o etanol.
26. Procedimiento según se ha definido en la reivindicación 24, en el que el solvente orgánico es N,N-dimetilformamida, que incluye la etapa de añadir acetona a la mezcla de reacción previamente al sembrado.
27. Procedimiento según se ha definido en la reivindicación 24, en el que las semillas de cristales de la Forma N-1 se preparan:
28. Procedimiento de preparación de la sal de ácido clorhídrico de la base libre de la estructura

en forma de cristales de la Forma N-4 según la reivindicación 14, que comprende
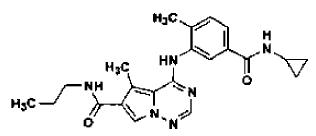
29. Procedimiento de preparación de la sal de ácido clorhídrico de la base libre de la estructura
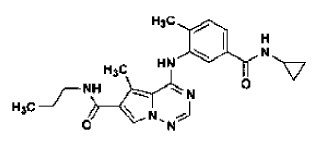
en la forma de cristales de la Forma N-4, tal como se ha definido en la reivindicación 14, que comprende

30. Procedimiento de preparación de la sal de ácido clorhídrico de una base libre de la estructura
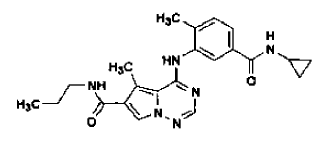
en la forma de cristales N-4, tal como se ha definido en la reivindicación 14, que comprende
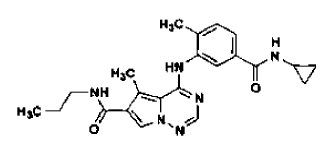
31. Procedimiento de preparación de la sal de ácido clorhídrico de una base libre de la estructura

en la forma de cristales N-4, tal como se ha definido en la reivindicación 14, que comprende

32. Procedimiento de preparación de la sal de ácido clorhídrico de
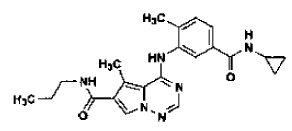
en la forma de cristales de la Forma N-4, tal como se ha definido en la reivindicación 14, que comprende

33. Procedimiento de preparación de la Forma N-4 de sal de ácido clorhídrico de un compuesto que tiene la estructura

tal como se ha definido en la reivindicación 14, que comprende

34. Procedimiento de preparación de la sal de ácido clorhídrico de una base libre de la estructura
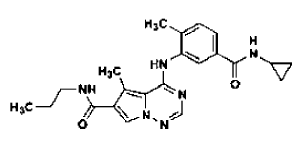
en la forma de cristales N-4, tal como se ha definido en la reivindicación 14, que comprende

35. Procedimiento de preparación de la sal de ácido clorhídrico de la base libre de la estructura

en la forma de cristales de la Forma N-4, tal como se ha definido en la reivindicación 14, que comprende
36. Procedimiento de preparación de la sal de ácido clorhídrico de la base libre de la estructura
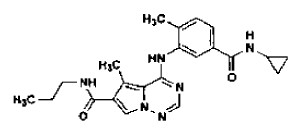
en la forma de cristales N-4, tal como se ha definido en la reivindicación 14, que comprende
37. Forma N-1 de la sal de ácido clorhídrico de la base libre

preparada tal como se ha definido mediante el procedimiento de la reivindicación 21.
38. Forma N-1 de la sal de ácido metanosulfónico de la base libre
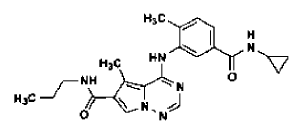
preparada tal como se ha definido mediante procedimiento de la reivindicación 24.
39. Forma N-4 de la sal de ácido clorhídrico de la base libre
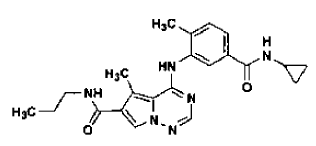
preparada tal como se ha definido mediante el procedimiento de la reivindicación 28.
40. Forma N-4 de sal de ácido clorhídrico de la base libre
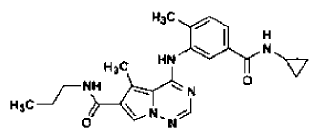
preparada tal como se ha definido mediante el procedimiento de la reivindicación 29.
41. Forma N-4 de sal de ácido clorhídrico de la estructura
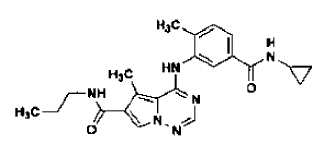
preparada tal como se ha definido mediante el procedimiento de la reivindicación 30.
42. Forma N-4 de sal de ácido clorhídrico de la estructura
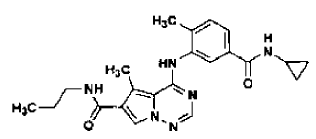
preparada tal como se ha definido mediante el procedimiento de la reivindicación 31.
43. Forma N-4 de la sal de ácido clorhídrico de la estructura

preparada tal como se ha definido mediante el procedimiento de la reivindicación 32.
44. Forma N-4 de sal de ácido clorhídrico de la estructura
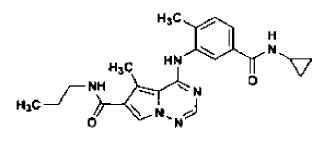
preparada tal como se ha definido mediante el procedimiento de la reivindicación 33.
45. Forma N-4 de sal de ácido clorhídrico de la estructura

preparada tal como se ha definido mediante el procedimiento de la reivindicación 34.
46. Forma N-4 de sal de ácido clorhídrico de la estructura

preparada tal como se ha definido mediante el procedimiento de la reivindicación 35.
47. Forma N-4 de sal de ácido clorhídrico de la estructura
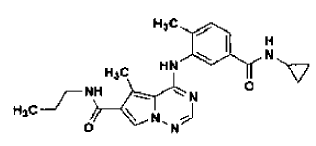
preparada tal como se ha definido mediante el procedimiento de la reivindicación 36.
48. Composición farmacéutica que comprende al menos un compuesto según la reivindicación 1 y un diluyente o portador farmacéuticamente aceptable.
49. Composición farmacéutica que comprende al menos un compuesto según la reivindicación 2 y un diluyente o portador farmacéuticamente aceptable.
50. Composición farmacéutica que comprende al menos un compuesto según la reivindicación 14 y un diluyente o portador farmacéuticamente aceptable.
51. Uso de un compuesto de una cualquiera de las reivindicaciones 1 a 20, o 37 a 47 para preparar una composición farmacéutica para tratar un trastorno inflamatorio.
52. Uso según la reivindicación 51, en el que el trastorno inflamatorio es seleccionado de entre asma, síndrome de insuficiencia respiratoria en adultos, enfermedad pulmonar obstructiva crónica, enfermedad inflamatoria pulmonar crónica, diabetes, enfermedad inflamatoria intestinal, osteoporosis, psoriasis, rechazo de injerto vs huésped, arterioesclerosis y artritis, incluyendo artritis reumatoide, artritis psoriática, artritis traumática, artritis por rubeola, artritis gotosa y osteoartritis.
53. Compuesto según una cualquiera de las reivindicaciones 1 a 20, para su uso en un procedimiento de tratamiento de un trastorno inflamatorio.
54. Compuesto según la reivindicación 53, en el que el trastorno inflamatorio es seleccionado de entre asma, síndrome de insuficiencia respiratoria en adultos, enfermedad pulmonar obstructiva crónica, enfermedad inflamatoria pulmonar crónica, diabetes, enfermedad inflamatoria intestinal, osteoporosis, psoriasis, rechazo de injerto vs huésped, arterioesclerosis y artritis, incluyendo artritis reumatoide, artritis psoriática, artritis traumática, artritis por rubeola, artritis gotosa y osteoartritis.
Patentes similares o relacionadas:
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
1,5-Dihidro-4H-pirazolo[3,4-d]pirimidin-4-onas y 1,5-dihidro-4H-pirazolo[4,3-c]piridin-4-onas como inhibidores de la PDE1, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de fórmula (I) **(Ver fórmula)** en donde Y es N o CH; R1 se selecciona del grupo que consiste en alquilo C2-C8 lineal o ramificado, cicloalquilo […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Antagonistas del receptor de dopamina D3 que tienen una unidad estructural biciclo, del 15 de Julio de 2020, de Indivior UK Limited: Un compuesto, o una sal farmacéuticamente aceptable del mismo, que tiene la fórmula: **(Ver fórmula)** en donde; A y B juntos tienen la fórmula: **(Ver […]