MONOHIDRATO DE AZITROMICINA.
Procedimiento para la producción de azitromicina en forma de un monohidrato estable,
que comprende las etapas de:
i) ajustar el pH de una solución de azitromicina en forma de una sal, y
ii) aislar azitromicina de fórmula I en forma de un monohidrato,
caracterizado porque la solución de azitromicina en la etapa i) es una solución acuosa en donde el disolvente se elige entre agua
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06117687.
Solicitante: SANDOZ AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35,4056 BASEL.
Inventor/es: CENTELLAS, VICTOR, GARCIA, RAFAEL, POCH, MARTA, DIAGO, JOSE, LUDESCHER, JOHANNES, BOSCH, IMMACULADA.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Junio de 2000.
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K31/7052 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el nitrógeno como heteroatomo de un ciclo, p. ej. nucleósidos, nucleótidos.
- C07H17/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido.
- C07H17/08 C07H […] › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Clasificación PCT:
- A61K31/7048 A61K 31/00 […] › teniendo el oxígeno como heteroatomo de un ciclo, p. ej. Leucoglucosano, hesperidina, eritromicina, nistatina.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C07H17/00 C07H […] › Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido.
- C07H17/08 C07H 17/00 […] › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
Fragmento de la descripción:
Monohidrato de azitromicina.
La presente invención se refiere a un procedimiento para la producción de azitromicina. La azitromicina (9-deoxo-9a-aza-9a-metil-9a-homoeritromicina A) de fórmula
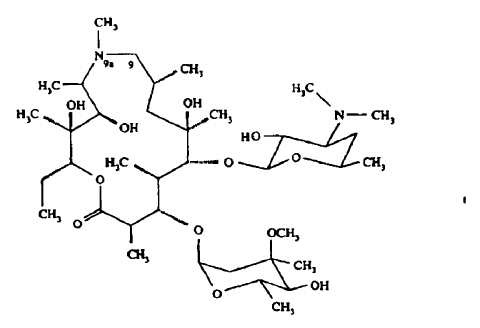
es un agente antibacteriano bien conocido, descrito, por ejemplo, en The Merck Index, 12ª edición (1996), página 157 (946) y se puede producir, por ejemplo, mediante:
- transposición de Beckmann de 9 oxima de eritromicina A para proporcionar 9-deoxo-6-deoxi-6,9-epoxi-9,9a-didehidro-9a-aza-9a-homoeritromicina de fórmula
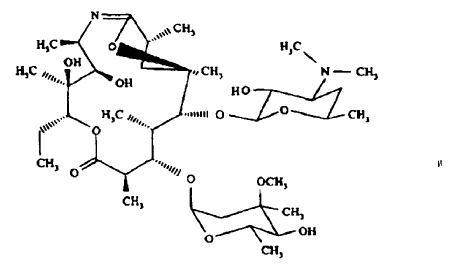
- reducción de un compuesto de fórmula II para proporcionar 9-deoxo-9a-aza-9a-homoeritromicina A de fórmula
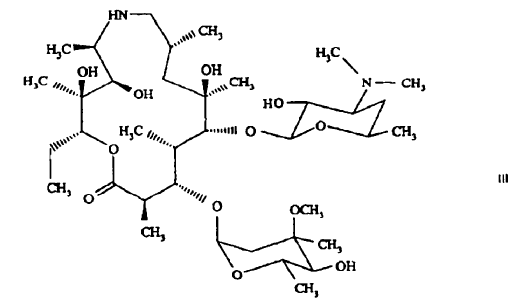
- N-metilación de un compuesto de fórmula III para proporcionar azitromicina, por ejemplo, de fórmula I. La reducción de un compuesto de fórmula II para obtener un compuesto de fórmula III se puede efectuar, por ejemplo, bien catalíticamente empleando hidrógeno o bien, alternativamente, en presencia de borohidruros, por ejemplo, borohidruro sódico, cuyo uso, sin embargo, puede traducirse en compuestos de boratos intermedios, por ejemplo, ésteres de ácido bórico con uno o más de los grupos hidroxi de un compuesto de fórmula III. La naturaleza química de los compuestos de boratos intermedios resultantes puede depender de las condiciones de reacción usadas y se pueden obtener diferentes compuestos de boratos intermedios y mezclas de los mismos. Por ejemplo, de acuerdo con los datos (MS, 11B y 13C NMR) se puede obtener, por ejemplo, un compuesto de borato intermedio de fórmula
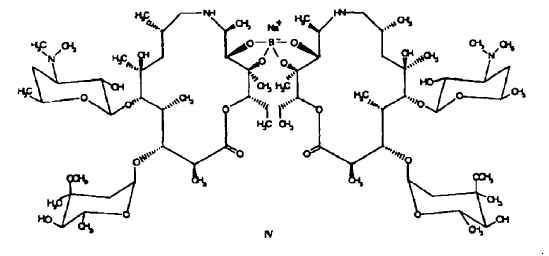
La hidrólisis de los compuestos de boratos intermedios para obtener un compuesto de fórmula III se puede efectuar bajo condiciones ácidas que, sin embargo, pueden implicar condiciones degradantes para la estructura del macrólido. El aislamiento de un compuesto de fórmula III a partir de la mezcla de reacción resultante de la hidrólisis de los compuestos de boratos intermedios se puede efectuar bajo condiciones neutras o básicas y puede complicarse debido a que bajo condiciones neutras y básicas puede presentarse la formación de nuevo de compuestos de boro intermedios y por cromatografía, por ejemplo, se puede separar un compuesto de fórmula III de los compuestos de boratos intermedios. De este modo, a escala industrial, la reducción de un compuesto de fórmula I se efectúa con preferencia catalíticamente empleando hidrógeno.
La azitromicina puede encontrarse en forma de un solvato, por ejemplo en forma de un hidrato, tal como un monohidrato o, por ejemplo, en forma de un dihidrato. Se sabe que la azitromicina en forma de un monohidrato es inestable, por ejemplo, la estructura cristalina de la azitromicina en forma de un monohidrato puede romperse bajo condiciones normales de humedad del aire en el plazo de algunas horas. De este modo, la azitromicina en forma de un monohidrato que se puede obtener de acuerdo con un método convencional, por ejemplo mediante precipitación con agua en solución etanólica, ha sido descrita como de una manipulación nada fácil. Esto podría ser uno de los motivos por los cuales la azitromicina actualmente en el mercado se encuentra en forma de un dihidrato que, como se conoce, es estable bajo condiciones normales de humedad del aire, por ejemplo, se sabe que la estructura cristalina de la azitromicina en forma de un dihidrato no se rompe en el plazo de algunas horas bajo condiciones normales de humedad del aire.
La azitromicina en forma de un monohidrato producida de acuerdo con métodos conocidos, por ejemplo precipitación con agua en una solución etanólica, puede contener, además de su inestabilidad, un alto contenido en disolventes residuales, por ejemplo, 1,0% y más y puede resultar inadecuada para utilizarse como producto farmacéutico.
La EP 298650 está relacionada con el dihidrato de azitromicina que es estable en comparación con el monohidrato de azitromicina hidróscópico conocido (página 2, líneas 14-21). No existe descripción de un procedimiento para la preparación de monohidrato de azitromicina estable empleando agua como único disolvente.
Se ha comprobado ahora de manera sorprendente que se puede obtener azitromicina, por ejemplo de fórmula I, en forma, por ejemplo, de un monohidrato cristalino que es estable y que puede ser manipulado fácilmente. La expresión "monohidrato estable" tal y como aquí se emplea incluye un compuesto de fórmula I en forma de un monohidrato que es cristalino y que mantiene su estructura cristalina durante al menos 24 horas, por ejemplo durante varias semanas, bajo condiciones normales, por ejemplo, bajo la humedad normal del aire. La estructura cristalina de la azitromicina en forma de un monohidrato se puede determinar por su patrón de difracción de rayos X en polvo (conocido).
También se ha comprobado que la azitromicina en forma de un monohidrato estable de acuerdo con la presente invención puede contener agua en una cantidad, por ejemplo, de alrededor de 1,5%, por ejemplo y más, tal como de 2,0% hasta 5,5% y más, por ejemplo, 6,0% p/p, por ejemplo de 2,0% a 6,0% p/p, tal como de 1,5% a 5,5% p/p sin que cambie su estructura cristalina y sin absorber de forma notable más agua. Un contenido en agua de 2,0% a 6,0% p/p incluye el agua necesaria para la formación del monohidrato de azitromicina.
La presente invención proporciona un procedimiento para la producción de azitromicina en forma, por ejemplo, de un monohidrato estable, por ejemplo cristalino, que comprende las etapas de:
De acuerdo con la presente invención, la azitromicina en forma, por ejemplo, de un monohidrato estable, por ejemplo cristalino, se puede obtener sustancialmente libre de disolvente orgánico.
Como material de partida se puede emplear azitromicina en cualquier forma, por ejemplo en forma como se ha descrito anteriormente como un material de partida para la producción de azitromicina en forma de un monohidrato estable. Se puede obtener una solución de azitromicina en forma de una sal en agua, por ejemplo, disolviendo azitromicina en forma de una sal en agua, o bien por conversión de azitromicina en forma libre en agua a una forma de una sal de azitromicina; por ejemplo, por adición de un ácido a la azitromicina en agua. El término "solución" incluye una suspensión en donde está disuelta al menos una parte de la azitromicina en forma de una sal. Acidos adecuados incluye, por ejemplo, un ácido orgánico, por ejemplo ácido fórmico o ácido acético, y un ácido inorgánico, por ejemplo ácido clorhídrico, bromhídrico, nítrico o sulfúrico, con preferencia ácido clorhídrico o ácido sulfúrico.
Las condiciones de reacción adecuadas para la producción de una solución de azitromicina en forma de una sal de acuerdo con la presente invención incluyen, por ejemplo:
La solución resultante de azitromicina en forma de una sal en agua puede ser purificada como resulte más adecuado, por ejemplo, por filtración, tratamiento con carbón vegetal, con el fin de eliminar impurezas. El pH, por ejemplo, de una solución purificada de azitromicina en forma de una sal puede ser ajustado a un pH en donde la azitromicina está presente en forma libre, incluyendo, por ejemplo, un pH de alrededor de 8,0 a 13,0, tal como de 9,0 a 12,0, por ejemplo de 10,0 a 11,0, por ejemplo, por adición de una base a una solución de azitromicina...
Reivindicaciones:
1. Procedimiento para la producción de azitromicina en forma de un monohidrato estable, que comprende las etapas de:
caracterizado porque la solución de azitromicina en la etapa i) es una solución acuosa en donde el disolvente se elige entre agua.
Patentes similares o relacionadas:
Polimorfos de 20,23-piperidinil-5-O-micaminosiltilonolida, del 20 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una forma cristalina de 20,23-dipiperidinil-5-O-micaminosil-tilonolida que tiene al menos una de las siguientes características: un espectro FT-Raman que comprende […]
Derivados de azitromicina con propiedades de potenciación de la barrera epitelial, del 13 de Mayo de 2020, de EpiEndo Pharmaceuticals ehf: Un compuesto de acuerdo con la fórmula (I) **(Ver fórmula)** En donde R1 es OH; R2 es de acuerdo con la fórmula (III) **(Ver […]
Derivados de avermectina B1 que tienen un sustituyente alcoximetilo en la posición 4'''' o 4'', del 17 de Febrero de 2020, de Boehringer Ingelheim Animal Health USA Inc: Compuesto de fórmula**Fórmula** en la que n es 0 o 1; A-B es -CH=CH; R1 es sec-butilo o isopropilo; R2 es CH2CH3, p-ClC6H4, CH2(CH2)2N3 […]
Levoisovalerilespiramicina III y preparaciones, métodos de preparación y utilizaciones de la misma, del 1 de Enero de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto cristalino de levoisovalerilespiramicina III, en el que, la fórmula estructural química de la levoisovalerilespiramicina III se representa como la fórmula […]
 Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Forma cristalina de levoisovalerilespiramicina II y preparaciones, procedimientos de preparación y utilizaciones de la misma, del 7 de Agosto de 2019, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto de levoisovalerilespiramicina II, en el que, la fórmula estructural química de la levoisovalerilespiramicina II se representa como la fórmula (II), en condiciones […]
Derivados de la anfotericina B con índice terapéutico mejorado, del 20 de Septiembre de 2018, de The Board of Trustees of the University of Illionis: Un compuesto, o una sal farmacéuticamente aceptable del mismo, el compuesto que se selecciona de**Fórmula**
Procedimientos para tratar enfermedades resistentes usando macrólidos que contienen triazol, del 11 de Abril de 2018, de Cempra Pharmaceuticals, Inc: Una cantidad terapéuticamente efectiva de un compuesto de la fórmula **Fórmula** o una sal farmacéuticamente aceptable del mismo, en el […]