METODO FARMACEUTICAMENTE COMPATIBLE PARA PURIFICAR MINICELULAS BACTERIANAS INTACTAS.
Un método de purificación que comprende someter una muestra enriquecida en minicélulas a una condición que induce que las células bacterianas parentales adopten una forma filamentosa y después filtrar dicha muestra,
produciendo una composición purificada de minicélulas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/002091.
Solicitante: ENGENEIC MOLECULAR DELIVERY PTY LTD.
Nacionalidad solicitante: Australia.
Dirección: BUILDING 2, 25 SIRIUS ROAD LANE COVE WEST,SYDNEY NSW 2066.
Inventor/es: BRAHMBHATT, HIMANSHU, MACDIARMID,JENNIFER.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C12N1/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Separación de microorganismos de sus medios de cultivo.
- C12N1/20 C12N 1/00 […] › Bacterias; Sus medios de cultivo.
Clasificación PCT:
- C12N1/02 C12N 1/00 […] › Separación de microorganismos de sus medios de cultivo.
Clasificación antigua:
- C12N1/02 C12N 1/00 […] › Separación de microorganismos de sus medios de cultivo.
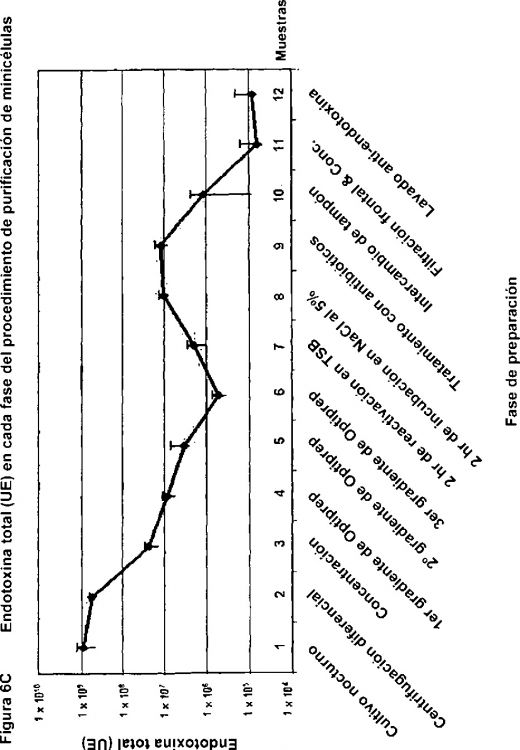
Fragmento de la descripción:
Método farmacéuticamente compatible para purificar minicélulas bacterianas intactas.
Antecedentes de la invención
La presente invención se refiere a un método farmacéuticamente compatible para purificar minicélulas bacterianas intactas.
Una minicélulas es una forma anucleada de una E. coli u otra célula bacteriana, engendrada por una alteración en la coordinación, durante la fisión binaria, de la división celular con la segregación de ADN. La replicación cromosómica procariota está unida a la fisión binaria normal, que implica la formación de un septo en mitad de la célula. Por ejemplo, en E. coli, la mutación de los genes min, tal como minCD, puede eliminar la inhibición de la formación del septo en los polos celulares durante la división celular, lo que resulta en la producción de una célula hija normal y una minicélula anucleada (de Boer et al., 1992; Raskin & de Boer, 1999; Hu & Lutkenhaus, 1999; Harry, 2001).
Además de las mutaciones en el operón min, las minicélulas anucleadas también se generan siguiendo una gama de otras reorganizaciones o mutaciones genéticas que afectan a la formación del septo, por ejemplo en el divIVB1 en B. subtilis (Reeve y Cornett, 1975; Levin et al., 1992). Las minicélulas también se pueden formar después de una alteración en los niveles de la expresión génica de proteínas implicadas en la división celular/segregación cromosómica. Por ejemplo, la sobreexpresión de minE produce división polar y la producción de minicélulas. De forma similar, las minicélulas sin cromosoma pueden provenir de defectos en la segregación cromosómica, por ejemplo la mutación smc en Bacillus subtilis (Britton et al., 1998), la deleción spoOJ en B. subtilis (Ireton et al., 1994), la mutación mukB en E. coli (Hiraga et al., 1989) y la mutación parC en E. coli (Stewart y D'Ari, 1992). Los productos génicos se pueden suministrar en trans. Cuando se sobreexpresa de un plásmido de alto número de copia, por ejemplo, CafA puede aumentar la velocidad de división celular y/o inhibir el reparto cromosómico después de la replicación (Okada et al., 1994), lo que produce la formación de células encadenadas y minicélulas anucleadas (Wachi et al., 1989; Okada et al., 1993).
Las minicélulas son diferentes de otras pequeñas vesículas que se generan y liberan de forma espontánea en ciertas situaciones y, al contrario que las minicélulas, no se deben a reorganizaciones genéticas específicas o expresión génica episomal. Ejemplares de tales otras vesículas son ampollas bacterianas que son pequeñas vesículas de membrana (Dorward et al., 1989). Se han observado las ampollas en varias especies de bacterias desde Agrobacterium, Bacillus, Bordetella, Escherichia, Neisseria, Pseudomonas, Salmonella y Shigella, por ejemplo. Las ampollas bacterianas se pueden producir, por ejemplo, mediante manipulación del entorno de crecimiento (Katsui et al., 1982) y mediante el uso de agentes exógenos que desestabilizan la membrana (Matsuzaki et al., 1997).
Puesto que la replicación de plásmidos en células procariotas es independiente de la replicación cromosómica, los plásmidos pueden segregar tanto en células hijas normales como minicélulas durante la división celular anómala descrita anteriormente. De esta manera, las minicélula derivadas de E. coli min- recombinantes tienen números significativos de copias de plásmidos, con todos los componentes celulares bacterianos excepto cromosomas y se han usado como tales para estudiar expresión de genes codificados en plásmidos in vitro. Véase Brahmbhatt (1987), Harlow et al., (1995) y Kihara et al., (1996). Brahmbhatt (1987) demostró, por ejemplo, que las miniclélulas de E. coli pueden tener plásmidos recombinantes con insertos de ADN tan grandes como de 20 kb, ausente cualquier ADN cromosómico, y pueden expresar nueve o más proteínas recombinantes de forma simultánea.
Una publicación de patente reciente, WO03033519, describe minicélulas recombinantes intactas que contienen moléculas de ácido nucleico terapéutico. Tales minicélulas son vectores eficaces para distribuir oligonucleótidos y polinucleótidos a células huésped in vitro e in vivo. Según esto, son particularmente útiles para introducir moléculas de ácido nucleico que, tras la transcripción y/o traducción, funcionan para mejorar o tratar de otra manera una enfermedad o modificar un rasgo asociado con un tipo celular, tejido u órgano particular de un sujeto.
Khachatourians et al., (1973) describe un método para preparar minicélulas en donde las bacterias contaminantes presentes en cultivos de minicélulas después de centrifugación diferencial a baja velocidad se transforman en células filamentosas largas y se matan mediante tratamiento sónico.
Las aplicaciones de minicélulas in vivo en general requieren preparaciones de minicélulas de alta pureza, particularmente con respecto a bacterias parentales vivas, sin endotoxina y restos celulares (incluyendo bacterias parentales vivas, fragmentos de membrana, ácidos nucleicos y componentes intracelulares) que podrían provocar una respuesta inflamatoria en un huésped inmunizado. Además, el uso de minicélulas en productos farmacéuticos comerciales requerirá métodos de purificación de las minicélulas según estándares farmacéuticos internacionales aprobados. Para este fin, los métodos convencionales de purificación de minicélulas son en general insatisfactorios.
Las técnicas convencionales implican (a) centrifugación a baja velocidad, para reducir la carga biológica de células parentales y (b) sedimentación a velocidad diferencial en un gradiente de glicerol, sacarosa o percoll. Una centrifugación diferencial inicial a baja velocidad típicamente reduce las células parentales en tanto como 100 veces, mientras que deja del 50% al 70% de las minicélulas en el líquido sobrenadante. Dos ciclos posteriores de sedimentación a velocidad diferencial producen después preparaciones de minicélulas que tienen una pureza de alrededor de 1 célula vegetativa por 106-107 minicélulas. Tales métodos convencionales se revisan en Frazer & Curtiss (1975) y se describen en Reeve (1979), Clark-Curtiss & Curtiss (1983) y la patente de EE. UU. No. 4311797 (a Khachatourians).
La pureza alcanzada mediante los métodos convencionales de purificación puede no ser adecuada para todas las aplicaciones in vivo, algunas de las cuales pueden requerir dosis mayores de 106 minicélulas o incluso 1010 minicélulas. A la relación de contaminación anteriormente mencionada, esto se traduciría en 10.000 células parentales vivas por dosis. Tal nivel de contaminación podría ser letal, particularmente en pacientes inmunodeprimidos tales como pacientes de cáncer y SIDA. Por ejemplo, la DI50 (dosis infecciosa en el 50% de las personas infectadas) para organismos de Shigella dysenteriae, Salmonella enteritidis y Listeria monocytogenes es aproximadamente 10, 1.000 y 10 respectivamente. Además, estudios previos han descrito que el nivel de contaminación celular parental varía con diferentes cepas bacterianas (Clarke-Curtiss y Curtiss, 1983). A ese respecto, las aplicaciones de terapia génica descritas en WO03033519 pueden emplear minicélulas derivadas de una gama de cepas bacterianas mutantes Gram negativas y Gram positivas y requerirían minicélulas que están esencialmente libres de contaminación de células bacterianas parentales vivas. De esta manera, los métodos convencionales de purificación de minicélulas no permiten control de calidad para la fabricación cGMP (buena práctica de fabricación actual, en sus siglas en inglés) de dosis biofarmacéuticas de minicélulas.
Como desventaja adicional, los medios de formación del gradiente (percoll, sacarosa y glicerol) empleados por los métodos convencionales de purificación son incompatibles con usos in vivo. El percoll es tóxico y, por lo tanto, está restringido a contextos de "solo fines de investigación". La sacarosa da una gran osmolaridad a los gradientes que puede producir cambios fisiológicos en la minicélulas. En efecto, los presentes inventores han determinado que las minicélulas experimentan un choque osmótico en gradientes de sacarosa y, como consecuencia, de vuelven estructuralmente deformadas....
Reivindicaciones:
1. Un método de purificación que comprende someter una muestra enriquecida en minicélulas a una condición que induce que las células bacterianas parentales adopten una forma filamentosa y después filtrar dicha muestra, produciendo una composición purificada de minicélulas.
2. Un método según la reivindicación 1, en donde dicha condición es una condición osmótica, una condición anaeróbica o una condición de limitación de nutrientes, que inducen estrés.
3. Un método según la reivindicación 1, en donde dicha muestra se incuba en un medio hipertónico.
4. Un método según la reivindicación 1, en donde el paso de filtración es una filtración frontal con un filtro que emplea un tamaño de poro de alrededor de 0,45 µm.
5. Un método según la reivindicación 1, en donde el paso de filtración emplea un filtro que tiene un tamaño de poro lo suficientemente pequeño para permitir que las minicélulas pasen a través de los poros, pero no las células bacterianas parentales filamentosas.
6. Un método según la reivindicación 1, en donde el paso de filtración comprende filtración de flujo transversal.
7. Un método según la reivindicación 1, en donde el paso de filtración comprende un proceso de filtración en serie que combina filtración de flujo transversal y filtración frontal.
8. Un método según la reivindicación 7, en donde el paso de filtración emplea al menos un filtro que emplea un tamaño de poro menor que o igual a alrededor de 0,2 µm.
9. Un método según la reivindicación 7, en donde el paso de filtración emplea al menos un filtro que emplea un tamaño de poro mayor que o igual a alrededor de 0,45 µm.
10. Un método según la reivindicación 7, en donde dicho proceso de filtración en serie está precedido por centrifugación diferencial.
11. Un método según la reivindicación 1, en donde el paso de filtración emplea al menos un filtro que emplea un tamaño de poro menor que o igual a alrededor de 0,2 µm.
12. Un método según la reivindicación 1, en donde el paso de filtración emplea al menos un filtro que emplea un tamaño de poro mayor que o igual a alrededor de 0,45 µm.
13. Un método según la reivindicación 1, que además comprende un paso de someter las minicélulas a centrifugación en gradiente de densidad.
14. Un método según la reivindicación 13, que además comprende un paso de someter las minicélulas a centrifugación diferencial.
15. Un método según la reivindicación 13, en donde dicho medio es isotónico y no tóxico.
16. Un método según la reivindicación 13, en donde dicho medio consiste esencialmente en yodixanol y agua.
17. Un método según la reivindicación 1, que además comprende un paso de tratar dicha composición purificada de minicélulas con un antibiótico.
18. Un método según la reivindicación 1, que comprende además un paso de eliminar la endotoxina libre de dicha composición purificada de minicélulas.
19. Un método según la reivindicación 18, en donde dicho paso de eliminar la endotoxina libre emplea anticuerpos anti-lípido A.
20. Una preparación purificada de minicélulas, obtenible según el método de la reivindicación 1, que contiene menos de alrededor de 1 célula bacteriana parental contaminante por 1010 minicélulas, en donde el paso de filtración de dicho método comprende un proceso de filtración en serie que combina filtración de flujo transversal y filtración frontal, en donde dicho proceso de filtración en serie está precedido por centrifugación diferencial y dicho método comprende además un paso de someter las minicélulas a centrifugación en gradiente de densidad.
21. Una preparación purificada de minicélulas, obtenible según el método de la reivindicación 1, que contiene menos de alrededor de 1 célula bacteriana parental contaminante por 1011 minicélulas, en donde el paso de filtración de dicho método comprende un proceso de filtración en serie que combina filtración de flujo transversal y filtración frontal, en donde dicho proceso de filtración en serie está precedido por centrifugación diferencial y dicho método comprende además un paso de someter las minicélulas a centrifugación en gradiente de densidad.
Patentes similares o relacionadas:
Método para producir carne capaz de reducir el consumo de ácidos grasos saturados, del 22 de Julio de 2020, de Biobalance Co., Ltd: Lactobacillus plantarum BB-PLT (NITE BP-02097).
Composición adecuada para proteger microorganismos, del 15 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición que comprende un material soporte formado por un polisacárido, al menos un antioxidante y una combinación de aminoácidos seleccionados entre cisteína y […]
Consorcio de microorganismos y su uso para reducir la demanda química de oxígeno del fluido consumido para trabajar metales, del 15 de Julio de 2020, de FORD MOTOR COMPANY LIMITED: Un consorcio de microorganismos que comprende, consiste o consiste esencialmente en Rhizobium radiobacter NCIMB 42280, Bacillus subtilis NCIMB […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
UNA FORMULACIÓN PARA LA PROTECCIÓN CONTRA LA BACTERIOSIS DEL KIWI, CAUSADA POR LA BACTERIA PSEUDOMONAS SYRINGAE PV. ACTINIDIAE (PSA), del 9 de Julio de 2020, de UNIVERSIDAD DE CONCEPCION: La tecnología corresponde a una formulación para la protección contra la bacteriosis del kiwi, causada por la bacteria Pseudomonas syringae […]
Novedosa cepa de Gluconacetobacter diazotrophicus (Gd) y uso de la misma en agricultura, del 8 de Julio de 2020, de Azotic Technologies Ltd: Una cepa fijadora de nitrógeno de Gluconacetobacter diazotrophicus (Gd) depositada por CABI en el Reino Unido con el número de acceso del depósito IMI 504958.
Selección y uso de cepas de bacilos tolerantes al frío como fitoestimuladores biológicos, del 8 de Julio de 2020, de Abitep GmbH: Composición para estimular el crecimiento de plantas de cultivo, caracterizada por el hecho de que contiene la cepa tolerante al frío Bacillus atrophaeus ABI02A […]
PROCEDIMIENTO PARA REDUCIR EL CONTENIDO DE HISTAMINA EN VINOS, del 7 de Julio de 2020, de PAGO DE CARRAOVEJAS, S.L: Procedimiento para reducir el contenido de histamina en vinos. La invención consiste en un proceso a través del cual, seleccionando una serie de poblaciones de bacterias […]