INTERLEUQUINA 2 ESTABILIZADA.
Una composición farmacéutica liofilizada estable que comprende una muteína de interleuquina-2 (IL-2) humana estabilizada con histidina,
en la que la muteína de IL-2 posee una única sustitución de aminoácido: N88R
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US01/20675.
Solicitante: BAYER CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 100 BAYER ROAD,PITTSBURGH, PA 15205-9741.
Inventor/es: WANG, WEI, SHEARER, MICHAEL A., NAYAR, RAJIV.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K38/20B
Clasificación PCT:
- A61K38/20 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interleuquinas.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
Fragmento de la descripción:
Interleuquina 2 estabilizada.
Antecedentes de la invención
La invención en general se refiere al campo de las formulaciones farmacéuticas. Más específicamente, la invención se refiere a una formulación de interleuquina-2 terapéuticamente activa estabilizada capaz de activar selectivamente células T (blastos PHA) y que incluye, muy preferentemente, una luteína de IL-2 que exhibe una reducida activación de las células Citolíticas Naturales ("NK"). Las composiciones estabilizadas que poseen las propiedades preferentes incluyen variantes de la IL-2 descritas más abajo.
Según se trata en una solicitud relacionada, la PCT/US 99/10643 publicada el 25 de noviembre de 1999, la Interleuquina 2 (IL-2) es un potente estimulador inmunitario, que activa diversas células del sistema inmunitario, incluyendo células T, B y monocitos. IL-2 es también un potente y crítico factor de crecimiento de células T. Fue en virtud de estas actividades que se ensayó IL-2 en cuanto a su capacidad para tratar el cáncer. La IL-2 humana es un fármaco aprobado por la FDA para el tratamiento de carcinoma renal metastásico y melanoma metastásico. El uso de IL-2 en pacientes que reúnen los requisitos necesarios está restringido debido a la grave toxicidad asociada con la terapia con IL-2; se estima que como mucho sólo el 20% de los pacientes que reúnen los requisitos necesarios reciben en realidad la terapia. Las toxicidades asociadas con la terapia con IL-2 incluyen fiebre severa, náuseas, vómitos, extravasación vascular y grave hipotensión. A pesar de estas toxicidades, sin embargo, IL-2 es efectiva para las indicaciones aprobadas. Las variantes de IL-2 que poseen toxicidad reducida son el objeto de la solicitud WO 99/60128.
Se dispone de información importante sobre la estabilización de IL-2 y otras formulaciones terapéuticas proteicas. La preparación de IL-2 humana actualmente aprobada (Proleukin® IL-2, Chiron Corporation) es una preparación liofilizada que incluye manitol, dodecil sulfato de sodio (SDS) y un tampón de fosfato. Otras proteínas terapéuticas formuladas, que incluyen a IL-2, se describen en las siguientes referencias.
Fernandes et al., 1986, Pharmaceutical compositions of microbially produced interleukin-2 (Patente Estadounidense Núm. 4.604.377) describe una formulación liofilizada que contiene un estabilizador (manitol) y un agente solubilizante tal como dodecil sulfato de sodio o desoxicolato sulfato de sodio a razón de aproximadamente 100 a aproximadamente 250 ug por mg de IL-2. Se cree que en esta referencia se describe la formulación para el producto actualmente disponible Proleukin® IL-2.
Patel, 1994 Stabilization of protein formulations (Patente Estadounidense Núm. 5.358.708) describe formulaciones acuosas de un interferón, un factor estimulante de colonias de macrófagos y granulocitos o una interleuquina que poseen vidas útiles extendidas incorporando metionina, histidina o mezclas de las mismas. Aunque se hace referencia a varias interleuquinas, incluyendo IL-2, en el trabajo realizado con una formulación de IL-4 los patentadores descubrieron que la histidina es menos efectiva como estabilizador que la metionina, en las condiciones del ensayo de estabilizador utilizado.
Shaked, et al., 1991, Pharmaceutical compositions of recombinant interleukin-2 and formulation processes (Patente Estadounidense Núm. 5.037.644) describe formulaciones que están en forma liofilizada o líquida. Los excipientes de la formulación incluyen un detergente polimérico no iónico tal como Triton X405, Triton X305, monoestearato de PEG (4000), Tween 80 y Tween 20 en concentraciones de aproximadamente 0,001% a aproximadamente 5%, un agente expansor de volumen/estabilizante tal como sacarosa, fructosa, dextrosa, maltosa, glucosa, dextrano, manitol, sorbitol, inositol, galactitol, xilitol, lactosa, trehalosa, albúmina de suero humano y albúmina de suero bovino, y un agente tampón tal como glicina, citrato o fosfato en un intervalo de concentración de aproximadamente 10 mM a aproximadamente 50 mM con un pH que varía de aproximadamente 3 a aproximadamente 7. La concentración (peso/vol) del agente expansor de volumen azúcar-poliol varía de aproximadamente 0,025% a aproximadamente 10%.
Roskam et al., 1995, Drugs containing a glycosylated interleukin-2 (Patente Estadounidense Núm. 5.417.970) describe una formulación liofilizada que contiene gelatina (o albúmina de suero humano) hidrolizada y alanina con un pH 6,5.
Hora et al., 1992, Pharmaceutical composition for interleukin-2 containing physiologically compatible stabilizers (Patente Estadounidense Núm. 5.078.997) describe formulaciones que son líquidas o liofilizadas. Las formulaciones pueden contener uno o una combinación de estabilizadores tales como arginina, carnitina, betaína, piridoxina, polivinilpirrolidona, sales del ácido cáprico, azúcares, azúcar-alcoholes, albúmina de suero y citrato en tampón de pH 5,0-8,5. La concentración de los estabilizadores está entre 0,2 y 3,0% (p/v) para arginina, entre 0,2 y 3,0% (p/v) para carnitina, entre 2 y 6% (p/v) para sacarosa y entre 0,01 y 0,3 M para citrato.
Yasushi et al., 1987 Stable composition of interleukin-2 and albumin (Patente Estadounidense Núm. 4.645.830) describe una formulación acuosa estable que contiene albúmina de suero humano (0,1-50 mg/ml) con o sin un excipiente reductor tal como glutatión, ácido tióctico, N-acetilcisteína o ácido ascórbico (concentración de 0,05-20 mg/ml) a pH entre 3 y 5,5. La formulación de albúmina puede contener un aminoácido monoaminoalifático, un aminoácido cíclico, un monosacárido, un azúcar-alcohol o un aminoácido monoaminoalifático (concentración de 5 a 50 mg/ml).
Lee et al., 1989 Pharmaceutical plasma protein formulations in low ionic strength media; sodium chloride and/or potassium chloride, lysine hydrochloride, and histidine (Patente Estadounidense Núm. 4.877.608) describe el factor VIII estable y otras formulaciones de proteínas plasmáticas en medios de baja fuerza iónica que comprenden: cloruro de sodio, cloruro de potasio o mezclas de los mismos, clorhidrato de lisina, e histidina como agente tampón.
Nayar, 1998 stabilized albumin-free recombinant Factor VIII preparation having a low sugar content (Patente Estadounidense Núm. 5.763.401 y 5.874.408) describe una formulación FVIII estabilizada libre de albúmina que incluye glicina, histidina, sacarosa y NaCl.
Thatcher, 1987 interleukin-2 compositions (Solicitud de patente EP Núm. 0 229 016) desvela composiciones que contienen IL-2 natural o su equivalente recombinante estabilizada por albúmina sérica.
Lihsyng, 1999 stabilized monomeric protein compositions (Patente Estadounidense Núm. 5.917.021) se refiere a una composición de proteína en un estado acuoso congelado.
En el intento por descubrir una formulación de IL-2 estable (especialmente para la muteína de IL-2 preferente (N88R) del documento WO 99/60128), ahora hemos descubierto una formulación farmacéuticamente aceptable y muy estable para la IL-2 humana útil y biológicamente activa. Nuestro descubrimiento se basa en abordar lo que creemos es el mecanismo básico responsable de la estabilidad, según se describe más abajo.
Breve descripción de las figuras
La Figura 1 es un gráfico que ilustra el intervalo de pH óptimo para una solución acuosa de IL-2.
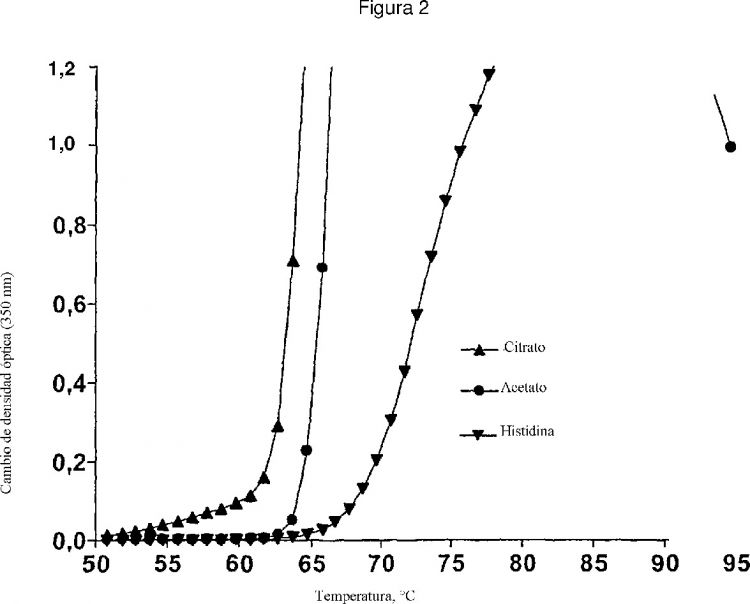
La Figura 2 compara el efecto estabilizador de la histidina respecto de acetato y citrato sobre la agregación de IL-2 inducida por calentamiento de la solución de proteína a razón de 1ºC/min desde 25ºC hasta 95ºC.
Sumario de la invención
La presente invención es una composición o formulación farmacéutica de una muteína de IL-2 estabilizada con histidina. Preferentemente, la composición comprende una mezcla que da como resultado una solución de baja fuerza iónica (por ejemplo <0,1) e incluye otros estabilizadores tales como azúcares y aminoácidos, preferentemente sacarosa y glicina. La formulación puede incluir de 0 a 0,9% en peso de NaCl. La composición es libre de albúmina y la formulación en forma liofilizada puede reconstituirse rápidamente (< 1 minuto) con agua. La composición se solubiliza en condiciones fisiológicamente aceptables de pH, preferentemente en un pH que varía de aproximadamente 5,0 a aproximadamente 6,5, sin utilizar tensioactivos tales como dodecil sulfato de sodio. La solución reconstituida está ceca de la isotonicidad y puede administrarse...
Reivindicaciones:
1. Una composición farmacéutica liofilizada estable que comprende una muteína de interleuquina-2 (IL-2) humana estabilizada con histidina, en la que la muteína de IL-2 posee una única sustitución de aminoácido: N88R.
2. Una composición farmacéutica en forma acuosa estable que comprende una muteína de interleuquina-2 humana estabilizada con histidina, en la que la muteína de IL-2 posee una única sustitución de aminoácido N88R, que posee un pH que varía desde aproximadamente 5,0 a aproximadamente 6,5.
3. La composición de la reivindicación 1 o 2 que incluye glicina.
4. La composición de la reivindicación 1 o 2 que incluye sacarosa.
5. La composición de la reivindicación 1 o 2 que incluye glicina y sacarosa.
6. Una composición liofilizada estable que, tras la reconstitución acuosa, comprende lo siguiente:
en la que IL-2 es una muteína que posee una única sustitución de aminoácido: N88R.
Patentes similares o relacionadas:
PROCEDIMIENTO PARA EL CONTROL DEL COLESTEROL CON UNA MEZCLA DE CITOCINA LIBRE DE SUERO Y LIBRE DE MITÓGENOS, del 3 de Noviembre de 2011, de CEL-SCI CORPORATION: Mezcla de citocina libre de suero y de mitógenos compuesta de proporciones específicas de citocinas seleccionadas de entre el grupo de IL-1β, TNF-α, […]
COMBINACIÓN DE UNA PROTEÍNA DE FUSIÓN ENTRE UN ANTICUERPO CONTRA EL DOMINIO EDB DE LA FIBRONECTINA E IL2 CON UNA PEQUEÑA MOLÉCULA ADICIONAL, del 16 de Febrero de 2011, de PHILOGEN S.P.A.: Una combinacion que comprende al menos (i) una proteina de fusion y (ii) gemcitabina, en la que la proteina de fusion comprende una parte de anticuerpo que reconoce especificamente […]
PROCEDIMIENTO DE TERAPIA PARA CANCERES QUE EXPRESAN EL ANTIGENO CD40, del 22 de Octubre de 2010, de NOVARTIS VACCINES AND DIAGNOSTICS, INC.: Un anticuerpo anti CD40 o un fragmento de unión a antígeno del mismo, para usar en un procedimiento de tratar a un sujeto humano de un cáncer […]
TRATAMIENTO DEL CARCINOMA RENAL METASTATICO, del 28 de Mayo de 2010, de ED GEISTLICH SIHNE AG FUR CHEMISCHE INDUSTRIE: Utilización de interleuquina-2 y taurolidina en la fabricación de una preparación combinada destinada al tratamiento simultáneo, separado o secuencial […]
 PROCEDIMIENTO PARA PREPARAR ALDESLEUKINA PARA USO FARMACEUTICO, del 22 de Marzo de 2010, de CHIRON CORPORATION: Un procedimiento para preparar aldesleukina para uso farmacéutico, que comprende las etapas de (a) añadir SDS a una composición que comprende aldesleukina, para […]
PROCEDIMIENTO PARA PREPARAR ALDESLEUKINA PARA USO FARMACEUTICO, del 22 de Marzo de 2010, de CHIRON CORPORATION: Un procedimiento para preparar aldesleukina para uso farmacéutico, que comprende las etapas de (a) añadir SDS a una composición que comprende aldesleukina, para […]
ANTICUERPOS MONOCLONALES ANTI-CD40 ANTAGONISTAS Y PROCEDIMIENTOS PARA SU USO, del 3 de Marzo de 2010, de NOVARTIS VACCINES AND DIAGNOSTICS, INC.: Un anticuerpo monoclonal humano que es capaz de unirse específicamente a un antígeno CD40 humano expresado en la superficie de una célula humana que expresa CD40, […]
METODOS PARA TRATAR UNA LEUCEMIA, del 22 de Febrero de 2010, de SHIRE BIOCHEM INC.: Uso de un compuesto de la fórmula I para la producción de un medicamento destinado al tratamiento de una leucemia mielógena crónica o de una leucemia mielógena […]
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]