FORMULAS FARMACEUTICAS PARA HORMONAS TIROIDEAS Y PROCEDIMIENTOS PARA SU OBTENCION.
Composición farmacéutica de hormonas tiroideas, de preferencia de T3 y/o T4 o sus sales,
en una concentración farmacéuticamente efectiva, en la gama de 0,001-1% en peso, como una matriz uniforme de cápsula blanda que puede ser tomada por boca sin masticar, en donde la matriz tiene la forma y dimensiones de un comprimido o cápsula, comprendiendo la composición farmacéutica, en el estado seco, 30%-68% en peso de gelatina de origen bovino, porcino o pescado, y caracterizada porque comprende, en el estado seco, 31-60% en peso de glicerol y 1-10% en peso de agua
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E03029729.
Solicitante: ALTERGON S.A..
Nacionalidad solicitante: Suiza.
Dirección: VIA DOGANA VECCHIA, 2,CH-6900 LUGANO.
Inventor/es: GARAVANI, ALBERTO, MARCHIORRI, MAURIZIO, DI MARTINO, ALESSANDRO, MATEO,ANGEL.
Fecha de Publicación: .
Fecha Solicitud PCT: 23 de Diciembre de 2003.
Fecha Concesión Europea: 11 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- A61K9/20H6H
- A61K9/20P
Clasificación PCT:
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/48 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Preparaciones en cápsulas, p. ej. de gelatina, de chocolate.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Fórmulas farmacéuticas para hormonas tiroideas y procedimientos para su obtención.
Campo del invento
El presente invento se refiere a la formulación farmacéutica para hormonas tiroideas y procedimientos para su obtención.
Arte anterior
T3 y T4 son hormonas tiroideas y se utilizan para varias aplicaciones terapéuticas. La T3 (liotironina = O-(4-hidroxi-3-yodofenil)-3,5-diyodo-L-tiroxina) y la T4 (levo-tiroxina o levotiroxina = O-(4-hidroxi-3,5-diyodofenil)-3,5-diyodo-L-tiroxina), tal cual o en forma de sales sódica o hidrato son ampliamente conocidas y obtenidas mediante síntesis y/o extracción de glándulas animales (por ejemplo: cerdo, etc.).
En particular estas hormonas tiroideas tienen dos funciones importantes: intervienen en el desarrollo, especialmente en el sistema nervioso central y actúan en el adulto manteniendo la homeostasis metabólica e influenciando virtualmente la función de todos los órganos. Las concentraciones en el suero de las hormonas tiroideas están precisamente reguladas por la tirotropina hormonal con un sistema de realimentación negativo clásico. Sin embargo, el tratamiento de la carencia de estas hormonas proporciona resultados satisfactorios con la administración de T3 y T4 (o de sus sales sódicas respectivas) y la mayoría de pacientes pueden tratarse con su administración.
En particular, T3 y T4 se utilizan sobre todo en el tratamiento de hipotiroidismo. El hipotiroidismo es una dolencia muy común. En los Estados Unidos, 1 recién nacido de 4000-5000 tiene hipotiroidismo, mientras que el hipertiroidismo aparece mas tarde en 0,5-1,3 por ciento de adultos. En la población que supera los sesenta, la incidencia del hipotiroidismo aumenta, alcanzando el 2,7 por ciento en el hombre y el 7,1 por ciento en la mujer. Debido a que el hipotiroidismo congénito puede resultar en el retardo mental irreversible, el cual puede no obstante prevenirse mediante diagnosis y tratamiento en sus etapas iniciales, la exploración de esta condición en el recién nacido es obligatoria en América del Norte, Europa y Japón.
Así como para el tratamiento del hipotiroidismo, por ejemplo, la T4 (sal sódica de levotiroxina) puede utilizarse para suprimir la secreción de tirotropina en el tratamiento de bocio no endémico simple, de tiroiditis linfocíclica y de cáncer de tiroide. La sal sódica de levotiroxina se utiliza también junto con agentes antitiroideos en el tratamiento de tirotoxicosis para prevenir el inicio de bocio e hipotiroidismo.
Con frecuencia la terapia de suplementar con hormonas tiroideas continua a través de la vida del paciente. Además la dosificación debe establecerse individualmente para cada paciente. En general la dosis inicial es pequeña. La cantidad se aumenta luego gradualmente hasta la determinación clínica y pruebas de laboratorio indican que se recibe una respuesta óptima en el organismo tratado. Luego se mantiene la dosis necesaria para obtener esta respuesta. La edad y condición física general del paciente y la severidad y duración de los síntomas de hipotiroidismo determinan la dosis inicial y la rapidez con la que puede llevarse la dosis a su nivel definitivo. Es particularmente importante aumentar la dosis solo muy gradualmente en pacientes con mixedema o con enfermedades cardiovasculares para impedir el inicio de angina, infarto de miocardio o ictus.
Por estos motivos la T3 y T4, sus respectivas sales sódicas y su combinación (Liotrix), se han administrado siempre por la boca, en particular en forma de comprimidos que, mediante la comprobación de la frecuencia con la que se toman y elección de las unidades dosificadas, permite adaptar el suplemento a la situación individual del paciente.
En efecto, la dosificación precisa es extremadamente crítica puesto que la infradosificación conduciría a una respuesta menos que óptima y por consiguiente al hipotiroidismo. Por otra parte, la dosificación excesiva conduciría a manifestaciones tóxicas del hipertiroidismo tal como, por ejemplo, dolor cardiaco, palpitaciones o arritmia cardiaca. En pacientes que sufren de enfermedades coronarias aún un aumento mínimo de la dosis de levotiroxina puede ser peligrosa.
El hipertiroidismo es también un factor de riesgo bien conocido para la osteoporosis. Para minimizar el riesgo de osteoporosis se recomienda, por consiguiente, calcular la dosis de forma tan precisa como sea posible hasta que se obtiene la dosis mínima efectiva.
Por tanto, debido a los riesgos asociados con la sobredosis o infradosis, no solo de la sal sódica de levotiroxina, sino de las hormonas tiroideas en general, es absolutamente crítico que los pacientes puedan atenerse a productos farmacéuticos que sean fiables en términos de titulación y bio-disponibilidad. Por consiguiente presenta considerable dificultad alcanzar y sobre todo mantener estos criterios particularmente estrictos.
Por ejemplo, entre 1987 y 1994 la United States Food and Drug Administration ("FDA") recibió 58 informes de experiencias irregulares asociadas con la potencia (título) de productos de levotiroxina sódica administrados por la boca. 47 de estos informes sugirieron que el título de los preparados farmacéuticos fue inferior que el valor declarado, mientras que 9 sugirieron que el título fue superior. Dos de los informes trataron de inconsistencias en el nivel de sangre de las hormonas tiroideas. Cuatro de los informes resultaron en hospitalización, siendo 2 de estos atribuidos a infradosis y los otros 2 a sobredosis. Mas de la mitad del total de 58 informes estuvieron respaldados por pruebas de sangre de la función tiroide. Entre los síntomas específicos de hipotiroidismo se registraron los siguientes: depresión severa, fatiga, aumento de peso, estreñimiendo, intolerancia al frío, edema, y dificultad en la concentración. Los síntomas específicos de hipertiroidismo incluyeron fibrilación atrial, palpitación del corazón e insomnio.
Si bien aparecieron algunos problemas en el momento del cambio de la marca del producto farmacéutico, muchos de los problemas también aparecieron cuando los pacientes solo tomaron cantidades adicionales de un producto que ya les había sido administrado durante un periodo prolongado y que había dado previamente tratamiento satisfactorio, indicando pobre consistencia en términos de estabilidad, título y bio-disponibilidad entre las partidas diferentes del mismo fabricante.
Si bien es claro que las hormonas tiroideas, en particular las T3, T4 y una combinación de las dos, representa medicaciones necesarias en muchos casos en donde no existen sustitutos aceptables, existe no obstante el problema de que -en vista del índice terapéutico muy estricto al que se somete la dosificación de hormonas tiroideas- es particularmente importante que la cantidad de principio activo disponible sea absolutamente fiable para una unidad dada de dosificación farmacéutica.
En vista de las dificultades encontradas con las formulas tradicionales, se conoce desde hace algún tiempo que es necesario obtener formulas farmacéuticas para la administración de hormonas tiroideas, particularmente de TG3 o T4 y la combinación de ambas, de preferencia por la boca, que sean mas fiables en términos de titulo y biodisponibilidad. En particular, durante algún tiempo ha sido necesario obtener fórmulas farmacéuticas para la administración preferentemente oral de hormonas tiroideas, en particular T3 o T4 y la combinación de las dos, que permanezca estable con el tiempo, o sea que tenga una vida de almacenamiento efectiva de por lo menos dos años. Además es necesario obtener fórmulas farmacéuticas para la administración de hormonas tiroideas, particularmente de T3 o T4 y la combinación de las dos, que haga posible la obtención de dosificación perfectamente uniforme, no solo independientemente de la partida de producción, sino de preferencia también dentro de la misma unidad de dosificación farmacéutica.
La GB 1180574 describe una composición farmacéutica acuosa inyectable que comprende tiroxina como el ingrediente activo junto con gluconato cálcico y un complejo macroaniónico de vitamina B 12 y gelatina, estando presente por lo menos cinco veces el peso de tiroxina del complejo y por lo menos veinte veces el peso de tiroxina de gluconato cálcico.
Por consiguiente el presente invento tiene por objeto satisfacer estas y otras necesidades que resultarán claras a partir de la descripción detallada que sigue.
Sumario
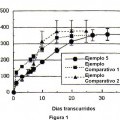
De conformidad con un primer aspecto del presente invento se ha encontrado que las desventajas del arte anterior pueden superarse proporcionando...
Reivindicaciones:
1. Composición farmacéutica de hormonas tiroideas, de preferencia de T3 y/o T4 o sus sales, en una concentración farmacéuticamente efectiva, en la gama de 0,001-1% en peso, como una matriz uniforme de cápsula blanda que puede ser tomada por boca sin masticar, en donde la matriz tiene la forma y dimensiones de un comprimido o cápsula, comprendiendo la composición farmacéutica, en el estado seco, 30%-68% en peso de gelatina de origen bovino, porcino o pescado, y caracterizada porque comprende, en el estado seco, 31-60% en peso de glicerol y 1-10% en peso de agua.
2. Composición farmacéutica, de conformidad con la reivindicación 1, caracterizada porque comprende, en el estado seco, 32-55% en peso de glicerol y 1-10% en peso de agua.
3. Composición farmacéutica, de conformidad con la reivindicación 2, caracterizada porque comprende, en el estado seco, 32,5%-50% en peso de glicerol y 1-10% en peso de agua.
4. Composición farmacéutica, de conformidad con la reivindicación 1, 2 o 3, en donde la gelatina tiene un pH entre 3 y 10.
5. Composición farmacéutica, de conformidad con una o mas de las reivindicaciones precedentes, caracterizada porque comprende de 0,5-5% en peso de etanol.
6. Composición farmacéutica, de conformidad con una o mas de las reivindicaciones precedentes, caracterizada porque comprende, en estado seco, 3-10% en peso de otros alcoholes polihidroxi o poliéter, de preferencia elegidos del grupo que comprende sorbitol/sorbitanos, 1,2-propilenglicol, polietilenglicoles y manitol o sus mezclas.
7. Composición farmacéutica, de conformidad con una o mas de las reivindicaciones precedentes, caracterizada porque comprende excipientes, por ejemplo aditivos sólidos que modifican las características de la liberación de hormonas tiroideas de la matriz uniforme de cápsula blanda, o conservantes y/o agentes colorantes.
8. Composición farmacéutica, de conformidad con una o mas de las reivindicaciones precedentes, provista en el exterior con capas entéricas y/o capas para facilitar la ingestión.
9. Un método para obtener composiciones farmacéuticas como en la reivindicación 1, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 10-50% en peso de glicerol, 0-10% en peso de etanol, 20-80% en peso de agua y 0,001-1% en peso de T3 y/o T4 o sus sales,
fusión de la mezcla gelatinosa medicada a una temperatura entre 30 y 55ºC, de preferencia entre 35 y 45ºC,
alimentación de la mezcla gelatinosa medicada en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
cortado y toma de la composición famacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
10. Un método para obtener composiciones farmacéuticas como en la reivindicación 1, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 5-45% en peso de glicerol, 0-10% en peso de etanol, 20-60% en peso de agua,
fusión de la mezcla gelatinosa a una temperatura entre 30 y 80ºC, de preferencia entre 40 y 65ºC,
cuando está completamente fundida, rebajar la temperatura de la mezcla gelatinosa hasta 45 +/-5ºC y
adición de una mezcla medicada que comprende T3 y/o T4 o sus sales según se requiera y glicerol, correspondiendo la cantidad de la mezcla medicada al 5%-10% en peso de la mezcla gelatinosa,
obtención de una mezcla gelatinosa medicada,
alimentación la mezcla gelatinosa medicada en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
cortado y toma de la composición famacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
11. Un método para obtener composiciones farmacéuticas como en la reivindicación 1, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 10-50% en peso de glicerol, 0-10% en peso de etanol y 20-80% en peso de agua,
fusión de la mezcla gelatinosa a una temperatura entre 30 y 80ºC, de preferencia entre 40 y 65ºC,
alimentación de la mezcla gelatinosa en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
inyección, en el momento de cierre de la cavidad, por medio del inyector especial, de una cantidad de material medicado correspondiente a 1% a 50% en peso, de preferencia de 5-30% en peso de la cantidad de mezcla gelatinosa dispuesta en la cavidad para permitir la difusión uniforme de dicho material inyectado medicado en la matriz sin alterar la estructura monofase, comprendiendo dicho material inyectado medicado
30-95% en peso de glicerol,
0-50% en peso de etanol,
0-50% en peso de agua,
0-50% en peso de gelatina,
tanto como sea necesario en peso de T3 y T4,
cortado y toma de la composición farmacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
12. Un método según la reivindicación 11, en donde la sustancia inyectada medicada comprende 50-90% en peso de glicerol, 0%-30% en peso de etanol, 0%-45% en peso de agua, 5%-20% en peso de gelatina y tanto como sea necesario en peso de T3 y/o T4.
13. Composición farmacéutica de hormonas tiroideas, de preferencia de T y/o T4 o sus sales, en una concentración farmacéuticamente eficaz, de preferencia 0,001-1% en peso, en una matriz uniforme de cápsula blanda que puede tomarse por boca sin masticar, en donde la matriz tiene la forma y dimensiones de un comprimido o cápsula, comprendiendo la composición farmacéutica, en el estado seco, 30%-70% en peso de gelatina de origen bovino, porcino o pescado, y caracterizada porque comprende, en estado seco, 20-60% en peso de sorbitol/sorbitanos, y 1-10% en peso de agua.
14. Composición farmacéutica de conformidad con la reivindicación 13, caracterizada porque comprende, en el estado seco, 25-55% en peso de sorbitol/sorbitanos y 1-10% en peso de agua.
15. Composición farmacéutica de conformidad con la reivindicación 14, caracterizada porque comprende, en el estado seco, 25-50% en peso de sorbitol/sorbitanos y 1-10% en peso de agua.
16. Composición farmacéutica de conformidad con la reivindicación 13-15, en donde la gelatina tiene un pH entre 3 y 10.
17. Composición farmacéutica de conformidad con una o mas de las reivindicaciones 13-16, caracterizada porque comprende 0,5-5% en peso de etanol.
18. Composición farmacéutica de conformidad con una o mas de las reivindicaciones 13-17, caracterizada porque comprende en estado seco 1-10% en peso de otros alcoholes polihidroxi o poliéter, de preferencia elegidos del grupo que comprende glicerol, 1,2-propilenglicol, polietilenglicoles y manitol o sus mezclas.
19. Composición farmacéutica de conformidad con una o mas de las reivindicaciones 13-18, caracterizada porque comprende excipientes, por ejemplo aditivos sólidos que modifican las características de la liberación de hormonas tiroideas de la matriz uniforme de cápsula blanda, o conservantes y/o agentes colorantes.
20. Composición farmacéutica, de conformidad con una o mas de las reivindicaciones 13-19, provista en el exterior con capas entéricas y/o capas para facilitar la ingestión.
21. Un método para obtener composiciones farmacéuticas como en la reivindicación 13, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa medicada que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 10-50% en peso de solución de
sorbitol/sorbitanos, 0-10% en peso de etanol, 20-80% en peso de agua y 0,001-1% en peso de T3 y/o T4 o sus sales,
fusión de la mezcla gelatinosa a una temperatura entre 30 y 55ºC, de preferencia entre 35 y 45ºC,
alimentación de la mezcla gelatinosa medicada en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
cortado y toma de la composición famacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
22. Un método para obtener composiciones farmacéuticas como en la reivindicación 1, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 10-50% en peso de solución de sorbitol/sorbitanos,
0-10% en peso de etanol, 20-60% en peso de agua,
fusión de la mezcla gelatinosa a una temperatura entre 30 y 80ºC, de preferencia entre 40 y 65ºC,
cuando está completamente fundida, rebajar la temperatura de la mezcla gelatinosa hasta 45 +/-5ºC y
adición de una mezcla medicada que comprende T3 y/o T4 o sus sales según se requiera y glicerol, correspondiendo la cantidad de la mezcla medicada al 1%-5% en peso de la mezcla gelatinosa,
obtención de una mezcla gelatinosa medicada,
alimentación la mezcla gelatinosa medicada en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
cortado y toma de la composición famacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
23. Un método para obtener composiciones farmacéuticas como en la reivindicación 13, que comprende las etapas siguientes:
preparación de una mezcla gelatinosa que comprende 10-50% en peso de gelatina tipo A o B de origen bovino, porcino o pescado, 10-50% en peso de solución de sorbitol/sorbitanos, 0-10% en peso de etanol y 20-80% en peso de agua, fusión de la mezcla gelatinosa a una temperatura entre 30 y 80ºC, de preferencia entre 40 y 65ºC,
alimentación de la mezcla gelatinosa en las cavidades de los cilindros de conformado de una máquina tipo "Rotary Die" para formar cápsulas,
inyección, en el momento de cierre de la cavidad, por medio del inyector especial, de una cantidad de material inyectado medicado correspondiente a 1-30% en peso, de preferencia a 5-15% en peso de la cantidad de mezcla gelatinosa dispuesta en la cavidad para permitir la difusión uniforme de dicho material inyectado medicado en la matriz sin alterar la estructura monofase,
comprendiendo dicho material inyectado medicado
25-95% en peso de glicerol,
0-50% en peso de etanol,
0-50% en peso de agua,
0-50% en peso de gelatina, tanto como sea necesario en peso de T3 y T4,
cortado y toma de la composición farmacéutica en una matriz uniforme de cápsula blanda así formada a partir de la máquina "Rotary Die", y
secado de la composición farmacéutica en una matriz uniforme de cápsula blanda.
24. Un método según la reivindicación 11, en donde la sustancia inyectada medicada comprende 50-90% en peso de glicerol, 0%-30% en peso de etanol, 5%-45% en peso de agua, 0%-20% en peso de gelatina y tanto como sea necesario en peso de T3 y/o T4.
Patentes similares o relacionadas:
TOXINA BOTULINICA PARA TRATAR ULCERAS PEPTICAS Y LA ENFERMEDAD DE REFLUJO GASTROESOFAGICO, del 30 de Abril de 2010, de ALLERGAN, INC.: Uso de una toxina botulínica para la fabricación de un medicamento para tratar una úlcera péptica, con la condición de que la toxina no sea toxina botulínica tipo […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE UN VECTOR FARMACÉUTICO, del 1 de Abril de 1961, de MERCK & COMPANY INCORPORATED: Procedimiento para la preparación de un vector farmacéutico conveniente para administración oral, que comprende polimerizar la gelatina hidrolizada con alrededor […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE UNA FORMA DE DOSIFICACIÓN SÓLIDA A PRUEBA DE ABUSO, del 10 de Noviembre de 2011, de GRUNENTHAL GMBH: Procedimiento para la preparación de una forma de dosificación sólida a prueba de abuso que contiene al menos un principio activo susceptible de abuso […]
FORMAS FARMACÉUTICAS SÓLIDAS DE DESINTEGRACIÓN RÁPIDA QUE NO SON FRIABLES Y QUE COMPRENDEN PULULANO, del 20 de Septiembre de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una forma farmacéutica sólida que comprende: (a) al menos un agente tensioactivo que tiene un tamaño de partículas promedio eficaz, antes de la inclusión en la […]
FORMULACIONES SÓLIDAS DE OSPEMIFENO, del 19 de Septiembre de 2011, de HORMOS MEDICAL LTD.: Una formulación sólida de un fármaco, que comprende granulados que contienen 30 a 90 mg de ospemifeno o una de sus sales farmacéuticamente aceptables en combinación con una […]
FORMAS DE DOSIFICACIÓN FARMACÉUTICAS ORALES RESISTENTES A MANIPULACIONES QUE INCLUYE UN ANALGÉSICO OPIOIDE, del 21 de Junio de 2011, de PURDUE PHARMA LP: Forma posológica farmacéutica oral sólida de liberación prolongada que comprende una formulación de matriz de liberación prolongada, comprendiendo la formulación […]
 SISTEMA DE LIBERACIÓN DE FÁRMACO DEL TIPO POLÍMERO BIODEGRADABLE, del 9 de Mayo de 2011, de SENJU PHARMACEUTICAL CO., LTD. TOJO, KAKUJI: Un método para la producción de un sistema de liberación de un fármaco basado en un polímero biodegradable que comprende los pasos: 220ºC, […]
SISTEMA DE LIBERACIÓN DE FÁRMACO DEL TIPO POLÍMERO BIODEGRADABLE, del 9 de Mayo de 2011, de SENJU PHARMACEUTICAL CO., LTD. TOJO, KAKUJI: Un método para la producción de un sistema de liberación de un fármaco basado en un polímero biodegradable que comprende los pasos: 220ºC, […]
 FORMAS FARMACÉUTICAS DE DOSIFICACIÓN ORAL RESISTENTES A LA MANIPULACIÓN INDEBIDA QUE COMPRENDEN UN ANALGÉSICO OPIOIDE, del 5 de Mayo de 2011, de PURDUE PHARMA LP: Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial […]
FORMAS FARMACÉUTICAS DE DOSIFICACIÓN ORAL RESISTENTES A LA MANIPULACIÓN INDEBIDA QUE COMPRENDEN UN ANALGÉSICO OPIOIDE, del 5 de Mayo de 2011, de PURDUE PHARMA LP: Forma farmacéutica sólida de dosificación oral y liberación prolongada que comprende una formulación matricial de liberación prolongada, comprendiendo la formulación matricial […]