FORMULACION PARA LA DOSIFICACION DE MATERIAS EN POLVO, ESTABLE, PARA INHALACION.
Una insuflación, para la administración de un fármaco, al interior de la cavidad corporal,
la cual consiste en una cantidad que va de un 0,1% a un 3%, en peso, de una materia en polvo de bromuro de ipratropio, sulfato de albuterol o bromuro de tiotropio, conjuntamente con un soporte, en donde, el soporte, es una materia en polvo finamente dividida, consistente en celobiosa
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US02/18406.
Solicitante: BOEHRINGER INGELHEIM PHARMACEUTICALS INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 900 RIDGEBURY ROAD, P.O. BOX 368,RIDGEFIELD, CONNECTICUT 06877-.
Inventor/es: ETZLER,FRANK M.,BOEHRINGER INGELHEIM CORP.
Fecha de Publicación: .
Fecha Concesión Europea: 3 de Marzo de 2010.
Clasificación PCT:
- A61K47/26 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K9/72 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › para fumar o inhalar.
Clasificación antigua:
Fragmento de la descripción:
Formulación para la dosificación de materias en polvo, estable, para inhalación.
La presente invención, se refiere a una formulación farmacéutica en polvo, la cual puede utilizarse como vehículo soporte, para la administración de fármacos. La formulación farmacéutica en polvo de la presente invención, está particularmente adaptada para la administración como una insuflación, al interior de la cavidad corporal. De una forma específica, tal tipo de formulación, puede utilizarse en inhaladores de materias en polvo, secas, para la distribución en los pulmones. Los ejemplos de fármacos para la distribución pulmonar, son el sulfato de albuterol, el bromuro de ipratropio, y el bromuro de tiotropio. No obstante, pueden incorporarse otros fármacos, en la formulación de la presente invención.
Las cápsulas, se utilizan, frecuentemente, como medio de almacenaje para materias en polvo farmacéuticas, finamente divididas, que comprenden el fármaco activo que se suministra a un paciente, vía inhalación. Así, por ejemplo, con objeto de evitar el uso de gases propulsores, algunos de los cuales (clorofluorocarbonos ó CFCs) se han visto implicados en el daño medioambiental (agotamiento de la capa de ozono en la atmósfera), se emplazan materias en polvo, secas, que comprenden un constituyente de fármaco activo, en el interior de la cápsula. La cápsula, se carga en el interior de un inhalador de materia en polvo, seca (DPI-[del inglés, dry powder inhaler]-) y, el inhalador, se utiliza para administrar el producto del fármaco. Generalmente, tales tipos de dispositivos, cortan o perforan las cápsulas que comprenden la materia en polvo, previamente a la administración y, entonces, se inhala la materia en polvo, por parte del paciente.
Las cápsulas, consisten, usualmente, en dos (2) mitades, las cuales se suministran, usualmente, por parte de los fabricantes de las cápsulas, en un estado ensamblado (cerrado) pero no bloqueado. Durante el llenado de la cápsula, las dos mitades, se separan, se llenan con la formulación farmacéutica en polvo que comprende el fármaco activo y, a continuación, se cierran y se bloquean, para la inserción en el interior del DPI. A menudo, la cápsula, es una cápsula de gelatina dura. Se utilizan, también, la celulosa dura y las cápsulas plásticas apropiadas para almacenar las materias en polvo farmacéuticas. Tales tipos de cápsulas, se encuentran disponibles en mercado, de procedencia de las firma Capsugel (Bélgica), Su-Heung (Corea del Sur) y Elamco (Estados Unidos de América), entre otros fabri- cantes.
Allí en donde, el fármaco activo, en la formulación farmacéutica en polvo, deba administrarse a la parte superior del tracto respiratorio (es decir, intranasalmente), las partículas del fármaco activo, deberían ser de un tamaño correspondiente a un valor comprendido dentro de unos márgenes que van desde aproximadamente 20 hasta aproximadamente 100 micrómetros. Allí en donde, la administración del fármaco activo, deba administrarse al tracto respiratorio inferior (es decir, intrapulmonarmente), las partículas del fármaco activo, serán, de una forma preferible, de un tamaño inferior a aproximadamente 5 micrómetros.
Tales tipos de tamaño tan reducidos, presentan problemas de manipulación (es decir, el llenado de las cápsulas durante la fabricación), de tal forma que, el fármaco activo, se mezcla, usualmente, con un soporte tosco. El soporte es, de una forma típica, una hexosa soluble, tal como la glucosa o la lactosa, o manitol. El soporte, funciona, también, como un agente masificante (que proporciona un mayor volumen), para un fármaco activo que tenga un reducido régimen de dosificación. Véase, por ejemplo, la patente estadounidense US 5.254.335. Adicionalmente, además, muchos fármacos utilizados en la terapia de inhalación, a pesar de todo, se proporcionan en reducidas dosis, es decir, en dosis correspondientes a un valor inferior a aproximadamente 250 mg y, así, de este modo, de una forma rutinaria, se utilizan agentes masificantes (que proporcionan un mayor volumen).
El bromuro de ipratropio, es un fármaco activo, el cual se administra, de una forma típica, vía inhalación. Éste presenta problemas paras su uso en DPIs (Inhaladores de materias en polvo), puesto que, la cantidad a ser administrada, es muy pequeña (<50 microgramos). Correspondientemente en concordancia, el bromuro de ipratropio, debe mezclarse con un agente masificante, tal como la lactosa o la glucosa, para la administración vía DPIs.
Las hexosas solubles utilizadas como soportes, para los fármacos inhalables, no son tóxicas, y tienden a ser estables, en presencia de las substancia activa del fármaco. No obstante, las hexosas solubles, tienden a ser higroscópicas, y requieren un envasado especial, con objeto de prevenir el que, la humedad, entre en contacto con la formulación en polvo, y que, con ello, se provoque el hecho de que, la formulación, se convierta en inutilizable, debido a las aglomeraciones y a la formación de grumos.
Breve resumen de la invención
El solicitante, ha descubierto el hecho de que, ciertos materiales en polvo, farmacéuticamente aceptables, tienen una sensibilidad reducida a la humedad, pero que también tienen e requisito de biocompatibilidad, el cual permite el uso de estos materiales en polvo, farmacéuticamente aceptables, como un vehículo para la formulación de una insuflación.
La presente invención, proporciona una insuflación, para la administración de un fármaco, al interior de la cavidad corporal. La forma de dosificación, comprende una cantidad efectiva de un fármaco, el cual es activo cuando se administra como una insuflación, y un soporte en polvo, el cual es una materia en polvo finamente dividida, consistente en celobiosa.
Correspondientemente en concordancia, es un objeto primario de la presente invención, el proporcionar una nueva formulación de un fármaco, en polvo, el cual pueda administrarse como una insuflación.
Es también un objeto de la presente invención, el proporcionar una composición estable de un fármaco, de flujo libre (suelta), la cual resista el efecto de la humedad y de la alta humedad, y que pueda dispensarse como una insuflación.
Es también un objeto de la presente invención, el proporcionar un procedimiento para la administración de una fármaco, en una formulación en polvo, el cual permita la administración del fármaco como una insuflación.
Estos otros objetos de la invención, resultarán evidentes, a partir de la especificación que se presenta en la parte restante de esta solicitud de patente.
Descripción resumida de los dibujos
La figura 1, es un gráfico de las tasas relativas de sinterización de la celobiosa tamizada, la celobiosa molida y la lactosa, bajo unas condiciones correspondientes a un porcentaje del 85% de humedad relativa.
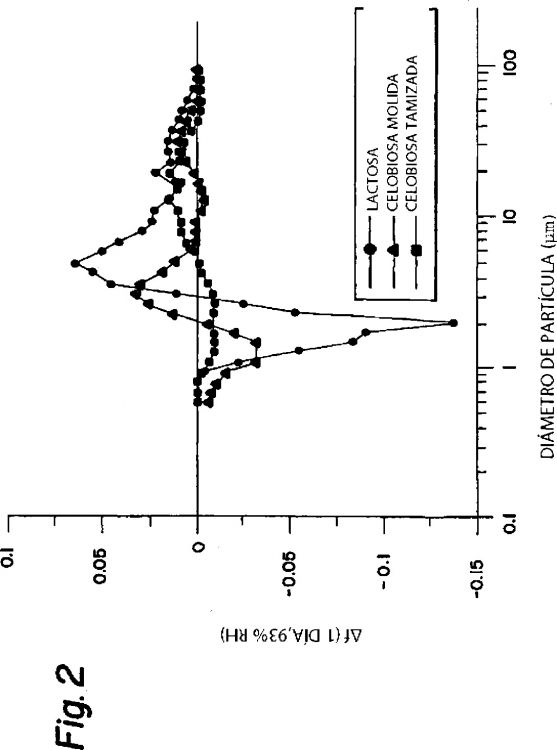
La figura 2, es un gráfico de las tasas relativas de sinterización de la celobiosa tamizada, la celobiosa molida y la lactosa, bajo unas condiciones correspondientes a un porcentaje del 93% de humedad relativa.
Descripción detallada de la invención
Las prestaciones técnicas de las cápsulas de inhalación en polvo, se consiguen mediante un gran número de factores. Entre tales tipos de factores, se conoce el hecho de que, la exposición a la alta humedad (>60% RH-[RH = humedad relativa-(del inglés, Relative Humidity)-]-), reduce la masa respirable. La celobiosa, es una alternativa a la lactosa, en las formulaciones de materias farmacéuticas en polvo para la inhalación, debido a su reducida tasa de sinterización en alta humedad. La celobiosa, es un disacárido, con una estructura muy similar a la de la lactosa.
En el trabajo que se presenta a continuación, se procedió a comparar una formulación que contenía celobiosa, con una formulación que contenía lactosa, utilizando la clasificación del tamaño de partícula y las mediciones de la retención de las cápsulas. Las distribuciones del tamaño de partícula de la celobiosa, la lactosa, una mezcla de lactosa/bromuro de ipratropio y una mezcla de celobiosa/bromuro de ipratropio, se midieron utilizando el clasificador de medición del tamaño del tipo Aerosizer (de la firma Amhserst Processing Instruments). Las distribuciones del tamaño de partícula de las mezclas de celobiosa ó lactosa con bromuro de ipratropio, se midieron utilizando el producto Aerobreather, fabricado por la firma Amhserst Processing Instruments, un dispositivo utilizado para medir la distribución del tamaño de partícula de las partículas inhaladas. La retención en las...
Reivindicaciones:
1. Una insuflación, para la administración de un fármaco, al interior de la cavidad corporal, la cual consiste en una cantidad que va de un 0,1% a un 3%, en peso, de una materia en polvo de bromuro de ipratropio, sulfato de albuterol o bromuro de tiotropio, conjuntamente con un soporte, en donde, el soporte, es una materia en polvo finamente dividida, consistente en celobiosa.
2. La insuflación, según se reivindica en la reivindicación 1, en donde, la celobiosa, es mayor de 1 µm y menor de 5 µm, en diámetro.
3. La insuflación, para la administración de un fármaco, al interior de la cavidad corporal, la cual consiste en una cantidad que va de un 0,1% a un 3%, en peso, de una materia en polvo de bromuro de ipratropio, conjuntamente con un soporte, en donde, el soporte, es celobiosa finamente dividida en forma de materia en polvo.
4. La insuflación, según se reivindica en la reivindicación 3, en donde, la celobiosa, es mayor de 1 µm y menor de 5 µm, en diámetro.
5. La insuflación, para la administración de un fármaco, al interior de la cavidad corporal, la cual consiste en una cantidad que va de un 0,1% a un 3%, en peso, de una materia en polvo de bromuro de ipratropio, conjuntamente con un soporte, en donde, el soporte, es celobiosa finamente dividida en forma de materia en polvo.
6. La insuflación, según se reivindica en la reivindicación 5, en donde, la celobiosa, es mayor de 1 µm y menor de 5 µm, en diámetro.
Patentes similares o relacionadas:
Método para preparar composiciones de inhalación de polvo seco, del 5 de Febrero de 2020, de ORION CORPORATION: Un método para preparar una composición de inhalación de polvo seco que comprende un primer y un segundo principios activos en forma micronizada que comprende […]
Matriz para liberación sostenida, invariable e independiente de compuestos activos, del 27 de Noviembre de 2019, de EURO-CELTIQUE S.A.: Una formulación farmacéutica que comprende una matriz, en la que dicha matriz comprende oxicodona o una sal farmacéuticamente aceptable de la misma, naloxona […]
Composición farmacéutica que contiene oxicodona y naloxona, del 27 de Noviembre de 2019, de Mundipharma Pharmaceuticals S.L: Preparaciones farmacéuticas orales, en las que cada preparación comprende como los activos clorhidrato de oxicodona y clorhidrato de naloxona, […]
Formulación superfina de formoterol, del 11 de Septiembre de 2019, de CHIESI FARMACEUTICI S.P.A.: Una formulación farmacéutica en aerosol para su administración mediante un inhalador presurizado de dosis medida, que comprende como ingredientes activos fumarato […]
Formulación superfina de formoterol, del 24 de Julio de 2019, de CHIESI FARMACEUTICI S.P.A.: Una formulación farmacéutica de aerosol para su administración mediante un inhalador presurizado de dosis medida, que comprende como ingrediente activo fumarato de (R,R)-(±)-formoterol […]
Formulaciones terapéuticas sostenidas inhalables, del 2 de Julio de 2019, de Civitas Therapeutics, Inc. (100.0%): Partículas no poliméricas para la administración pulmonar de un agente terapéutico, profiláctico o diagnóstico, comprendiendo las partículas: (a) un agente terapéutico, […]
Formulación superfina de formoterol, del 12 de Junio de 2019, de CHIESI FARMACEUTICI S.P.A.: Un sistema de propulsor/disolvente común que comprende fumarato de (R,R)-(±)-formoterol completamente disuelto o un solvato del mismo y dipropionato […]
Composiciones, métodos y artículos que se refieren al óxido nítrico farmacéutico y los sistemas controlados de administración al paciente del mismo, del 8 de Mayo de 2019, de INO Therapeutics LLC: Un aparato para fabricar óxido nítrico gaseoso que comprende: un cerramiento que define una cámara del reactor que tiene un puerto de entrada de gas y un […]