EPITOPO DE DIAGNOSTICO Y TERAPEUTICO.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05027922.
Solicitante: ISIS INNOVATION LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: EWERT HOUSE, EWERT PLACE,OXFORD, OXFORDSHIRE OX2 7BZ.
Inventor/es: HILL, ADRIAN VIVIAN SINTON, WELLCOME TRUST CENTRE, JEWELL, DEREK PARRY, GASTROENTEROLOGY UNIT, ANDERSON,ROBERT PAUL AUTOIMMUNITY A. TRANSPL.DIV.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Octubre de 2000.
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C07K14/415 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de vegetales.
- C12N15/82C4D
- G01N33/564 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para complejos inmunológicos preexistentes o enfermedades autoinmunes.
- G01N33/68D
Clasificación PCT:
- A61P37/08 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Agentes antialérgicos (agentes antiasmáticos A61P 11/06; antialérgicos oftálmicos A61P 27/14).
- C07K14/415 C07K 14/00 […] › de vegetales.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Epítopo de diagnóstico y terapéutico.
La presente invención se refiere al diagnóstico y terapia de enfermedad celiaca, y a péptidos obtenidos de una proteína de gliadina que no causa enfermedad celiaca.
Una reacción inmunitaria a la gliadina (un componente del gluten) en la dieta causa enfermedad celiaca. Se sabe que las respuestas inmunitarias en el tejido intestinal responden preferentemente a gliadina que ha sido modificada por una transglutaminasa intestinal. La enfermedad celiaca se diagnostica por detección de anticuerpos antiendomisiales, pero esto requiere confirmación por el hallazgo de una inflamación linfocítica en biopsias intestinales. La toma de dicha biopsia es incómoda para el paciente.
Los investigadores han supuesto anteriormente que sólo las respuestas de células T intestinales proporcionan una indicación precisa de la respuesta inmunitaria contra gliadinas. Por tanto, se han concentrado en la investigación de respuestas de células T en tejido intestinal1. Por ejemplo, el documento EP-0.905.518 desvela epítopos de células T de glutenina y gliadina. Éstos son reconocidos específicamente por células T sensibles o específicas del gluten obtenidas intestinalmente. Los péptidos tienen secuencias SGQGSFQPSQQ (gliadina 206-216; SEQ ID NO: 4) y GQQGYYPTSPQQSGQ (glutenina; SEQ ID NO: 5). Se conocen epítopos de gliadina que requieren modificación de transglutaminasa (antes de ser reconocidos por el sistema inmunitario)2.
Los autores de la invención han encontrado el epítopo de célula T inmunodominante reconocido por el sistema inmunitario en enfermedad celiaca, y han demostrado que es reconocido por células T en la sangre periférica de individuos con enfermedad celiaca. Se encontró que dichas células T están presentes en frecuencias suficientemente altas para ser detectables sin reestimulacíón (es decir, podría usarse un sistema de detección de nueva respuesta
). El epítopo se identificó usando un procedimiento basado en clonación de células no T que proporcionaba un reflejo más preciso de los epítopos en reconocimiento. El epítopo inmunodominante requiere modificación de transglutaminasa (que causa la sustitución de una glutamina particular por glutamato) antes de reconocimiento por el sistema inmunitario.
Basándose en este trabajo, los autores de la invención han desarrollado una prueba que puede usarse para diagnosticar enfermedad celiaca en una fase temprana. La prueba puede efectuarse en una muestra de sangre periférica y por tanto no se requiere una biopsia intestinal. La prueba es más sensible que las pruebas de anticuerpos que se están usando en la actualidad.
La invención proporciona así un procedimiento de diagnóstico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca, en un individuo que comprende:
(a) puesta en contacto de una muestra del hospedador con un agente seleccionado entre (i) un péptido cuya longitud no supera los 50 aminoácidos, y que puede ser reconocido por un receptor de células T que reconoce un epítopo que comprende la secuencia 62PQPELPY68 (SEQ ID NO: 1) ; (ii) un péptido de (i), en el que el péptido es una variante sustituida de A-gliadina 57-73 QE65 que comprende la sustitución de aminoácido S63, D65, 163, M63, VS2 o V68; (iii) un péptido de (i), en el que el péptido es una variante sustituida de A-gliadina 57-73 QE65 que comprende la sustitución de aminoácido Y62, W62, L63, 162, W68, F62, V63, H63, F63, 162, T63, M66, S62, M62, A63, L62, 168, S67, Q62, F68, N65, A62, A68, P66, S68, Y63, E63, T64, T67 o D63; (iv) un péptido de (i), en el que el péptido es un antagonista del receptor de células T que comprende la sustitución de aminoácido 65T, 67M, 64W o 67W; (v) una proteína de fusión que comprende un péptido según (i), (ii), (iii) o (iv) y otra secuencia de gliadina o de no gliadina; o un péptido de (i), (ii), (iii) o (iv), o una fusión de (v), que comprende un aminoácido no natural, y
(b) determinación in vitro de si las células T en la muestra reconocen el agente, reconocimiento por las células T que indica que el individuo tiene, o es susceptible a, enfermedad celiaca.
La memoria descriptiva también proporciona el uso del agente para la preparación de un medio de diagnóstico para uso en un procedimiento de diagnóstico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca, en un individuo, comprendiendo dicho procedimiento la determinación de si las células T del individuo reconocen el agente, reconocimiento por las células T que indica que el individuo tiene, o es susceptible a, enfermedad celiaca.
El hallazgo de un epítopo inmunodominante que es modificado por transglutaminasa permite también el diagnóstico de enfermedad celiaca basándose en determinar si están presentes otros tipos de respuesta inmunitaria a este epítopo. Así la memoria descriptiva proporciona también un procedimiento de diagnóstico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca, en un individuo que comprende la determinación de la presencia de un anticuerpo que se une al epítopo en una muestra del individuo, la presencia del anticuerpo que indica que el individuo tiene, o es susceptible a, enfermedad celiaca.
La memoria descriptiva proporciona adicionalmente el agente, opcionalmente en asociación con un soporte, para uso en un procedimiento de tratamiento o prevención de enfermedad celiaca por tolerización de células T que reconocen el agente. También se proporciona un antagonista de una célula T que tiene un receptor de células T que reconoce (i) o (ii), opcionalmente en asociación con un soporte, para su uso en un procedimiento de tratamiento o prevención de enfermedad celiaca por antagonización de dichas células T. Adicionalmente se proporciona el agente o un análogo que se une a un anticuerpo (que se une al agente) para su uso en un procedimiento de tratamiento o prevención de enfermedad celiaca en un individuo por tolerización del individuo para prevenir la producción de dicho anticuerpo.
La memoria descriptiva proporciona un procedimiento de determinación de si una composición es capaz de causar enfermedad celiaca que comprende la determinación de si una proteína capaz de ser modificada por una transglutaminasa a una secuencia de oligopéptidos según se define anteriormente está presente en la composición, indicando la presencia de la proteína que la composición es capaz de causar enfermedad celiaca.
La memoria descriptiva también proporciona una proteína de gliadina mutante cuya secuencia de tipo salvaje puede ser modificada por una transglutaminasa a una secuencia que comprende una secuencia que comprende epítopo según se define anteriormente, aunque dicha proteína de gliadina mutante ha sido modificada de tal manera que no contiene secuencia que pueda ser modificada por una transglutaminasa a una secuencia que comprenda dicha secuencia que comprende epítopo; o un fragmento de dicha proteína de gliadina mutante que tiene al menos una longitud de 15 aminoácidos y que comprende la secuencia que ha sido modificada de dicha manera.
La memoria descriptiva también proporciona una proteína que comprende una secuencia que es capaz de unirse a un receptor de células T, receptor de células T que reconoce el agente, y siendo capaz la secuencia de causar antagonismo de una célula T que lleva dicho receptor de células T.
Adicionalmente la memoria descriptiva proporciona un alimento que comprende las proteínas definidas anteriormente.
La invención se ilustra mediante los siguientes dibujos adjuntos en los que:
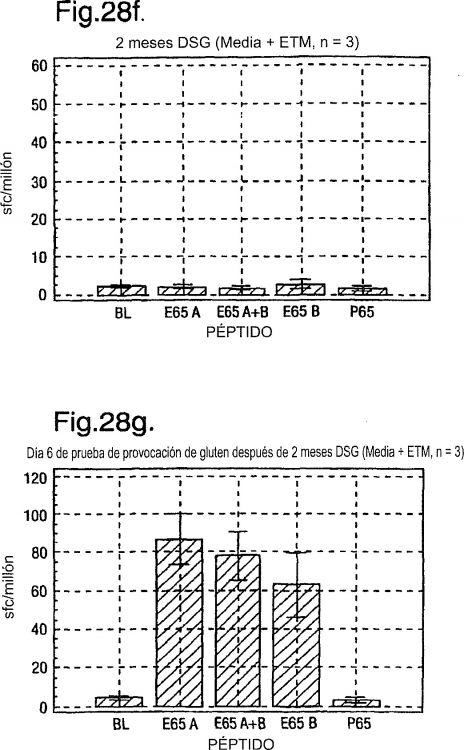
la fig. 1 muestra respuestas de ELISPOT de IFN? de PBMC (célula mononuclear de sangre periférica) recién aislada (el eje vertical muestra puntos de formación de células por 106 PBMC) a reserva 3 de péptidos tratados y no tratados con transglutaminasa (tTG) (cada péptido 10 µg/ml) que incluye cinco 15-meros superpuestos que se extienden a A-gliadina 51-85 (véase Tabla 1) y gliadina digerida con a-quimotripsina (40 µg/ml) en el Sujeto 1 con enfermedad celiaca, inicialmente en remisión después de una dieta sin gluten y a continuación sometido a prueba de provocación con 200 g de pan diarios durante tres días desde el día 1 (a). Respuestas de ELISPOT de IFN? de PBMC por el Sujeto 2 a reservas de péptidos de A-gliadina tratados con tTG 1-10 que se extienden a la proteína de A-gliadina completa durante prueba de provocación con pan de diez días (b). El eje horizontal muestra los días después de comenzar con el pan;
la fig. 2 muestra respuestas de ELISPOT...
Reivindicaciones:
1. Un péptido cuya longitud no supera los 50 aminoácidos, y que puede ser reconocido por un receptor de células T que reconoce un epítopo que comprende la secuencia 62PQPELPY68 (SEQ ID NO: 1).
2. Un péptido según la reivindicación 1, en el que el péptido es una variante sustituida de A-gliadina 57-73 QE65 que comprende la sustitución de aminoácido S63, D65, 163, M63, V62 o V68.
3. Un péptido según la reivindicación 1, en el que el péptido es una variante sustituida de A-gliadina 57-73 QE65 que comprende la sustitución de aminoácido Y62, W62, L63, 162, W68, F62, V63, H63, F63, T62, T63, M66, S62, M62, A63, L62, 168, S67, Q62, F68, N65, A62, A68, P66, S68, Y63, E63, T64, T67 o D63.
4. Un péptido según la reivindicación 1, en el que el péptido es un antagonista del receptor de células T que comprende la sustitución de aminoácido 65T, 67M, 64W o 67W.
5. Una proteína de fusión que comprende (a) un péptido según cualquiera de las reivindicaciones precedentes y (b) otra secuencia de gliadina o de no gliadina.
6. Un péptido según cualquiera de las reivindicaciones 1 a 4, o una proteína de fusión según la reivindicación 5, que comprende un aminoácido no natural.
7. Una composición que comprende uno o más de los péptidos o proteínas de fusión según cualquiera de las reivindicaciones precedentes.
8. Una composición farmacéutica que comprende un péptido o proteína de fusión según cualquiera de las reivindicaciones 1 a 6 y un soporte o diluyente farmacéuticamente aceptable.
9. Un péptido o proteína de fusión según se define en cualquiera de las reivindicaciones 1 a 6, o una composición farmacéutica según se define en la reivindicación 8, para uso en terapia.
10. Un péptido o proteína de fusión según se define en cualquiera de las reivindicaciones 1 a 6, o una composición farmacéutica según se define en la reivindicación 8, para uso en el tratamiento o prevención de enfermedad celiaca.
11. Un péptido, proteína de fusión o composición farmacéutica según se define en la reivindicación 10, en que dicho tratamiento o prevención de enfermedad celiaca es por tolerización.
12. Un procedimiento de diagnóstico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca, en un individuo que comprende:
(a) puesta en contacto de una muestra del hospedador con un péptido o proteína de fusión de cualquiera de las reivindicaciones 1 a 6, y
(b) determinación in vitro de si las células T en la muestra reconocen el péptido o proteína de fusión; reconocimiento por las células T que indica que el individuo tiene o es susceptible a enfermedad celiaca.
13. Uso de un péptido o proteína de fusión según cualquiera de las reivindicaciones 1 a 6 para la preparación de un medio de diagnóstico para uso en un procedimiento de diagnostico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca, en un individuo, comprendiendo dicho procedimiento la determinación de si las células T del individuo reconocen el péptido, reconocimiento por las células T que indica que el individuo tiene o es susceptible a enfermedad celiaca.
14. Uso según la reivindicación 13, en el que el procedimiento comprende la administración del péptido o proteína de fusión a la piel en un individuo y la detección de la presencia de inflamación en el sitio de administración, indicando la detección de inflamación que las células T del individuo reconocen el péptido o proteína de fusión.
15. Un procedimiento según la reivindicación 12 o un uso según la reivindicación 13, en el que la muestra es una muestra de sangre.
16. Un kit para efectuar un procedimiento o uso según cualquiera de las reivindicaciones 12 a 15 que comprende un péptido o proteína de fusión de cualquiera de las reivindicaciones 1 a 6 y un medio para detectar el reconocimiento del péptido o proteína de fusión por la célula T.
17. Un procedimiento de diagnóstico de enfermedad celiaca, o susceptibilidad a enfermedad celiaca en un individuo que comprende
(a) puesta en contacto de una muestra del individuo con un péptido o proteína de fusión según cualquiera de las reivindicaciones 1 a 6; y
(b) determinación de la presencia de un anticuerpo que se une al péptido o proteína de fusión, la presencia del anticuerpo que indica que el individuo tiene, o es susceptible a, enfermedad celiaca.
18. Un kit para efectuar el procedimiento de la reivindicación 17 que comprende un péptido o proteína de fusión de cualquiera de las reivindicaciones 1 a 6; y un medio para detectar la unión del anticuerpo.
19. Uso de un péptido o proteína de fusión según se define en cualquiera de las reivindicaciones 1 a 6 para producir un anticuerpo específico para el péptido.
20. Un procedimiento para identificar un análogo de un péptido que comprende la secuencia de aminoácidos 62PQPELPY68 (SEQ ID NO: 1) o 57QLQPFPQPELPYPQPQS73 (SEQ ID NO: 2) que comprende la determinación de si una sustancia candidata es reconocida por un receptor de células T o un anticuerpo que reconoce el péptido, indicando el reconocimiento de la sustancia que la sustancia es un análogo.
Patentes similares o relacionadas:
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
ANTICUERPO SÉRICO IGM-PC COMO BIOMARCADOR DE LA ESCLEROSIS MÚLTIPLE, Y NUEVA ELISA ULTRASENSIBLE PARA EL DIAGNÓSTICO DE ESTA ENFERMEDAD, del 2 de Julio de 2020, de FUNDACION UNIVERSITARIA SAN PABLO CEU: Anticuerpo sérico IgM frente a fosfatidilcolina (IgM-PC) para ser utilizado como biomarcador de la esclerosis múltiple (EM) y de las diferentes fases de esta enfermedad, […]
Ensayos para la detección de fármacos anti-TNF y autoanticuerpos, del 8 de Abril de 2020, de Prometheus Biosciences, Inc: Un método para determinar la presencia o el nivel de un fármaco anti-TNFa en una muestra biológica, en la que el fármaco anti-TNFa es un […]
Composiciones y métodos para el diagnóstico de la artritis reumatoide, del 4 de Marzo de 2020, de Inova Diagnostics, Inc: Un complejo que comprende un polipéptido purificado que comprende una alfa-1-antitripsina humana (hA1AT) carbamilada in vitro, o uno de sus fragmentos, y […]
Procedimientos y kits de supervisión de la nefropatía membranosa, del 15 de Enero de 2020, de uroimmun Medizinische Labordiagnostika AG: Un procedimiento in vitro para diagnosticar y/o pronosticar la nefropatía membranosa en un paciente, comprendiendo dicho procedimiento la etapa de detectar en una […]
Procedimiento de determinación de las concentraciones activas y/o de las constantes cinéticas de interacción en muestras biológicas complejas en resonancia de plasmón superficial, del 8 de Enero de 2020, de Université de Bordeaux: Método para determinar en muestras biológicas complejas en resonancia de plasmón superficial la concentración activa de un analito y, facultativamente, las constantes […]
Método para la medición de anticuerpos anti-fármaco, del 25 de Diciembre de 2019, de JIMRO CO., LTD: Un método para medir anticuerpos anti-fármaco (ADA) en un analito a medir, comprendiendo el método: una etapa de proporcionar una muestra […]
Procedimientos para determinar el riesgo de diabetes tipo 1 mediante biomarcadores de proteínas séricas, del 28 de Octubre de 2019, de TURUN YLIOPISTO: Un procedimiento para predecir, determinar y/o monitorizar un riesgo de y/o progresión hacia la diabetes tipo 1 (T1D) en un individuo, comprendiendo el procedimiento: a) determinar […]