Vectores de parvovirus duplicados.
Una partícula de parvovirus duplicado que comprende:
una cápsida del parvovirus
un genoma del vector que comprende en la dirección 5' a 3' :
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(iii) una secuencia de repetición terminal no resolvible que no puede ser resuelta por proteínas Rep en parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada que es esencialmente completamente complementaria a dicha primera secuencia de nucleótidos heteróloga; y
(v) una secuencia de repetición terminal de parvovirus en 3';
en donde dicho genoma del vector es capaz bajo condiciones adecuadas del apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida del parvovirus.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05076932.
Solicitante: UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 308 BYNUM HALL, CAMPUS BOX 4105 CHAPEL HILL, NC 27599-4105 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SAMULSKI, RICHARD, JUDE, MCCARTY, DOUGLAS, M.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/76 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Virus; Partículas subvirales; Bacteriófagos.
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/44 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Oxidoreductasas (1).
- A61K39/23 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Parvoviridae, p. ej. virus de la leucemia felina.
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/86 C12N 15/00 […] › Vectores virales.
- C12N15/864 C12N 15/00 […] › Vectores parvovirales.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
- C12N7/02 C12N […] › C12N 7/00 Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00). › Aislamiento o purificación.
- C12Q1/70 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen virus o bacteriófagos.
PDF original: ES-2505700_T3.pdf


Fragmento de la descripción:
Vectores de parvovirus duplicados Información relacionada con la solicitud
Esta solicitud reivindica el beneficio de la solicitud provisional de Estados Unidos núm. 60/208,604, presentada el 1 de junio de 2000.
Declaración de Soporte Federal
La presente invención se realizó, en parte, con el apoyo de los números de subvenciones HL51818, HL 48347, y DK 54419 del Instituto Nacional de Salud. El gobierno de Estados Unidos tiene ciertos derechos en esta invención.
Campo de la invención
La presente invención se relaciona con reactivos para el suministro de genes. Más particularmente, la presente invención se relaciona con vectores para el suministro mejorado de genes basados en parvovirus.
Antecedentes de la invención
El virus adeno-asociado (AAV) es un miembro no patogénico, helper dependiente de la familia de los parvovirus. Una de las características que identifican este grupo es la encapsidación de un genoma de ADN monocatenario (ADNmc). En el caso de AAV, las cadenas separadas de polaridad positiva o negativa se empacan con igual frecuencia, y, una es infecciosa. En cada extremo del genoma de ADNmc, una estructura palindrómica de repetición terminal (TR) parea las bases sobre sí misma en una configuración de horquilla. Esto sirve como cebador para la ADN polimerasa celular que sintetiza la cadena complementaria después del desnudamiento en la célula huésped. El virus adeno-asociado generalmente requiere un virus helper para una infección productiva. Aunque el adenovirus (Ad) generalmente sirve para este propósito, el tratamiento con irradiación de UV o hidroxiurea (HU) a células infectadas con AAV permitirá además una replicación limitada.
Los vectores de suministro de genes recombinantes AAV (rAAV) empacan también ADNmc de polaridad positiva o negativa, y pueden depender de factores de la replicación celular para la síntesis de la cadena complementaria. Aunque se esperó inicialmente que esta etapa pudiera llevarse a cabo espontáneamente, mediante replicación del ADN celular o vías de reparación, este no parece ser el caso. Los primeros trabajos con vectores rAAV revelaron que la capacidad para anotar la expresión del gen marcador se mejoró dramáticamente cuando las células se coinfectaron con adenovirus, o se trataron transitoriamente con agentes genotóxicos. Esta mejoría se correlacionó con la formación del ADN bicatenario a partir del virión de ADN monocatenario (vADN). Similar inducción de vectores de rAAV se observó in vivo seguido el tratamiento con Ad, radiación ionizante, o inhibidores de topoisomerasa. Sin embargo, el efecto fue muy variable entre diferentes tejidos y tipos de células. Se ha sugerido más recientemente que el reapareamiento del vADN complementario a partir de las partículas de rAAV infectantes separadas puede ser una vía importante para transducción de rAAV.
El requisito de síntesis de la cadena complementaria, o reclutamiento, se considera que es ahora un factor limitante en la eficacia de los vectores de rAAV. La tasa de transducción de rAAV en hígado de ratón se estimó en aproximadamente 5 % de los hepatocitos después de la infusión por la vena porta de 4.2 x 1010 partículas. Los experimentos posteriores revelaron que el vADN de rAAV estuvo alojado en los núcleos de prácticamente todos los hepatocitos hepáticos, y que el potencial de transducción de estos genomas puede rescatarse mediante la co-infección con adenovirus. Esto es coherente con un informe anterior de hasta el 25 % de los hepatocitos de ratón transducidos por 1010 partículas de rAAV en la presencia del adenovirus co-infectando. La expresión de rAAV en el tejido hepático coincide con la formación del ADN bicatenario y el vADN parece que se pierde si no se convierte en bicatenario dentro de las semanas 5-13. Otros experimentos sugieren que una subpoblación de hepatocitos de ratón es transitoriamente permisiva para la transducción in vivo de rAAV.
La publicación internacional de patente W099/11802 describe vectores autónomos de suministro basados en parvovirus que comprenden una secuencia de ácido nucleico heterólogo y se empaca dentro de una cápsida del parvovirus. En consecuencia, la presente invención se refiere a la necesidad en la técnica de mejorar los vectores de suministro de genes
de parvovirus. Particularmente, la presente invención se refiere a la necesidad de la síntesis de la cadena complementaria por vectores convencionales de suministro de genes de AAV.
Resumen de la Invención
La naturaleza monocatenarla del genoma de AAV puede afectar a la expresión de vectores de rAAV más que cualquier otra característica biológica. En lugar de basarse en mecanismos celulares potencialmente variables para proporcionar una cadena complementarla para vectores de rAAV, recién se encontró que este problema puede evitarse empacando ambas cadenas como una única molécula de ADN. En los estudios descritos en la presente, se observó una eficacia aumentada de la transducción de vectores duplicados sobre rAAV convencional en las células HeLa (5-140 veces). De mayor importancia, a diferencia de los vectores convencionales de VAA monocatenarios, los inhibidores de la repllcaclón del ADN no afectaron la transducción de los vectores duplicados de la Invención. Adicionalmente, los vectores de parvovirus duplicados de la invención mostraron una aparición más rápida y un nivel más alto que la expresión del transgen que la que mostraron los vectores de rAAV en hepatocitos de ratón in vivo. Todos estos atributos biológicos soportan la generación y caracterización de una nueva clase de vectores de parvovirus (ADN bicatenario de suministro) que contribuyen significativamente al desarrollo continuo de sistemas de suministro de genes basados en parvovirus.
En general, se construyó y caracterizó un nuevo tipo de vector de parvovirus que transporta un genoma duplicado, que resulta en cadenas co-empacadas de polaridad positiva y negativa atadas conjuntamente en una sola molécula en las investigaciones descritas en la presente.
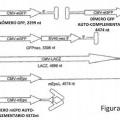
La presente invención proporciona una partícula de parvovirus duplicado que comprende: una cápsida del parvovirus, un genoma del vector que comprende en la dirección 5' a 3':
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótldos heteróloga;
(iii) una secuencia de repetición terminal no resolvióle que no puede ser resuelta por proteínas Rep en parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada que es esencialmente completamente complementaria a dicha primera secuencia de nucleótldos heteróloga; y
(v) una secuencia de repetición terminal de parvovirus en 3';
donde dicho genoma del vector es capaz bajo condiciones adecuadas del apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida del parvovirus.
Como un aspecto adicional, la presente invención proporciona una partícula de parvovirus duplicado que comprende: una cápsida del parvovirus, un genoma del vector que comprende en la dirección 5' a 3':
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(iii) una secuencia de repetición terminal no resolvióle que no puede ser resuelta por proteínas Rep en parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada; y
(v) una secuencia de repetición terminal de parvovirus en 3';
en donde las secuencias de nucleótidos entre cada una de las secuencias de repetición terminal de parvovirus 5' y 3' y la secuencia de repetición terminal no resolvióle son al menos 90 % complementarias entre sí; y en donde además dicho genoma del vector es capaz bajo condiciones adecuadas del apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida del parvovirus.
Preferentemente las secuencias de nucleótidos heterólogas duplicadas formadas por apareamiento de bases intracadena están operativamente asociadas con un elemento promotor o potenciador. En una modalidad adicional de la invención, las secuencias de nucleótidos entre cada una de las secuencias de repetición terminal de parvovirus 5' y 3' y la secuencia de repetición terminal no resolvióle son esencialmente completamente complementarias entre sí.
Preferentemente la partícula de parvovirus duplicado es una partícula de parvovirus híbrida, una partícula de parvovirus
quimérica o una partícula de parvovirus objetivo. Con mayor preferencia, el genoma del vector es aproximadamente el tamaño del genoma del AAV silvestre.
La presente invención también proporciona... [Seguir leyendo]
Reivindicaciones:
1. Una partícula de parvovirus duplicado que comprende:
una cápsida del parvovirus
un genoma del vector que comprende en la dirección 5' a 3' :
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(iii) una secuencia de repetición terminal no resolvible que no puede ser resuelta por proteínas Rep en
parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada que es esencialmente completamente complementaria
a dicha primera secuencia de nucleótidos heteróloga; y
(v) una secuencia de repetición terminal de parvovirus en 3';
en donde dicho genoma del vector es capaz bajo condiciones adecuadas del apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida del parvovirus.
2. Una partícula de parvovirus duplicado que comprende:
una cápsida del parvovirus
un genoma del vector que comprende en la dirección 5' a 3' :
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(iii) una secuencia de repetición terminal no resolvible que no puede ser resuelta por proteínas Rep en
parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada; y
(v) una secuencia de repetición terminal de parvovirus en 3';
en donde las secuencias de nucleótidos entre cada una de las secuencias de repetición terminal 5' y 3' de parvovirus y la secuencia de repetición terminal no resolvible son al menos 90 % complementarias entre sí; y además en donde dicho genoma del vector es capaz bajo condiciones adecuadas del apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida de parvovirus.
3. La partícula de parvovirus duplicado de la reivindicación 1 o la reivindicación 2, en donde las secuencias de nucleótidos heterólogas duplicadas formadas por el apareamiento de bases intracadena se asocian operativamente con un elemento promotor o potenciador.
4. La partícula de parvovirus duplicado de cualquiera de las reivindicaciones 1 a 3, en donde las secuencias de nucleótido entre cada secuencias de repetición terminal 5' y 3' de parvovirus y la secuencia de repetición terminal no resolvible son esencialmente completamente complementarias entre sí.
5. La partícula de parvovirus duplicado de cualquiera de las reivindicaciones 1 a 4, en donde la partícula de parvovirus duplicado es una partícula de parvovirus híbrida, una partícula de parvovirus quimérica o una partícula de parvovirus objetivo.
6. La partícula de parvovirus duplicado de cualquiera de las reivindicaciones 1 a 5, en donde el genoma del vector es aproximadamente del tamaño del genoma del AAV silvestre.
7. Un ácido nucleico que comprende una plantilla para producir un ADN del virión para empacar en una cápsida del parvovirus, la plantilla comprende un secuencia de nucleótidos heteróloga flanqueada por una secuencia de repetición terminal de parvovirus en 5' o 3' y una secuencia de repetición terminal no resolvible.
8. Un ácido nucleico de acuerdo con la reivindicación 7, en donde la plantilla es dimérica y comprende, en la dirección 5' a 3':
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(¡N) una secuencia de repetición terminal no resolvióle que no puede ser resuelta por proteínas Rep en parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada que es esencialmente completamente complementaria a dicha primera secuencia de nucleótidos heteróloga; y 10 (v) una secuencia de repetición terminal de parvovirus en 3';
9.
10.
11.
12.
en donde dicho ADN del virión es capaz bajo condiciones adecuadas de apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras de liberación de la cápsida del parvovirus.
Un ácido nucleico de acuerdo con la reivindicación 7, que comprende una plantilla dimérica para producir un ADN del virión para empacar en una cápsida del parvovirus, la plantilla comprende en la dirección 5' a 3':
(i) una secuencia de repetición terminal de parvovirus en 5';
(ii) una primera secuencia de nucleótidos heteróloga;
(iii) una secuencia de repetición terminal no resolvióle que no puede ser resuelta por proteínas Rep en parvovirus;
(iv) una secuencia de nucleótidos heteróloga separada; y
(v) una secuencia de repetición terminal de parvovirus en 3';
en donde las secuencias de nucleótidos entre cada una de las secuencias de repetición terminal 5 'y 3' de parvovirus y la secuencia de repetición terminal no resolvióle son al menos un 90 % complementarias entre sí; y además en donde dicho genoma del vector es capaz bajo condiciones adecuadas de apareamiento de bases intracadena entre las secuencias de nucleótidos heterólogas tras la liberación de la cápsida de parvovirus del.
La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes, en donde dichas secuencias de repetición terminal de parvovirus en 5' y 3' son secuencias de repetición terminal en 5' y 3' del virus adeno-asociado (AAV), opcionalmente seleccionadas del grupo que consiste en secuencias de repetición terminal en 5' y 3' de AAV1, AAV2, AAV3, AAV4, AAV5 y AAV6.
La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes, en donde dicha secuencia de repetición terminal no resolvióle no es una secuencia de repetición terminal de parvovirus no resolvióle.
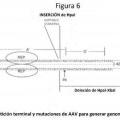
La partícula de parvovirus duplicado o el ácido nucleico de la reivindicación 11, en donde dicha secuencia de repetición terminal de parvovirus no resolvióle es una secuencia de repetición terminal de AAV no resolvióle.
13.
La partícula de parvovirus duplicado o el ácido nucleico de la reivindicación 12, en donde la secuencia de repetición terminal de parvovirus no resolvióle comprende una modificación seleccionada del grupo que consiste en:
(i) eliminación del sitio de resolución terminal (trs);
(ii) eliminación de esencialmente todo el elemento D;
(iii) una inserción en el elemento D;
(iv) inserción en la secuencia del sitio de resolución terminal (trs);
(v) una o más sustituciones de base de nucleótidos en la secuencia del sitio de resolución terminal (trs).
La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes, en donde la secuencia de repetición terminal no resolvióle es una secuencia de repetición terminal de un serotipo AAV que no es reconocido por las proteínas Rep de AAV2 o es una secuencia de repetición terminal de un parvovirus autonómo que no es reconocido por las proteínas Rep de AAV.
| La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes en donde la secuencia de nucleótidos heteróloga o la secuencia complementaria de ella codifica un pollpéptldo, opclonalmente en donde el polipéptido es un polipéptido terapéutico o ¡nmunogénlco. | |
| 16. | El parvovirus duplicado o el ácido nucleico de la Reivindicación 15, en donde el pollpéptldo es un pollpéptldo terapéutico y se selecciona del grupo que consiste en: endostatlna, anglostatlna, superóxldo dlsmutasa, erltropoyetlna, un anticuerpo monoclonal, Factor IX, Factor X, una enzima llsosomal que Incluye hexosamlnldasa A e ¡duronato sulfatasa, globina, leptina, catalasa, tirosina hidroxilasa, una cltoclna que incluyen a-lnterferón, (3- |
| ¡nterferón, ¡nterferón-y, interleuclna-2, interleucina-4, interleucina-12, factor estimulante de colonias granuloclto- macrófagos y linfotoxina, un factor de crecimiento peptídico o hormona que Incluyen somatotroplna, Insulina, factores de crecimiento tipo insulina 1 y 2, factor de crecimiento derivado de plaquetas, factor de crecimiento epidérmico, factor de crecimiento de fibroblastos, factor de crecimiento de nervios, factor neurotróflco 3 y 4, factor neurotróflco derivado del cerebro, factor neurotrófico derivado de la glía, factor -a y -P de crecimiento | |
| transformante, un receptor que incluye el receptor del factor de necrosis tumoral, un producto de gen suicida que incluyen timidina quinasa, citosina deaminasa, toxina de la difteria, citocromo P450, deoxicitidina cinasa y factor de necrosis tumoral, una proteína que confiere resistencia a un fármaco de terapia contra el cáncer, y un producto génico supresor de tumores. | |
| 17. | El parvovirus duplicado o el ácido nucleico de la reivindicación 15, en donde el polipéptido es un polipéptido inmunogénico y se selecciona del grupo que consiste en: un antígeno de cáncer antígeno tumoral; antígeno bacteriano; antígeno viral; (v) antígeno protozoario; o (vi) antígeno de parásito. |
| 18. | La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes 1 a 14 , en donde la secuencia de nucleótidos heteróloga o la secuencia complementaria a ella codifica un ácido nucleico antisentido, una ribozima, un ARN que efectúa empalme en trans mediado por empalmosoma, un ARN interferente (¡ARN), o un ARN guía. |
| 19. | La partícula de parvovirus duplicado o el ácido nucleico de cualquiera de las reivindicaciones precedentes, en donde dicha cápsida del parvovirus es una cápsida de virus adeno-asociado (AAV), opcionalmente seleccionada del grupo que consiste en una cápsida de AAV1, AAV2, AAV3, AAV4, AAV5 y AAV6. |
| El ácido nucleico de cualquiera de las reivindicaciones 7 a 19, en donde el ácido nucleico se selecciona del grupo que consiste en un plásmido, vector de ADN desnudo, cromosoma artificial bacteriano (BAC), cromosoma artificial | |
| de levadura (YAC) y un vector viral. | |
| 21. | El ácido nucleico de cualquiera de las reivindicaciones 7 a 20, en donde el ácido nucleico se incorpora de manera estable en el cromosoma de una célula de mamífero. |
| 22. | Un ADN del virión producido del ácido nucleico de cualquiera de las reivindicaciones 7 a 21. |
| 23. | Una célula cultivada que comprende el ácido nucleico de cualquiera de las reivindicaciones 7 a 21. |
| 24. | Una formulación farmacéutica que comprende una pluralidad de la partícula de parvovirus duplicado de cualquiera de las reivindicaciones 1 a 6 o reivindicaciones 10 a 19 en un portador farmacéuticamente aceptable. |
| Un método para producir una partícula de parvovirus duplicado in vitro, que comprende proporciona a una célula: | |
| (a) un ácido nucleico que codifica una plantilla de acuerdo con cualquiera de las reivindicaciones 7 a 21; (b) secuencias de nucleótidos suficientes para replicación de la plantilla para producir un genoma del vector; y (c) secuencias de nucleótidos suficientes para el empaque del genoma del vector en una cápsida del parvovirus; |
26.
27.
28.
29.
31.
32.
33.
bajo condiciones suficientes para la replicación y empaque del genoma del vector en la cápsida del parvovirus, de manera que la partícula de parvovirus duplicado que comprende el genoma del vector encapsidado dentro de la cápsida del parvovirus se produzca en la célula.
El método de la reivindicación 25, en donde el ácido nucleico que comprende la plantilla es un plásmido o un vector viral, opcionalmente un vector del virus herpes, un vector de adenovirus o un vector de baculovirus.
El método de la reivindicación 25, en donde el ácido nucleico que comprende la plantilla se integra de manera estable en el cromosoma de una célula de mamífero.
Un método para suministro in vitro de una secuencia de nucleótidos a una célula, que comprende poner en contacto una célula con una partícula de parvovirus duplicado de acuerdo con cualquiera de las reivindicaciones 1 a 6 o cualquiera de las reivindicaciones 10 a 21 bajo condiciones suficientes para que la partícula de parvovirus duplicado entre en la célula.
El método de la reivindicación 28, en donde la célula se selecciona del grupo que consiste en una célula de cáncer, célula de tumor, célula neural que incluyen células del sistema nervioso periférico y sistema nervioso central que incluyen célula del cerebro, célula del pulmón, célula de los músculos, célula epitelial que incluyen células epiteliales del intestino y vías respiratorias, células hepáticas, células dendríticas, células de los ojos que incluyen células de la retina, células pancreáticas que incluyen células de los islotes, células del miocardio, células óseas, células del bazo, queratinocito, fibroblasto, células endotellales, células de la próstata, células germinales, células progenitoras, célula madre neural y célula madre del hígado.
Un parvovirus duplicado de acuerdo con cualquiera de las reivindicaciones 1 a 6 o cualquiera de las reivindicaciones 10 a 19 para usar en el tratamiento de una enfermedad seleccionada del grupo que consiste en: fibrosis quística u otra enfermedad pulmonar, hemofilia A, hemofilia B, talasemia, anemia u otros trastornos de la sangre, SIDA, enfermedad de Alzheimer, enfermedad de Parkinson, enfermedad de Huntington, esclerosis lateral amiotróflca, epilepsia u otro trastorno neurológico, cáncer, diabetes mellitus, distrofia muscular que incluye distrofia muscular de Duchenne y distrofia muscular de Becker, enfermedad de Gaucher, enfermedad Hurler, deficiencia de adenosina deaminasa, una enfermedad de almacenamiento de glucógeno, deficiencia de ornitina transcarbamilasa, enfermedad de Tay-Sach, síndrome de Hunter u otro defecto metabólico, una enfermedad degenerativa de la retina u otra enfermedad del ojo.
Uso de un parvovirus duplicado de acuerdo con cualquiera de las reivindicaciones 1 a 6 o cualquiera de las reivindicaciones 10 a 19 para la fabricación de un medicamento para tratar una enfermedad, en donde tratamiento de la enfermedad necesita el suministro de un ácido nucleico a una célula.
Uso de un parvovirus duplicado de acuerdo con cualquiera de las reivindicaciones 1 a 6 o cualquiera de las reivindicaciones 10 a 19 para la fabricación de un medicamento para tratar una enfermedad, en donde tratamiento de la enfermedad necesita el suministro de un polipéptido inmunogénico a una célula.
Uso de una partícula de parvovirus duplicado de acuerdo con cualquiera de las reivindicaciones 1 a 6 o cualquiera de las reivindicaciones 10 a 19 para la fabricación de un medicamento para el tratamiento de una enfermedad seleccionada del grupo que consiste en fibrosis quística u otra enfermedad pulmonar, hemofilia A, hemofilia B, talasemia, anemia u otros trastornos de la sangre, SIDA, enfermedad de Alzheimer, enfermedad de Parkinson, enfermedad de Huntington, esclerosis lateral amiotrófica, epilepsia u otro trastorno neurológico, cáncer, diabetes mellitus, distrofia muscular que incluyen distrofia muscular de Duchenne y distrofia muscular de Becker, enfermedad de Gaucher, enfermedad Hurler, deficiencia de adenosina deaminasa, una enfermedad de almacenamiento de glucógeno, deficiencia de ornitina transcarbamilasa, enfermedad de Tay-Sach, síndrome de Hunter u otro defecto metabólico, una enfermedad degenerativa de la retina u otra enfermedad del ojo.
Patentes similares o relacionadas:
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]