PROTEÍNAS DE UNIÓN ARTIFICIALES BASADAS EN UNA REGIÓN DE HÉLICE ALFA MODIFICADA DE UBIQUITINA.
Un método para la generación de una proteína seleccionada entre el grupo compuesto por proteínas de la superfamilia de proteínas de "proteínas tipo ubiquitina",
así como fragmentos o proteínas de fusión de las mismas, cada una de las cuales tienen el motivo de plegamiento tipo ubiquitina, donde la proteína debido a una o más modificaciones de aminoácidos en la región de hélice alfa muestra una afinidad de unión mejorada con respecto a un agentes cuya afinidad de unión no existía o no existía a ese grado en la proteína no modificada, donde la región de hélice alfa consta de los restos correspondientes a los restos 16 a 55 de la ubiquitina humana/de mamífero, con las siguientes etapas: a) seleccionar una proteína no modificada de la superfamilia de "proteínas tipo ubiquitina"; b) proporcionar un agente para el que la proteína no modificada tiene baja o ninguna afinidad de unión; c) seleccionar aminoácidos en una región expuesta en superficie de la proteína incluyendo la región de hélice alfa; d) modificar los aminoácidos seleccionados preferiblemente por sustitución, inserción, deleción y/o modificación química, donde están modificados al menos cuatro aminoácidos expuestos en superficie en la región de hélice alfa; e) poner en contacto la proteína modificada con el agente proporcionado en la etapa b); f) detectar y aislar la proteína que tiene una afinidad de unión nueva o potenciada con respecto al agente proporcionado en la etapa b), y opcionalmente las siguientes etapas: g) producir la proteína modificada en un sistema de expresión procariota, eucariota o in vitro adecuado, o por síntesis química; h) aislar las proteínas después de la producción por un método de purificación adecuado; y de forma adicionalmente opcional i) realizar una maduración de la proteína modificada repitiendo las etapas d - h), donde la afinidad de unión, expresada en KD, de la proteína modificada por el agente es de 10 -5 M a 10 -12 M, de forma adicionalmente preferible de 10 -6 a 10 -12 M o de 10 -9 a 10 -12 M
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/062375.
Solicitante: SCIL PROTEINS GMBH.
Nacionalidad solicitante: Alemania.
Dirección: HEINRICH-DAMEROW-STRASSE 1 06120 HALLE/SAALE ALEMANIA.
Inventor/es: SCHRAEML,Michael, FIEDLER,Erik.
Fecha de Publicación: .
Fecha Solicitud PCT: 15 de Noviembre de 2007.
Clasificación Internacional de Patentes:
- C07K14/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- G01N33/68A
Clasificación PCT:
- C07K14/47 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- C12N15/10 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2358856_T3.pdf

Fragmento de la descripción:
La presente invención se refiere a proteínas de unión derivadas de la superfamilia de proteínas de ubiquitina como proteínas con modificaciones en su región de hélice alfa. La presente invención se refiere adicionalmente a un métodopara la generación de esas proteínas así como a una proteína que se puede obtener por dicho método. Además, lainvención proporciona el uso de una proteína para el reconocimiento, unión y neutralización específicos de una molécula diana pre-descrita, para la detección, determinación cuantitativa, separación y/o aislamiento de un compañero de unióncorrespondiente y el uso de una proteína de la invención, para el diagnóstico, profilaxis y tratamiento de enfermedades en las que el compañero de unión correspondiente está directa o indirectamente implicado.
Antecedentes de la invención
La ubiquitina es una proteína pequeña, monomérica, y citosólica de secuencia altamente conservada y que está presente en todas las células eucariotas conocidas desde protozoos a vertebrados. En el organismo, desempeña una tarea crucial en la regulación de la degradación controlada de las proteínas celulares. Para este propósito, las proteínas destinadas para su degradación se unen covalentemente a la ubiquitina o las cadenas de poliubiquitina durante su paso a través de una cascada de enzimas y se degradan selectivamente a causa de este marcador. De acuerdo con recientes resultados, la ubiquitina o el marcaje de las proteínas por al ubiquitina, respectivamente, desempeña una tarea importante también en otros procesos celulares tales como la importación de varias proteínas o la regulación génica delas mismas (Marx, 2002).
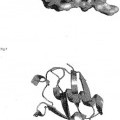
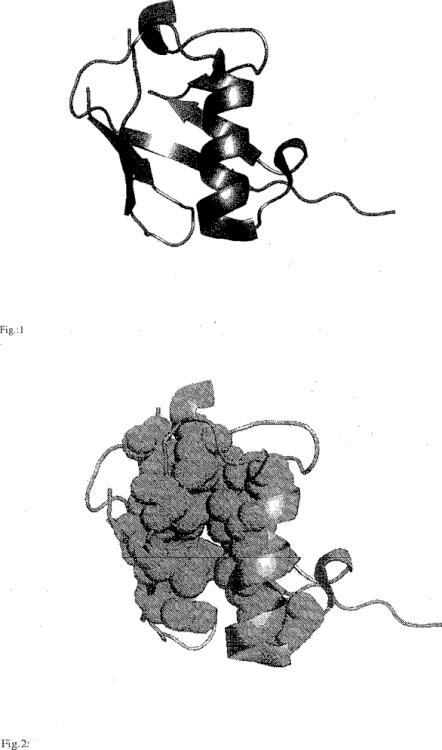
Más allá del esclarecimiento de su función biológica, la ubiquitina es un objeto de investigación principalmente a causa de sus propiedades estructurales y proteoquímicas. La cadena polipeptídica de la ubiquitina consta de 76 aminoácidos plegados en una estructura alfa/beta extraordinariamente compacta (Vijay-Kumar, 1987): casi el 87% de la cadenapolipeptídica está implicada en la formación de los elementos estructurales secundarios mediante enlaces de hidrógeno. Como estructuras secundarias prominentes pueden mencionarse tres giros y medio de hélice alfa así como una lámina beta antiparalela que consta de cuatro cadenas. La disposición característica de estos elementos - una lámina beta antiparalela expuesta en la superficie de la proteína sobre cuyo lado posterior está empaquetada una hélice alfa que descansa verticalmente sobre la parte superior de la misma - se considera generalmente como el llamado motivo deplegamiento tipo ubiquitina. Por lo tanto, la ubiquitina es el nombre que se da a la respectiva superfamilia de proteínas ("proteínas tipo ubiquitina") o a la familia de proteínas ("proteínas relacionadas con ubiquitina"), respectivamente, (Murzin et al., 1995) que comprende proteínas tales como, por ejemplo, SUMO-1 (Müller et al., 2001), FAU (Michiels et al., 1993), NEDD-8 (Kumar et al., 1993), UBL-1 (Jones y Candino, 1993), y GDX (Filippi et al., 1990) que albergan este motivo así como un alto grado de identidad con la ubiquitina en su secuencia primaria.
La ubiquitina humana es - como se ha mencionado anteriormente - un polipéptido de 76 aminoácidos de longitud (Fig. 1). Es una proteína pequeña, globular de 7,5 kDa con un extremo C-terminal forzado hacia el exterior. Las característicasestructurales principales de la ubiquitina se muestran en la Fig.1. Los restos hidrófobos de la lámina y de la hélice componen el núcleo hidrófobo de la proteína y estabilizan la orientación de la hélice (Fig. 2). El empaquetado hidrófobo altamente denso del núcleo de la proteína se refleja por su excelente estabilidad termodinámica, que debe hacer que la proteína sea un candidato ideal para su uso como esqueleto para enfoques de ingeniería proteica.
A causa de su pequeño tamaño, la preparación artificial de la ubiquitina puede realizarse tanto por síntesis química como por métodos biotecnológicos. Debido a las propiedades favorables de plegamiento, la ubiquitina puede producirse por ingeniería genética usando microorganismos tales como Escherichia coli en cantidades relativamente grandes en el citosol o en el espacio periplásmico. A causa de las condiciones oxidantes que predominan en el periplasma la última estrategia generalmente se reserva para la producción de proteínas de secreción. Debido a la preparación bacterianasimple y eficaz, la ubiquitina puede usarse como compañero de fusión para otras proteínas foráneas a preparar cuya producción es problemática. Mediante la fusión de la ubiquitina, puede conseguirse una solubilidad mejorada y de estemodo un rendimiento mejorado. El enfoque puesto en práctica en la presente invención para proporcionar ubiquitina como proteína de unión artificial universal permite una utilización completamente nueva de sus propiedades proteoquímicas.
Entre las proteínas cuya función natural se utiliza en diagnóstico y farmacéutica, las inmunoglobulinas desempeñan una tarea predominante. Su capacidad de unión específica, no covalente a un amplio rango de diferentes sustancias hace que sean la herramienta más importante para aplicación biocientífica. Los métodos desarrollados en los últimos años para la biosíntesis funcional de fragmentos de anticuerpo en E. coli han ampliado adicionalmente las posibilidades deusar las inmunoglobulinas pero al mismo tiempo han demostrado sus limitaciones.
Además de los fragmentos Fab y Fv (Skerra y Plückthun, 1988) que pueden obtenerse principalmente por métodos convencionales, podrían desarrollar diferentes construcciones artificiales mediante métodos de ingeniería proteica. Con la ayuda de la estructura modular de las inmunoglobulinas (revisado en Dübel y Kontermann, 2001), podrían generarse notablemente fragmentos Fv de cadena sencilla (scFv) (Bird et al., 1988), fragmentos Fv con unidos por puente disulfuro (dsFv) (Brinkmann et al., 1993) así como fragmentos de anticuerpo bivalentes (Carter et al., 1992) y biespecíficos (por ejemplo, diacuerpos, Holliger et al., 1993). Para el diagnóstico y el uso en terapia, pueden obtenerse proteínas bifuncionales por fusión génica de los fragmentos de Ig recombinantes a los módulos efectores. Por tanto, están disponibles fusiones a la fosfatasa alcalina (Müller et al., 1999) y la proteína fluorescente verde (GFP; Griep et al., 1999)entre otras. Las fusiones de fragmentos de anticuerpo a radioisótopos o sustancias citotóxicas son de gran importancia potencial para el tratamiento del cáncer (inmunotoxinas; Reiter y Pastan, 1998). En este caso, la unión selectiva de los fragmentos de Ig respectivos a las proteínas superficiales específicas en células tumorales se utiliza para la aplicación específica de sitio de agentes terapéuticos (direccionamiento tumoral).
Sin embargo, los métodos para la preparación de fragmentos de anticuerpo en E. coli no solamente permiteproporcionarlos para diagnóstico y terapia en suficiente calidad y cantidad sino también para una modificación simple yrápida de sus propiedades proteoquímicas e inmunoquímicas. La fácil manipulación de un hospedador bacteriano posibilita una alteración sencilla de los genes codificados en el vector para la proteína foránea mediante métodos de biología molecular convencionales. Mediante ingeniería dirigida de anticuerpos (Kontermann y Dübel, 2001) pueden optimizarse de este modo los fragmentos de anticuerpo, por ejemplo, con respecto a su afinidad de unión o su compatibilidad de hospedador. Además, pueden prepararse de forma artificial anticuerpos específicos o fragmentos delos mismos, respectivamente, es decir, fuera del sistema inmune, que están dirigidos contra las sustancias diana más diferentes tales como estructuras de bajo peso molecular o proteínas, por ejemplo. Mediante dichos métodos evolutivos,se preparan bibliotecas sintéticas de fragmentos de anticuerpo por la introducción de mutaciones aleatorias que en sumedida pueden ser cercanas al repertorio humano (Knappik et al., 2000). Mediante estrategias de selección adecuadas tales como presentación en fagos o presentación en ribosomas (Winter, 1998, Hoogenboom et al., 1998; Hanes et al., 2000) se aíslan fragmentos funcionales de Ig que tienen la propiedad de unión deseada en el caso de éxito. De estomodo, también es posible, por ejemplo, obtener proteínas de unión para aquellos antígenos que durante una inmunización clásica provocarían efectos tóxicos o solamente una respuesta inmune débil.
A pesar de los logros mencionados anteriormente y las posibilidades proporcionadas por la ingeniería de... [Seguir leyendo]
Reivindicaciones:
1. Un método para la generación de una proteína seleccionada entre el grupo compuesto por proteínas de la superfamilia de proteínas de "proteínas tipo ubiquitina", así como fragmentos o proteínas de fusión de las mismas, cada una de las cuales tienen el motivo de plegamiento tipo ubiquitina, donde la proteína debido a una o más modificaciones de aminoácidos en la región de hélice alfa muestra una afinidad de unión mejorada con respecto a un agentes cuyaafinidad de unión no existía o no existía a ese grado en la proteína no modificada, donde la región de hélice alfa constade los restos correspondientes a los restos 16 a 55 de la ubiquitina humana/de mamífero, con las siguientes etapas:
a) seleccionar una proteína no modificada de la superfamilia de "proteínas tipo ubiquitina";
b) proporcionar un agente para el que la proteína no modificada tiene baja o ninguna afinidad de unión;
c) seleccionar aminoácidos en una región expuesta en superficie de la proteína incluyendo la región de hélice alfa;
d) modificar los aminoácidos seleccionados preferiblemente por sustitución, inserción, deleción y/o modificación química, donde están modificados al menos cuatro aminoácidos expuestos en superficie en la región de hélice alfa;
e) poner en contacto la proteína modificada con el agente proporcionado en la etapa b);
f) detectar y aislar la proteína que tiene una afinidad de unión nueva o potenciada con respecto al agenteproporcionado en la etapa b), y opcionalmente las siguientes etapas:
g) producir la proteína modificada en un sistema de expresión procariota, eucariota o in vitro adecuado, o por síntesis química;
h) aislar las proteínas después de la producción por un método de purificación adecuado; y de forma adicionalmente opcional
i) realizar una maduración de la proteína modificada repitiendo las etapas d - h), donde la afinidad de unión, expresada en KD, de la proteína modificada por el agente es de 10-5 M a 10-12 M, de forma adicionalmente preferible de 10-6 a 10-12 M o de 10-9 a 10-12 M.
2. El método de acuerdo con la reivindicación 1, en el que la etapa d) se realiza por síntesis química de la proteínamodificada, o en el que la modificación de la etapa d) se realiza mediante ingeniería genética para alterar un ADN que pertenece a la proteína modificada correspondiente.
3. El método de acuerdo con la reivindicación 1, en el que en la etapa d) se establece una genoteca, o en el que en la etapa d) por mutagénesis aleatoria se realiza una sustitución aleatoria de los aminoácidos seleccionados.
4. El método de acuerdo con la reivindicación 1, en el que en la etapa e) el contacto con el agente se realiza mediante un método de selección adecuado, preferiblemente el método de presentación en fagos, presentación en ribosomas, presentación de ARNm, presentación CIS o presentación en superficie celular, presentación en superficie de levaduras, presentación en superficie de bacterias, de forma particularmente preferible mediante el método de presentación enfagos.
5. El método de acuerdo con la reivindicación 1, en el que en la etapa f) la detección de las proteínas que tienen afinidadde unión por el agente se realiza por uno o más de los siguientes métodos: ELISA, espectroscopía por resonancia de plasmón superficial, espectroscopía de fluorescencia, FACS, calorimetría por valoración isotérmica o ultracentrifugaciónanalítica.
6. El método de acuerdo con la reivindicación 1, en el que la proteína se madura por métodos conocidos per se conrespecto a su afinidad de unión, su especificidad de unión, estabilidad, solubilidad, o rendimiento, comprendiendo dichos métodos mutagénesis aleatoria, re-aleatorización dirigida al sitio de posiciones dentro del casete de unión preseleccionado, por sustituciones dirigidas de un único aminoácido o por modificaciones químicas.
7. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que la proteína se une covalentemente de un modo específico de sitio o aleatorio a al menos una proteína de la misma o diferente especificidad por lo cual se obtiene una proteína bivalente, multivalente o biespecífica.
8. El método de acuerdo con una o más de las reivindicaciones 1-7, en el que la proteína seleccionada par la modificación tiene al menos un 30% de identidad de secuencia de aminoácidos con la ubiquitina humana y un motivo deplegamiento tipo ubiquitina y/o pertenece a la familia de proteínas de "proteínas relacionadas con ubiquitina", y/o en el que la proteína seleccionada para la modificación tiene un motivo de plegamiento tipo ubiquitina y se selecciona preferiblemente entre el grupo compuesto por SUMO-1, FAU, NEDD-8, UBL-1, Rub1, APG8, ISG15, URM1, HUB1, GDX, elongina B, PLIC2 (dominio N-terminal), parking humana (dominio N-terminal), y/o en el que la proteína es ubiquitina humana u otra ubiquitina de mamífero.
9. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que se modifican los aminoácidos dela hélice alfa y opcionalmente también se modifican aminoácidos en las posiciones cadena arriba de la hélice o posiciones cadena abajo de la hélice que descansan fuera de la hélice alfa.
10. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que se modifican los aminoácidos de la ubiquitina de mamífero 22-32 de la hélice alfa y opcionalmente también se modifican aminoácidos en la región 16-21 (posiciones cadena arriba de la hélice) o 38-55 (posiciones cadena abajo de la hélice) que descansan fuera de la hélice alfa, y/o en el que la modificación es una sustitución, inserción, deleción, modificación química o combinaciones de los mismos, preferiblemente una sustitución, al menos parcialmente en aminoácidos directamente adyacentes o no directamente adyacentes en la secuencia primaria donde preferiblemente los aminoácidos modificados no adyacentes
entre sí en la secuencia primaria forman en la estructura secundaria una región de unión preferiblemente contigua parael agente, y/o donde la cantidad de modificaciones, preferiblemente sustituciones, de aminoácidos directamente adyacentes entre sí en la secuencia primaria es de 2 a 8 aminoácidos directamente adyacentes, adicionalmente preferible de 3 a 7 o de 4 a 6 o de 2 a 4 aminoácidos directamente adyacentes.
11. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que una parte de los aminoácidos modificados directamente adyacentes entre sí en la secuencia primaria está en la región inicial o final de la región dehélice alfa, donde esta parte tiene una longitud de dos o más aminoácidos, preferiblemente dos o tres aminoácidos, y/o donde en la proteína se modifican, preferiblemente se sustituyen, 5 o más aminoácidos directamente adyacentes entre sí en la secuencia primaria, de los cuales uno, dos o más, preferiblemente dos o tres, de los aminoácidos directamente adyacentes forman el principio o el final de una región de cadena de hélice alfa.
12. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que la proteína no modificada es ubiquitina humana, y en el que se modifican, preferiblemente se sustituyen, al menos 8 aminoácidos expuestos ensuperficie de la ubiquitina, de modo que estos aminoácidos modificados comprendan la región con afinidad de unión por el agente, y/o en el que la proteína modificada es ubiquitina humana sustituida, delecionada, insertada y/o modificadaquímicamente, preferiblemente sustituida, al menos con 4 o más de las posiciones 16, 18, 20, 21, 22, 24, 25, 28, 29, 31, 32, 33, 38, 39, 52, 53, 54, y/o 55.
13. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que el agente es un antígeno o un hapteno.
14. El método de acuerdo con una o más de las reivindicaciones precedentes, en el que la proteína se une
covalentemente de un modo específico de sitio o aleatorio a al menos una proteína de la misma o diferente especificidad 25 y por tanto muestra propiedades de unión bivalentes o multivalentes o biespecíficas, respectivamente.
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Péptidos de unión beta amiloide y sus usos para el tratamiento y el diagnóstico de la demencia de Alzheimer, del 17 de Junio de 2020, de Priavoid GmbH: Péptido que contiene al menos una secuencia de aminoácidos que se une a especies beta amiloides y en el que la carga negativa del grupo carboxilo presente […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones y métodos utilizando andamios de lisofosfatidilcolina, del 6 de Mayo de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Un método para seleccionar uno o más compuestos o ácidos grasos para determinar el transporte mediado por lisofosfatidilcolina (LPC) del uno o más compuestos o ácidos […]
Péptidos antimicrobianos y composiciones de los mismos, del 29 de Abril de 2020, de REVANCE THERAPEUTICS, INC: Composición farmacéutica o cosmética que comprende un péptido, en donde dicho péptido consiste en la secuencia de aminoácidos SEQ ID NO: 3 correspondiente […]
COMPOSICIÓN PARA LA ESTIMULACIÓN DEL SISTEMA INMUNE EN PECES QUE CONTIENE PÉPTIDOS RECOMBINANTES, PÉPTIDOS RECOMBINANTES INMUNOESTIMULANTES Y SECUENCIAS NUCLEOTÍDICAS QUE LOS CODIFICAN, del 23 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presente invención se refiere a una composición, una micropartícula y una formulación alimenticia que comprende péptidos recombinantes que estimulan el sistema inmune […]
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]