Preparación de formas hemihidratadas cristalinas de dihidropirazolopirimidinona.
Hemihidrato cristalino de 2-alil-1-[6-(1-hidroxi-1-metiletil)piridin-2-il]-6-{[4-(4-metilpiperazin-1-il)fenil]amino}-1,
2- dihidro-3H-pirazolo[3,4-d]pirimidin-3-ona.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/047622.
Solicitante: MERCK SHARP & DOHME CORP.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 126 EAST LINCOLN AVENUE RAHWAY, NJ 07065-0907 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WENSLOW,Robert, PETROVA,ROSITZA, SIROTA,ERIC.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/497 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › conteniendo otros heterociclos.
- A61K31/675 A61K 31/00 […] › que tienen el nitrógeno como heteroátomo de un ciclo, p. ej. fosfato de piridoxal.
- A61K31/70 A61K 31/00 […] › Hidratos de carbono; Azúcares; Sus derivados (sorbitol A61K 31/047).
PDF original: ES-2524161_T3.pdf


Fragmento de la descripción:
Preparación de formas hemihidratadas cristalinas de dihidropirazolopirimidinona Antecedentes de la invención
La presente invención se refiere a las formas hemihidratadas cristalinas de la 2-alil-1 -[6-(1 -hidroxi-1 -metiletil)piridin- 2-il]-6-{[4-(4-metilpiperazin-1-il)fenil]amino}-1,2-dihidro-3H-pirazolo[3,4-d]pirimidin-3-ona (Compuesto A) o una de sus sales, que son útiles en el ámbito del tratamiento de diversos cánceres como inhibidores de quinasas, especialmente como inhibidor de la quinasa Wee1.
Las células tienen un mecanismo de punto de control de manera que, cuando el ADN está dañado, las células detienen temporalmente el ciclo celular y reparan el ADN dañado (Cell Proliferation, Vol. 33, pp. 261-274). En aproximadamente la mitad de los cánceres humanos el gen supresor de cánceres p53 está mutado o mermado y por tanto las células han perdido su función del punto de control G1. No obstante, dichas células cancerígenas aún mantienen la función del punto de control G2 que permanece en ellas, lo que se considera un factor de reducción de la sensibilidad de las células a los agentes anticancerígenos activos para el ADN y a las radiaciones.
Una quinasa Wee1 es una tirosina quinasa que participa en el punto de control G2 del ciclo celular. La quinasa Wee1 fosforila la tirosina 15 de Cdc2 (Cdk1) que participa en la progresión hacia la fase M desde la fase G2 en el ciclo celular, inactivando así Cdc2 y deteniendo temporalmente el ciclo celular en la fase G2 (The EMBO Journal, Vol. 12, pp. 75-85). Por consiguiente, en células cancerígenas que han perdido su función p53, se considera que la función del punto de control G2 por la quinasa Wee1 es importante para reparar el ADN dañado de manera que se evite la muerte celular. Hasta ahora se ha informado de que la reducción de la expresión de Wee1 por interferencia del ARN o la inhibición de Wee1 por compuestos puede incrementar la sensibilidad de las células cancerígenas a la adriamicina, los rayos X o los rayos gamma (Cáncer Biology & Therapy, Vol. 3, pp. 35-313; Cáncer Research, Vol. 61, pp. 8211 -8217). Por todo lo anterior, se considera que un inhibidor de Wee1 puede inhibir la función del punto de control G2 de células cancerígenas mermadas en p53, aumentando así la sensibilidad de las células a agentes anticancerígenos activos para el ADN y a las radiaciones.
Los inhibidores de la quinasa Wee1 se han descrito en la solicitud de Estados Unidos 25/25836, WO 23/91255, Cáncer Research, Vol. 61, pp. 8211-8217, o Bioorg & Med. Chem. Lett., Vol. 15, pp. 1931-1935. No obstante, los compuestos descritos en estas referencias difieren estructuralmente de los compuestos de esta invención.
El Compuesto A, sus formas cristalinas y sus sales se describen en las publicaciones internacionales WO 27/126128 (publicada el 8 de noviembre de 27 por Merck & Co., Inc.), WO 27/126122 (publicada el 8 de noviembre de 27 por Merck & Co., Inc.) y WO 28/133866 (publicada el 6 de noviembre de 28 por Merck & Co., Inc.). El Compuesto A tiene un excelente efecto inhibitorio de la quinasa Wee1 y es útil en el tratamiento del cáncer.
Sumario de la invención
La presente invención se refiere a formas hemihidratadas cristalinas del Compuesto A, un inhibidor de la quinasa Wee1. Específicamente, la presente invención se refiere a la forma hemihidratada I y la forma hemihidratada II del Compuesto A.
Breve descripción de los dibujos
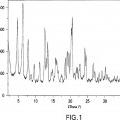
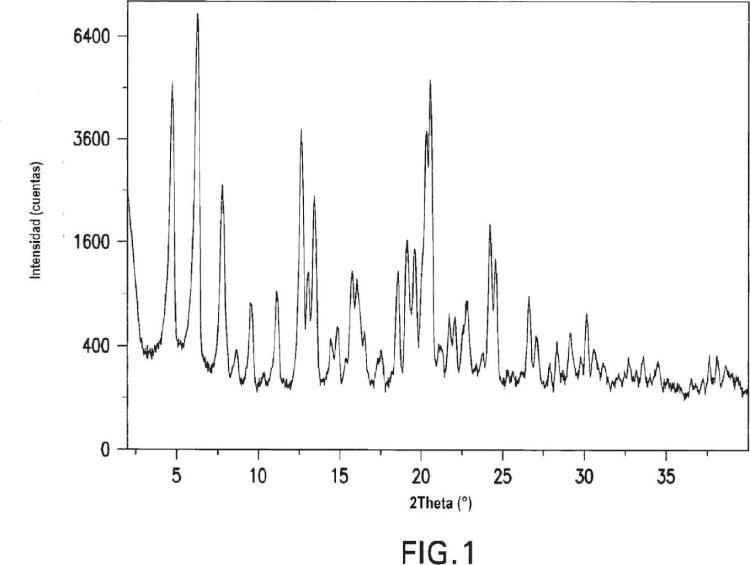
La Figura 1 es un patrón de difracción de rayos X característico de la forma cristalina del hemihidrato II del Compuesto A.
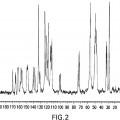
La Figura 2 es un espectro de resonancia magnética nuclear (RMN) con espín en ángulo mágico y polimerización cruzada de carbono 13 (CPMAS) de la forma cristalina del hemihidrato II del Compuesto A.
La Figura 3 es una curva DSC típica de la forma cristalina del hemihidrato II del Compuesto A.
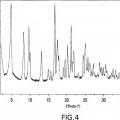
La Figura 4 es un patrón de difracción de rayos X característico de la forma cristalina del hemihidrato I del Compuesto A.
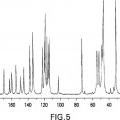
La Figura 5 es un espectro de resonancia magnética nuclear (RMN) con espín en ángulo mágico y polimerización cruzada de carbono 13 (CPMAS) de la forma cristalina del hemihidrato I del Compuesto A.
La Figura 6 es una curva DSC típica de la forma cristalina del hemihidrato I del Compuesto A.
Descripción detallada de la invención
La invención proporciona nuevas formas cristalinas de los hemihidratos del Compuesto A, un inhibidor de la quinasa Wee1. El Compuesto A, también conocido como MK-1775, es la 2-alil-1-[6-(1 -hidroxi-1 -metiletil)piridin-2-il]-6-{[4-(4- metilpiperazin-1 -il)fenil]amino}-1,2-dihidro-3H-pirazolo[3,4-d]p¡ñmid¡n-3-ona, de fórmula estructural:
que se puede preparar mediante procedimientos descritos en las publicaciones internacionales WO 27/126128 y WO 27/126122, ambas publicadas el 8 de noviembre de 27 por Merck & Co., Inc. Otras formas cristalinas y sales de Compuesto A, incluyendo la forma G monohidratada y la forma B anhidra, se describen en la publicación internacional WO 28/133866, publicada el 6 de noviembre de 28, por Merck & Co., Inc.
Las nuevas formas cristalinas de los hemihidratos del Compuesto A o una de sus sales se pueden suministrar de forma estable y constante desde el punto de vista del proceso de fabricación, y son útiles en el tratamiento del cáncer. La forma cristalina del hemihidrato I descrita en este documento es termodinámicamente más estable que otras formas conocidas a temperaturas de hasta 44 'O y a un intervalo de humedades relativas del 14-93 % (abreviado en este documento como "HR"). La forma cristalina del hemihidrato II descrita en este documento es termodinámicamente más estable que otras formas conocidas a temperaturas iguales o superiores a 48 °C y a un intervalo de humedad relativa del 19-93 %. La estabilidad relativa de los hemihidratos y la forma G monohidratada a una humedad relativa superior al 93 % ha sido difícil de establecer, debido a que las solubilidades de las tres formas cristalinas están muy próximas (diferencia <1 mg/ml) y la conversión es muy lenta.
Además, la forma del hemihidrato II se puede sintetizar usando un proceso de cristalización que es más eficiente y produce un tamaño de partícula y un control de la morfología mejorados cuando se compara con otras formas.
Las nuevas formas cristalinas de los hemihidratos del Compuesto A, o una de sus sales, así como el Compuesto A per se, tienen efecto inhibidor de quinasas, especialmente un efecto inhibidor de la quinasa Wee1, y por tanto son útiles como agentes farmacéuticos para el tratamiento de diversos cánceres tales como cáncer cerebral, cáncer cervico-cerebral, cáncer de esófago, cáncer de tiroides, cáncer de células pequeñas, cáncer de células no pequeñas, cáncer de mama, cáncer de pulmón, cáncer de estómago, cáncer de vesícula/conducto biliar, cáncer de hígado, cáncer de páncreas, cáncer de colon, cáncer rectal, cáncer de ovario, coriocarcinoma, cáncer del cuerpo uterino, cáncer útero-cervical, cáncer pélvico renal/del uréter, cáncer de vejiga, cáncer de próstata, cáncer de pene, cáncer de testículos, cáncer fetal, cáncer de Wilms, cáncer de piel, melanoma maligno, neuroblastoma, osteosarcoma, tumor de Ewing, sarcoma de partes blandas, leucemia aguda, leucemia linfática crónica, leucemia mielocítica crónica, linfomade Hodgkin.
En particular, las nuevas formas cristalinas de los hemihidratos del Compuesto A o una de sus sales, así como el Compuesto A per se, son útiles como agentes farmacéuticos, por ejemplo, para el tratamiento del cáncer de mama, cáncer de pulmón, cáncer de páncreas, cáncer de colon, cáncer de ovario, leucemia aguda, leucemia linfática crónica, leucemia mielocítica crónica, linfomade Hodgkin.
El término "Compuesto A" como se denomina en este documento se refiere a un compuesto de la fórmula química estructural descrita anteriormente.
Los estudios de difracción de rayos X sobre polvo se usan de forma generalizada para caracterizar estructuras moleculares, cristalinidad, y polimorfismo. El patrón de difracción de rayos X sobre polvo del hemihidrato se generó sobre un sistema de difracción de rayos X Philips Analytical X'Pert PRO X-ray Diffraction System con consola PW34/6. Como fuente se usó un tubo de rayos X cerámico LEF de radiación K-Alfa de Cu PW3373/.
El patrón de difracción de rayos X sobre polvo de la forma hemihidratada II del Compuesto A se muestra en la Figura 1. La forma hemihidratada II del Compuesto A, también conocida como "la forma hemihidratada II" o "la forma cristalina del hemihidrato II del Compuesto A" presenta picos de difracción característicos correspondientes a separaciones d de 13,81, 11,16, y 3,34 angstroms.... [Seguir leyendo]
Reivindicaciones:
1. Hemihidrato cristalino de 2-alil-1 -[6-(1 -hidroxi-1 -metiletil)piridin-2-il]-6-{[4-(4-metilpiperazin-1 -il)fenil]amino}-1,2- dihidro-3H-pirazolo[3,4-d]pirimidin-3-ona.
2. El hemihidrato cristalino de 2-alil-1-[6-(1-hidroxi-1-metiletil)piridin-2-il]-6-{[4-(4-metilpiperazin-1-il)fenil]amino}-1,2- dihidro-3H-pirazolo[3,4-d]pirimidin-3-ona de la reivindicación 1 que está caracterizado por un patrón de difracción de rayos X sobre polvo, recogido usando radiación Ka de cobre, correspondiente a separaciones d de 13,81, 11,16 y 3,34 angstroms.
3. El hemihidrato cristalino de la reivindicación 2 que además está caracterizado por separaciones d de 6,92, 6,74 y 6,53 angstroms.
4. El hemihidrato cristalino de la reivindicación 3 que además está caracterizado por separaciones d de 18,17 y 4,3 angstroms.
5. El hemihidrato cristalino de la reivindicación 2 que está caracterizado por un espectro de resonancia magnética nuclear CPMAS de carbono 13 en estado sólido que presenta señales a 28,6, 55,8 y 132,3 ppm.
6. El hemihidrato cristalino de la reivindicación 5 que además está caracterizado por señales a 123,2, 118,2 y 72,3 ppm.
7. El hemihidrato cristalino de 2-alil-1-[6-(1-hidroxi-1-metiletil)piridin-2-il]-6-{[4-(4-metilpiperazin-1-il)fenil]amino}-1,2- dihidro-3H-pirazolo[3,4-d]pirimidin-3-ona de la reivindicación 1 que está caracterizado por un patrón de difracción de rayos X sobre polvo, recogido usando radiación Ka de cobre, correspondiente a separaciones d de 1,66, 5,3 y 4,18 angstroms.
8. El hemihidrato cristalino de la reivindicación 7 que además está caracterizado por separaciones d de 9,11, 8,8 y 3,54 angstroms.
9. El hemihidrato cristalino de la reivindicación 8 que además está caracterizado por separaciones d de 18,22, 3,9 y 3,2 angstroms.
1. El hemihidrato cristalino de la reivindicación 7 que está caracterizado por un espectro de resonancia magnética nuclear CPMAS de carbono 13 en estado sólido que presenta señales a 116,6, 52,4, 55, y 31,7 ppm.
11. El hemihidrato cristalino de la reivindicación 1 que además está caracterizado por señales a 145,, 154,8, 16,1 y 169,4 ppm.
12. Una composición farmacéutica que comprende el hemihidrato cristalino de cualquiera de las reivindicaciones anteriores y un vehículo farmacéuticamente aceptable.
13. Un hemihidrato cristalino de una cualquiera de las reivindicaciones 1 a 11 para su uso en el tratamiento del cáncer.
14. Un hemihidrato cristalino para el uso de la reivindicación 13, en el que el cáncer se selecciona del grupo que consiste en cáncer cerebral, cáncer cervico-cerebral, cáncer de esófago, cáncer de tiroides, cáncer de células pequeñas, cáncer de células no pequeñas, cáncer de mama, cáncer de pulmón, cáncer de estómago, cáncer de vesícula/conducto biliar, cáncer de hígado, cáncer de páncreas, cáncer de colon, cáncer rectal, cáncer de ovario, coriocarcinoma, cáncer del cuerpo uterino, cáncer útero-cervical, cáncer pélvico renal/del uréter, cáncer de vejiga, cáncer de próstata, cáncer de pene, cáncer de testículos, cáncer fetal, cáncer de Wilms, cáncer de piel, melanoma maligno, neuroblastoma, osteosarcoma, tumor de Ewing, sarcoma de partes blandas, leucemia aguda, leucemia linfática crónica, leucemia mielocítica crónica y linfoma de Hodgkin.
15. Un hemihidrato cristalino de una cualquiera de las reivindicaciones 1 a 11 para su uso en terapia.
Patentes similares o relacionadas:
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Aditivo de alimento para animales que contiene diurnosida y/o cestrumosida, del 17 de Junio de 2020, de Neufeld GmbH: Aditivo de alimento para animales para aplicar en un procedimiento para la inhibición de la proteínquinasa C para la profilaxis de discondroplasia, […]
Tratamiento de trastornos metabólicos en animales equinos, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Uno o más inhibidores de SGLT2 de formas cristalinas farmacéuticamente aceptables de los mismos para la utilización en el tratamiento y/o la prevención […]
Terapia de reducción de sustrato, del 1 de Abril de 2020, de THE CHANCELLOR, MASTERS AND SCHOLARS OF THE UNIVERSITY OF OXFORD: Un compuesto que es un inhibidor de la biosíntesis de esfingolípidos para su uso en el tratamiento de una enfermedad que es el Síndrome de Smith-Lemli-Opitz (SLOS) […]
Composición que contienen glucosilglicerol para promover la regeneración de tejidos corporales lesionados, del 25 de Marzo de 2020, de BITOP AG: Composición que contiene como principio activo glucosilglicerol y/o ésteres de este compuesto para usar en la promoción de la regeneración de tejidos corporales […]
Terapias de combinación para el tratamiento de la enfermedad de Alzheimery transtornos relacionados, del 19 de Marzo de 2020, de THE GENERAL HOSPITAL CORPORATION: Combinación farmacéutica que comprende un primer compuesto y un segundo compuesto para su uso en disminuir la progresión de o en el tratamiento […]
Formulaciones farmacéuticas que contienen hidrato de dapagliflozina propilenglicol, del 11 de Marzo de 2020, de ASTRAZENECA AB: Una formulacion farmaceutica de liberacion inmediata en forma de una granulacion de reserva para cargar en capsulas o tabletas formadoras, o en […]
Método y kits para identificación de inhibidores CDK9 para el tratamiento de cáncer, del 19 de Febrero de 2020, de Memorial Sloan Kettering Cancer Center: Un inhibidor de CDK9, seleccionado del grupo que consiste en PHA-767491, DRB, SNS-032, flavopiridol y ARNph contra CDK9, para usar en el tratamiento del cancer […]