USO DE UN VECTOR DE EXPRESION PARA UNA CELULA ANIMAL.
Un vector de expresión para una célula animal seleccionada del grupo constituido por una célula CHO,
una BHK y una NIH3T3, en el que el vector comprende un promotor seleccionado del grupo constituido por un promotor del virus SV40 y un promotor del CMV, y el complemento de un elemento MAR de ß-globina que está ubicado en el extremo 5''-terminal del promotor
Tipo: Resumen de patente/invención. Número de Solicitud: W0101285KR.
Solicitante: MOGAM BIOTECHNOLOGY RESEARCH INSTITUTE
PAN-GEN BIOTECH LABORATORIES INC.
Nacionalidad solicitante: República de Corea.
Dirección: 341 POJUNG-RI, KOOSUNG-MYON,YONGIN-SI, KYONGGI-DO 449-9.
Inventor/es: KIM, JONG-MOOK, PARK,DOO-HONG, KIM,JUNG-SEOB, OH,SUN-MO, YOON,JAE-SEUNG, BAEK,KWANG-HEE, CHUNG,SOO-IL,HYUNDAI APT. 112-902, YOON,YEUP.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07K14/47A8
- C07K14/595 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Gastrinas; Colecistoquininas (CCK).
- C07K14/71 C07K 14/00 […] › para factores de crecimiento; para reguladores de crecimiento.
- C12N15/85 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células animales.
Clasificación PCT:
- C12N15/85 C12N 15/00 […] › para células animales.
Clasificación antigua:
- C12N15/85 C12N 15/00 […] › para células animales.
Fragmento de la descripción:
Uso de un vector de expresión para una célula animal.
Antecedentes de la invención
La presente invención se refiere a un vector de expresión para una célula animal, y más particularmente, a un vector de expresión que incluye el elemento de la región de unión a la matriz nuclear (denominado a continuación en el presente documento "elemento MAR") y el sitio de terminación de la transcripción del gen de la gastrina.
Muchos tipos de sistemas de expresión, tales como microorganismos, plantas, levaduras, células de insectos y células animales están actualmente en uso para el tratamiento médico mediante la expresión de las proteínas deseadas en una gran cantidad. Entre los muchos tipos de sistemas de expresión, los microorganismos son los más fácilmente usados como sistema de expresión, y muchos tipos de sistemas de microorganismos se estudian y se utilizan como sistema de expresión.
Sin embargo, el uso del sistema de expresión de microorganismos está limitado en algún sentido. En primer lugar, aunque los genes se expresan en un microorganismo, la estructura y caracteres de la proteína expresada son distintos de los de la proteína animal, porque el microorganismo tiene un mecanismo diferente para expresar proteínas y un mecanismo de modificación de proteína tal como glicosilación, fosforilación y amidación. Por tanto, una proteína recombinante producida a partir de microorganismos casi no tiene modificación, o está limitada en la producción de proteínas de las que la función no se ve muy afectada por la diferencia de la modificación y la estructura de las proteínas. Además, cuando se usan las proteínas recombinantes que se expresan por microorganismos, se necesita un proceso de limpieza por la contaminación del microorganismo o toxina.
Aunque las células animales son adecuadas para una expresión de proteínas en animales, el sistema de expresión que usa células animales no se usa comúnmente, porque el sistema de expresión que usa células animales crea costes de producción superiores debido a una eficacia de expresión inferior de la proteína recombinante en comparación con la de microorganismos y células animales.
Una célula animal para la industria, que se usa actualmente para un sistema de expresión incluye CHO (ovario de hámster chino), BHK (riñón de cría de hámster) y mieloma, y se introduce el vector de expresión en la célula animal y se produce una proteína foránea deseada, como en microorganismos.
Por tanto, los sistemas de expresión génica se modifican mediante diversos procedimientos, porque en general se expresa una pequeña cantidad de los genes foráneos. Por ejemplo, se cultiva una cepa de células de CHO en medio que contiene metotrexato (denominado a continuación en el presente documento "MTX") que es un inhibidor de la DHFR (dihidrofolato reductasa), con el fin de obtener la cepa CHO que está viva dependiendo de la concentración de MTX, y expresa altamente la proteína debido al aumento en el número de copias de genes.
Generalmente, cuando se expresan los genes foráneos en una célula animal, el gen foráneo se cotransfecta con el vector que tiene un marcador selectivo y se seleccionan células transformadas a través del cultivo en el medio selectivo durante muchas horas. Sin embargo, la frecuencia para lograr un clon de células que expresan altamente es baja. La baja frecuencia de la expresión del gen foráneo se debe a la inserción cromosómica del gen foráneo en un sistema animal, a diferencia de un microorganismo. Además, aunque el proceso de inserción del gen foráneo sea satisfactorio, no puede esperarse la expresión de los genes foráneos, puesto que el sitio insertado de cada gen difiere y la expresión del gen depende del sitio insertado (Grindley et al., 1987. Trends Genet. 3, 16-22; Kucherlapati et al., 1984. Crit. Rev. Biochem. 16, 349-381; Palmiter et al., 1986. Annu. Rev. Genet. 20, 465-499). Por tanto, aunque los genes foráneos están integrados de manera estable, pueden expresarse en una pequeña cantidad, porque la mayor parte de la expresión génica en células animales está inhibida por el ácido nucleico adyacente (Eissenberg et al., 1991. Trends Genet. 7, 335-340; Palmiter et al., 1986. Annu Rev. Genet. 20, 465-499).
Con el fin de proteger la expresión del gen foráneo de los efectos de posición, se ha informado de la posibilidad de usar elementos de matriz nuclear en varios sistemas. El elemento nuclear a modo de ejemplo incluye un elemento aislante, una región de unión a la matriz nuclear (denominada a continuación en el presente documento "MAR") y una región de unión al armazón proteínico (denominada a continuación en el presente documento "SAR").
Kalos (Kalos et al., 1995 Mol. Cell. Biol. 15, 198-207) sugirió que cuando la MAR de apolipoproteína B estaba combinada con el constructo transgénico del promotor mínimo, el gen foráneo se introducía de manera estable en el cromosoma huésped, de modo que la cantidad expresada del transcrito aumentaba en aproximadamente 200 veces. De manera similar al procedimiento mencionado anteriormente, se informó de que la MAR de lisozima A de pollo y la SAR de ß-interferón pueden aumentar el nivel de expresión del gen foráneo en una célula de vertebrado independientemente del sitio de inserción cromosómica (Eissenberg et al., 1991. Trends Genet. 7, 335-340; Klehr et al, 1991. Biochemistry 30, 1264-1270). Sin embargo, no se ha verificado que la MAR y la SAR puedan aumentar la producción de proteínas en una cepa de células CHO, o que la MAR y la SAR sean adecuadas para su uso común.
Cuando se expresa un gen de célula animal; la síntesis de ARNmr se produce a partir del promotor y finaliza en el sitio de terminación. Los niveles de las proteínas expresadas están influenciados con frecuencia por la eficacia de la terminación de la transcripción así como la estabilidad del ARNm sintetizado.
El sitio de terminación transcripcional que se incluye en un vector de expresión controla la poliadenilación y tiene una influencia en la estabilidad del ARNm. El sitio de terminación incluye una señal de poli-A, un sitio de rotura, un sitio de terminación, y la señal de poliadenilación es AATAAA y está bien estudiada. Sin embargo, no se conocen bien el sitio de rotura en el que se produce la poliadenilación, ni el sitio de terminación en el que se completa la transcripción génica por la enzima II de polimerización de ARN. Además, aunque se informa de que la región rica en GU/U excepto los tres tipos de región crítica controla la poliadenilación del ARNm, no se conoce el mecanismo detallado.
Los vectores de expresión que se usan comúnmente en células animales contienen una señal de poli-A del virus SV40 y BGH (hormona de crecimiento bovina), y no se ha sugerido que el terminador específico, que mejora la estabilidad de ARNm y el nivel de expresión, se desarrolla con el fin de usar el vector de expresión de células animales.
Sumario de la invención
Es un objeto de la presente invención proporcionar un vector de expresión que tenga un aumento de la eficacia de la expresión y los niveles para genes foráneos en la expresión de proteínas foráneas usadas en un sistema de célula animal.
Con el fin de lograr estos objetivos, la descripción presente proporciona un vector de expresión que comprende el elemento MAR (región de unión a la matriz nuclear) o su secuencia complementaria en el extremo 5'-terminal de un promotor.
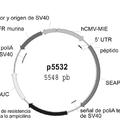
Además, la descripción presente proporciona un vector de expresión para células animales que comprende un constructo constituido por la señal de poli-A (poliadenilación) del virus SV 40 y el sitio de terminación de la transcripción del gen de la gastrina, en el que el constructo tiene una secuencia de SEC ID NO. 3.
Además, la descripción presente proporciona un vector pMSG KCCM 10202 de la SEC ID NO. 8, que comprende una secuencia complementaria de la MAR (región de unión a la matriz nuclear) en 5' de ß-globina humana, y el constructo constituido por la señal de poli-A del virus SV 40 y el sitio de terminación de la transcripción del gen de la gastrina.
Además, la descripción presente un procedimiento de preparación de materiales bioactivos usando un vector de expresión para células animales que comprende un elemento MAR de ß-globina, o la secuencia complementaria de la MAR de ß-globina en el extremo 5'-terminal...
Reivindicaciones:
1. Un vector de expresión para una célula animal seleccionada del grupo constituido por una célula CHO, una BHK y una NIH3T3, en el que el vector comprende un promotor seleccionado del grupo constituido por un promotor del virus SV40 y un promotor del CMV, y el complemento de un elemento MAR de ß-globina que está ubicado en el extremo 5'-terminal del promotor.
2. El vector de expresión según la reivindicación 1, en el que el vector de expresión es pMS de la SEC ID NO.1.
3. El vector de expresión según la reivindicación 1, que comprende el promotor del CMV y el complemento del elemento MAR de ß-globina ubicado en el extremo 5'-terminal del promotor.
4. El vector de expresión según la reivindicación 1, que comprende además la secuencia de SEC ID NO. 3 como terminador.
5. El vector de expresión según la reivindicación 4, en el que el vector de expresión es el vector pMSG de la SEC ID NO. 8.
6. Un procedimiento de preparación de materiales bioactivos en una célula animal seleccionada del grupo constituido por una célula CHO, una BHK y una NIH3T3, usando el vector de expresión según una cualquiera de las reivindicaciones 1 a 5.
7. El procedimiento según la reivindicación 6, en el que el material bioactivo es TGF-ß SRII.
8. Un procedimiento para aumentar una expresión génica en una célula animal seleccionada del grupo constituido por una célula CHO, una BHK, una NIH3T3, usando el vector de expresión según la reivindicación 1.
9. El procedimiento según la reivindicación 8, en el que el vector de expresión es pMS de la SEC ID NO. 1.
10. El procedimiento según la reivindicación 8, en el que el vector de expresión comprende el promotor del CMV y el complemento del elemento MAR de ß-globina ubicado en el extremo 5'-terminal del promotor.
11. El procedimiento según la reivindicación 8, en el que el vector de expresión comprende además la secuencia de SEC ID NO. 3 como terminador.
12. El procedimiento según la reivindicación 11, en el que el vector de expresión es el vector pMSG de la SEC ID NO. 8.
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
 Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]