PAREJAS DE INTERACCION DE CD55 Y LA UTILIZACION DE LAS MISMAS.
La utilización de (i) un miembro de unión que se une tanto a SCR1 como SCR2 de CD55 o (ii) un ácido nucleico que codifica dicho miembro de unión en la preparación de un medicamento para el tratamiento del cáncer,
en la que el miembro de unión no se une a ningún agente con propiedades antitumorales
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2003/005163.
Solicitante: CANCER RESEARCH TECHNOLOGY LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 61 LINCOLN'S INN FIELDS,LONDON WC2A 3PX.
Inventor/es: DURRANT,GILLIAN LINDY.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K16/28Z
- C07K16/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de células tumorales.
Clasificación PCT:
- C07K16/30 C07K 16/00 […] › de células tumorales.
Clasificación antigua:
- C07K16/30 C07K 16/00 […] › de células tumorales.
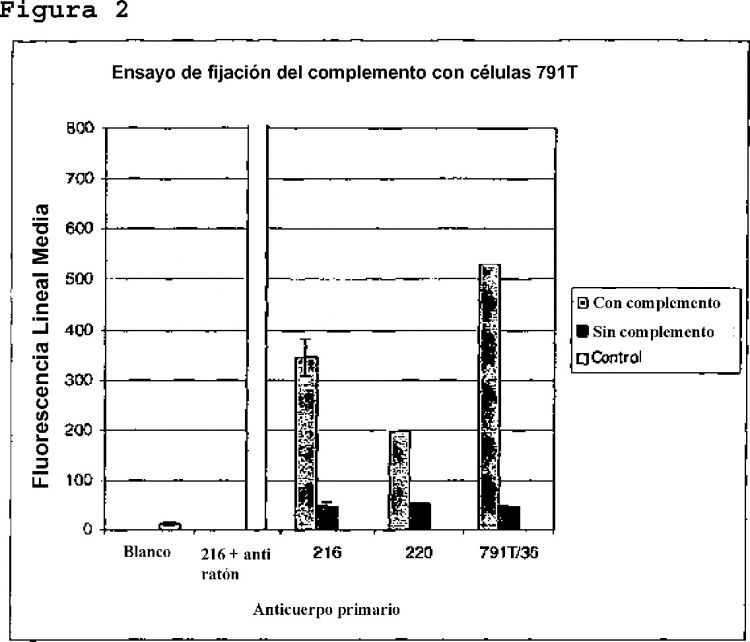
Fragmento de la descripción:
Parejas de interacción de CD55 y la utilización de las mismas.
La presente invención está relacionada con miembros de unión específica y su utilización en la terapia . En particular, la invención está relacionada con miembros de unión específica que se unen a CD55, su utilización en la modulación de la activación del complemento y el tratamiento de enfermedad, por ejemplo, una enfermedad neoplásica.
El sistema de complemento humano consiste en un mecanismo de reconocimiento y efector altamente eficiente que consiste en 30 componentes séricos o celulares, lo que incluye proteínas activadas, receptores y reguladores positivos y negativos. En breve, la cascada del complemento consiste en un paso de iniciación, un paso de amplificación con bucle de retroalimentación y finalmente, un ataque a la membrana o paso de lisis. El componente central del sistema de complemento es C3. La generación de C3b mediante la vía clásica o alternativa es crucial para la opsonización y lisis. La vía clásica se inicia cuando el componente C1, a través de su subcomponente C1q, se une a un anticuerpo para formar un complejo inmune. En la vía alternativa, sin embargo, no hay factor de iniciación equivalente a los anticuerpos. En lugar de ello, está en un estado de activación continua de bajo nivel como resultado de la hidrólisis espontánea de un grupo tioéster en la C3 nativa. Esto resulta en la unión de C3 a moléculas aceptoras no específicas en el plasma o sobre las superficies celulares. Esto puede resultar en la formación de convertasas de C3 y la creación de un bucle de retroalimentación. A causa de su potente capacidad pro-inflamatoria y destructiva, existe un sistema regulador diseñado para evitar la activación del complemento tanto en la fase fluida como en los tejidos circundantes.
Existen cuatro proteínas reguladoras del complemento unidas a membrana llamadas receptor del complemento 1 (CR1), CD55, CD46 y CD59 (Liszewski et al 1996. Adv Immunol 61: 201-283). La regulación se consigue mediante:
1. la reducción espontánea de las proteínas activadas y complejos enzimáticos (es decir una vida media corta),
2. la desestabilización e inhibición de los complejos de activación, o
3. la escisión proteolítica de los componentes "activados".
CD46, CD55 y CD59 se expresan ampliamente en muchos tejidos, lo que incluye los epitelios de superficie y los tejidos tumorales. Por el contrario, la expresión de CR1 se limita a las células de sangre periférica y por lo tanto, no está directamente involucrada en la protección de los tumores sólidos.
La mayoría de tumores son de origen epitelial y, aunque la mayoría de epitelios de superficie expresan proteínas reguladoras del complemento, los tumores muestran una expresión variable de CD55, CD46 y CD59. La mayoría de tumores colorectales y tiroidales expresan niveles elevados de las tres proteínas reguladoras del complemento (Niehans et al., 1996 Am J Pathol 149: 129-142; Li et al., 2001 Br. J. Cancer 84: 80-86; Thorsteinsson, 1998 APMIS 106: 869-878; Yamakawa et al., 1994 Cancer 73: 2808-2817). El carcinoma ductal de mama muestra la mayor variación en el fenotipo, con algunos tumores que expresan sólo un inhibidor mientras otros expresan diferentes combinaciones de dos o tres inhibidores (Niehans et al., 1996 supra; Thorsteinsson et al., 1998 supra). El carcinoma de células renales posee una expresión de débil a moderada de uno a tres inhibidores, generalmente CD55 y CD59 (Niehans et al., 1996 supra), mientras los carcinomas de pulmón de células grandes y los tumores de ovario y cervicales normalmente expresan CD59 y CD46 con una inmunoreactividad de CD55 variable (Niehans et al., 1996 supra; Bjorge et al., 1977 Cancer Immunol Immunother 42: 185-192; Simpson et al., 1997 Am J Pathol 151: 1455-1467). Se han obtenido resultados similares con líneas celulares establecidas (Bjorge et al., 1996 supra; Gorter et al 1986 Lab Invest 74 1; Juhl et al., 1997 J. Surgical Oncol. 64: 222-230; Li et al., 2001 supra).
Las tres proteínas reguladoras del complemento se expresan sobre el endotelio vascular. Sus papeles específicos durante la inflamación cuando el riesgo de daño mediado por el complemento puede aumentarse permanece sin determinar. CD55, pero no CD46 o CD59, está regulada positivamente en las células endoteliales por los mediadores proinflamatorios TNFa, IL-1ß y IFN-?, y también por el MAC (complejo de ataque de membrana) y la trombina. Estos resultados sugieren que CD55 es de una importancia crítica en la protección de las células endoteliales frente al complemento durante la inflamación y coagulación. Además se ha demostrado recientemente que la retracción de las células endoteliales que expone la matriz extracelular subendotelial es un potente inductor de la vía alternativa del complemento, lo que libera anafilotoxinas que estimulan la inflamación. Como los tumores frecuentemente poseen un endotelio desregulado, con las paredes de los vasos expuestas, el ambiente tumoral puede inducir la activación del complemento. Esta puede ser una de las razones de que las células tumorales sobreexpresen receptores reguladores del complemento. Sin embargo, se ha demostrado que, en realidad, tanto las células tumorales como las células endoteliales pueden secretar CD55 pero no CD46 a su matriz extracelular (ECM)(Hindmarsh y Marks, 1998 J. Immunol. 160: 6128-6136). Hindmarsh y Marks demostraron que la CD55 derivada de un tumor pero no la endotelial es funcionalmente activa y puede evitar la fijación de C3b. Sin embargo, la fijación de CD55 en la matriz no pudo regularse positivamente mediante citoquinas inflamatorias. Más recientemente, los presentes inventores han mostrado que tanto CD55 como CD59 pueden depositarse en la matriz extracelular tanto por los tumores como por las células endoteliales, y estas últimas pueden regularse positivamente de forma considerable por el potente factor de crecimiento de la angiogénesis VEGF (Li et al., 2001 supra). Además, se ha demostrado que la CD55 depositada en las células endoteliales estimuladas con VEGF es funcionalmente activa. VEGF no es habitual, ya que es la única citoquina identificada hasta el momento que regula positivamente tanto la expresión en la superficie celular como la fijación de CD55 en la ECM.
Como la mayoría de tumores secretan niveles elevados de VEGF para inducir la angiogénesis, estos estimularán la expresión de CD55 en las células endoteliales y en la ECM. De forma interesante, la inmunohistoquímica de tumores colorectales con anticuerpos monoclonales anti-CD55 muestra una tinción intensa del estroma del tumor (Li et al., 2001 supra; Simpson et al., 1997 supra; Niehans et al., 1996 supra) y de los vaso sanguíneos (Niehans et al., 1996 supra). La CD55 depositada en la ECM está unida covalentemente y no puede liberarse mediante ácidos o bases fuertes.
CD55 se une a las convertasas de C3 tanto de la vía clásica como alternativa del complemento desplazando a C2b y C3b respectivamente. Por lo tanto, puede evitar la fijación de C3b e inhibir en posterior ensamblaje del complejo de ataque de membrana. CD55 posee un dominio extracelular que está compuesta de 4 dominios consenso cortos contiguos (SCR) y una región rica en treonina/serina próxima a la superficie celular. Posee un único punto de N-glucosilación entre el primer y el segundo dominio SCR y está fuertemente O-glucosilada en las regiones ricas en treonina y serina. Está unida a la membrana celular mediante un anclaje glucofosfoinositol (GPI) y la expresan todas las células expuestas al complemento, es decir, hematíes, leucocitos y células endoteliales y epiteliales. CD55 también se ha detectado en pequeñas cantidades en plasma, saliva y orina. La significación biológica de esta forma soluble permanece sin esclarecer ya que nunca se ha podido demostrar que esté funcionalmente activa. Recientemente se ha demostrado que las células HeLa y HUVEC incorporan CD55 en su matriz extracelular y que esta CD55 unida covalentemente puede inhibir la fijación de C3b y la liberación de la anafilotoxina proinflamatoria C3a (Hindmarsh y Marks, 1998 supra).
Además de conseguir que las células tumorales sean susceptibles a la activación del complemento in situ, los anticuerpos que inhiben las funciones de las proteínas reguladoras del complemento también pueden conseguir que las células tumorales sean susceptibles a la citotoxicidad celular dependiente de complemento...
Reivindicaciones:
1. La utilización de (i) un miembro de unión que se une tanto a SCR1 como SCR2 de CD55 o (ii) un ácido nucleico que codifica dicho miembro de unión en la preparación de un medicamento para el tratamiento del cáncer, en la que el miembro de unión no se une a ningún agente con propiedades antitumorales.
2. La utilización de acuerdo con la reivindicación 1 en la que el cáncer es uno o más de uno de entre el cáncer colorectal, de mama, de ovario, cervical, gástrico, de pulmón, de hígado, de piel y mieloide (por ejemplo de médula ósea).
3. La utilización de acuerdo con la reivindicación 1 o reivindicación 2 en la que el miembro de unión es un anticuerpo o un fragmento del mismo.
4. La utilización de acuerdo con cualquiera de las reivindicaciones precedentes en la que el miembro de unión se une a los aminoácidos 4-12 de SCR1 en el Id. de Sec. Nº 1, los aminoácidos 9-20 de SCR2 en el Id. de Sec. Nº 5 y los aminoácidos del Id. de Sec. Nº 6.
5. La utilización de acuerdo con cualquiera de las reivindicaciones precedentes en las que el miembro de unión comprende uno o más CDR del anticuerpo, o un fragmento del mismo, producidos por la línea celular depositada en la ATCC con el número de registro HB9173.
6. La utilización de acuerdo con cualquiera de las reivindicaciones precedentes en la que el miembro de unión es el anticuerpo 79IT/36 producido por la célula de hibridoma depositada en la ATCC con el número de registro HB9173.
7. La utilización de acuerdo con cualquiera de las reivindicaciones 1-6 en la que el miembro de unión comprende al menos una región constante humana.
8. Un miembro de unión, que se une tanto a SCR1 como a SCR2 de CD55, en el que el miembro de unión no se une a ningún agente con propiedades antitumorales, y un agente activo como una preparación combinada para su utilización simultánea, separada o secuencial en el tratamiento del cáncer, en el que dicho agente activo es un agente quimioterapéutico, un agente calmante del dolor o un antiemético.
9. La preparación combinada de acuerdo con la reivindicación 8, en la que dicho agente activo es doxorubicina, taxol, 5-fluorouracilo, irinotecano o cisplatino.
10. La preparación combinada de acuerdo con la reivindicación 8, en la que dicho agente activo es un anticuerpo.
11. La preparación combinada de acuerdo con la reivindicación 10, en la que dicho agente activo es un anticuerpo anti-CD20; un anticuerpo anti-VEGF; un anticuerpo anti-CD171A; un mAb antiidiotípico anti-CEA; un mAb antiidiotípico anti-HMFG; un anticuerpo anti-EGFR o un anticuerpo anti-HER2.
12. La preparación combinada de acuerdo con cualquiera de las reivindicaciones 8-11, en la que el miembro de unión es un anticuerpo o un fragmento del mismo.
13. Una composición farmacéutica para el tratamiento del cáncer, en la que la composición comprende (i) un miembro de unión que se une tanto a la SCR1 como SCR2 de CD55 pero no se une a ningún agente con propiedades antitumorales y (ii) un excipiente, diluyente o transportador farmacéuticamente aceptable.
14. La composición farmacéutica de acuerdo con la reivindicación 13, en la que el miembro de unión es un anticuerpo o un fragmento del mismo.
15. Un método ex vivo de neutralizar la activación de la actividad inhibidora del complemento de CD55, que comprende proveer un miembro de unión que específicamente se une a la SCR1 y SCR2 de CD55, en el que, en su utilización, el miembro de unión no se une a ningún agente con propiedades antitumorales.
16. Un método ex vivo de potenciar la fijación del complemento, lo que comprende proveer un miembro de unión que se une específicamente a la SCR1 y SCR2 de CD55, en el que, en su utilización, el miembro de unión no se une a ningún agente con propiedades antitumorales.
17. Un método ex vivo para tratar el cáncer, que comprende proveer una cantidad terapéuticamente efectiva de un miembro de unión que se une específicamente a la SCR1 y SCR2 de CD55 de una célula tumoral, en el que, en su utilización, el miembro de unión no se une a ningún agente con propiedades antitumorales.
18. Un método ex vivo de acuerdo con cualquiera de las reivindicaciones 15-17, en el que el miembro de unión es un anticuerpo o un fragmento del mismo.
19. La preparación combinada de acuerdo con cualquiera de las reivindicaciones 8-12, en el que el miembro de unión se une a los aminoácidos 4-12 de la SCR1 del Id. de Sec. Nº 1 y los aminoácidos 9-20 de la SCR2 del Id. de Sec. Nº 5 y los aminoácidos 4-16 del Id. de Sec. Nº 6.
20. La preparación combinada de acuerdo con cualquiera de las reivindicaciones 8-12 o la reivindicación 19, en la que el miembro de unión comprende una o más de las CDR del anticuerpo, o un fragmento del mismo, producida a partir de la línea celular depositada en la ATCC con el número de registro HB9173.
21. La preparación combinada de acuerdo con cualquiera de las reivindicaciones 8-12 o cualquiera de las reivindicaciones 19-20, en la que el miembro de unión es el anticuerpo 79IT/36 producido por la célula de hibridoma depositada en la ATCC con el número de registro HB9173.
22. La preparación combinada de acuerdo con cualquiera de las reivindicaciones 8-12 o cualquiera de las reivindicaciones 19-21, en la que el miembro de unión comprende al menos una región constante humana.
23. La composición farmacéutica de acuerdo con la reivindicación 13 o reivindicación 14, en la que el miembro de unión se une a los aminoácidos 4-12 de SCR1 de Id. de Sec. Nº 1, los aminoácidos de SCR2 y los aminoácidos 4-16 del Id. de Sec. Nº 6.
24. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 13, 14 o 23, en la que el miembro de unión comprende una o más de las CDR del anticuerpo, o un fragmento del mismo, producida a partir de la línea celular depositada en la ATCC con el número de registro HB9173.
25. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 13-14, o las reivindicaciones 23-24, en la que el miembro de unión es el anticuerpo 79IT/36 producido por la célula de hibridoma depositada en la ATCC con el número de registro HB9173.
26. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 13-14, o las reivindicaciones 23-25, en la que el miembro de unión comprende al menos una región constante humana.
27. El método ex vivo de acuerdo con cualquiera de las reivindicaciones 15-18, en el que el miembro de unión se une a los aminoácidos 4-12 de la SCR1 del Id. de Sec. Nº 1, los aminoácidos 9-20 de SCR2 del Id. de Sec. Nº 5 y los aminoácidos 4-16 del Id. de Sec. Nº 6.
28. El método ex vivo de acuerdo con cualquiera de las reivindicaciones 15-18 o reivindicación 27, en el que el miembro de unión comprende una o más CDR del anticuerpo, o un fragmento del mismo, producidas a partir de la línea celular depositada en la ATCC con el número de registro HB9173.
29. El método ex vivo de acuerdo con cualquiera de las reivindicaciones 15-18 o cualquiera de las reivindicaciones 27-28, en el que el miembro de unión es el anticuerpo 79IT/36 producido por la célula de hibridoma depositada en la ATCC con el número de registro HB7193.
30. El método ex vivo de acuerdo con cualquiera de las reivindicaciones 15-18 o cualquiera de las reivindicaciones 27-28, en el que el miembro de unión comprende al menos una región constante humana.
31. Un miembro de unión que se une tanto a la SCR1 como SCR2 de CD55 o un ácido nucleico que codifica dicho miembro de unión para su utilización en el tratamiento del cáncer, en el que el miembro de unión no se une a ningún agente con propiedades antitumorales.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Método para purificar anticuerpos, del 8 de Julio de 2020, de UNITED THERAPEUTICS CORPORATION: Método para purificar una composición biológica, que comprende someter a diafiltración la composición biológica con solución salina tamponada con fosfato (PBS) para […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Conjugados fármaco-anticuerpo anti-lrrc15 humano y métodos para su uso, del 17 de Junio de 2020, de AbbVie Inc: Un conjugado de farmaco-anticuerpo anti-huLRRC15 ("ADC") que comprende un agente antimitotico unido a un anticuerpo anti-huLRRC15 por medio de un conector, en donde […]
Cadenas ligeras comunes y procedimientos de uso, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una molécula de unión a antígeno biespecífica activadora de linfocitos T que comprende un primer y un segundo resto de unión a antígeno, en la que el primer resto […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo anti-CD3 que es un anticuerpo biespecífico, en donde el anticuerpo biespecífico comprende un brazo anti-CD3 que comprende un primer dominio de unión que […]