NUEVO PROCEDIMIENTO DE PREPARACION DE LERCANIPIDINA.
Un procedimiento de preparación de lercanidipina de fórmula I:
Tipo: Resumen de patente/invención. Número de Solicitud: W05000198IN.
Solicitante: HETERO DRUGS LIMITED.
Nacionalidad solicitante: India.
Dirección: HETERO HOUSE 8-3-166/7/1, ERRAGADDA,HYDERABAD, ANDHRAPRADESH. HYDE.
Inventor/es: MURALIDHARA REDDY,DASARI,HETERO DRUGS LTD R & D, PARTHASARADHI REDDY,BANDI, RATHNAKAR REDDY,KURA HETERO DRUGS LTD., RAJI REDDY,RAPOLU HETERO DRUGS LTD., SATISH KUMAR,DANDAMUDI,HETERO DRUGS LIMITED.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07D211/90 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Clasificación PCT:
- C07D211/02 C07D 211/00 […] › Preparación por ciclación o hidrogenación.
- C07D211/90 C07D 211/00 […] › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Fragmento de la descripción:
Nuevo procedimiento de preparación de lercanipidina.
Campo técnico
La presente proporciona un nuevo procedimiento para la preparación de lercanipidina y sales de lercanipidina de adición de ácido de alta pureza; y solvatos e hidratos de las mismas en menor tiempo de reacción con rendimiento mejorado.
Antecedentes de la invención
La patente de EE.UU. Nº. 4.705.797 divulgó diésteres asimétricos nuevos de ácido 1,4-dihidro-2,6-dimetil-piridina-3,5-dicarboxílico, formas estereoquímicamente isómeras y sales farmacéuticamente aceptables de los mismos. Estos compuestos son agentes antihipertensores. Entre ellos, lercanidipina, químicamente 2-[(3,3-difenilpropil)metilamino]-1,1-dimetiletil metil éster de ácido 1,4-dihidro-2,6-dimetil-4-(3-nitrofenil)-3,5-piridindicarboxílico es un antagonista del tipo-L de canales de calcio, y se ha encontrado que es muy activo como antihipertensor y como agente para el tratamiento de angina y enfermedad coronaria. Lercanidipina se representa por la siguiente estruc- tura:
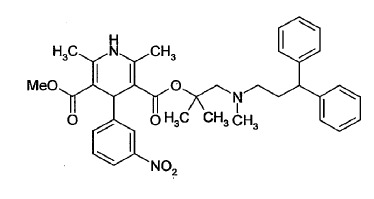
En la patente de EE.UU. Nº. 4.705.797 y en WO 96/35668 A1 se divulgan procedimientos para las preparaciones de lercanidipina y compuestos relacionados.
Según la patente de EE,UU, Nº. 4.705.797 se esterifica 2,N-dimetil-N-(3,3-difenilpropil)-1-amino-2-propanol con diceteno para formar 1,1,N-trimetil-N-(3,3-difenilpropil)-2-amino-2-propanol, que se acopla a continuación con 3-nitrobenzaldehído para dar 1,1,N-trimetil-N-(3,3-difenilpropil)-2-aminoetil-a-acetil-3-nitrocinamato, a lo que sigue ciclación con 3-aminocrotonato de metilo en isopropanol a reflujo para dar hidrocloruro de lercanidipina hemihidrato. El rendimiento de lercanidipina obtenido según el procedimiento descrito en la patente de EE,UU, Nº. 4.705.797 es escaso y el procedimiento implica purificaciones cromatográficas en columna. Los métodos que implican purificaciones cromatográficas en columna no se pueden usar para operaciones a gran escala, lo que hace al procedimiento no viable comercialmente.
Según el documento WO 96/35668, se halogena ácido 2,6-dimetil-5-metoxicarbonil-4-(3-nitrofenil)-1,4-dihidropiridina-3-carboxílico con un agente halogenante en un disolvente aprótico, a lo que sigue tratamiento con 2,N-dimetil-N-(3,3-difenilpropil)-1-amino-2-propanol en un disolvente aprótico y se aísla la lercanidipina resultante como su hidrocloruro anhidro. Este procedimiento implica condensación directa de 2,N,-dimetil-N-(3,3-difenilpropil)-1-amino-2-propanol con cloruro de 2,6-dimetil-5-metoxicarbonil-4-(3-nitrofenil)-1,4-dihidropiridina-3-carbonilo.
La reacción requiere más tiempo para terminarse y el rendimiento obtenido no es satisfactorio.
La presente invención es un procedimiento comercialmente viable, mejorado, que resuelve los problemas anteriormente expuestos que se asocian con el procedimiento descrito en la técnica anterior.
El objeto de la presente invención es proporcionar un procedimiento para preparar lercanidipina y sales de lercanidipina de adición de ácido farmacéuticamente aceptables; y solvatos e hidratos de las mismas de alta pureza y alto rendimiento usando nuevos compuestos intermedios con menor tiempo de reacción.
Resumen de la invención
Según la presente invención, se proporciona un procedimiento mejorado para preparar lercanidipina de fórmula I:
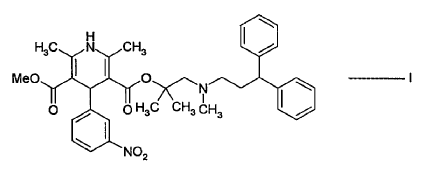
o una sal de la misma farmacéuticamente aceptable:
que comprende:
- a) hacer reaccionar el alcohol de fórmula II:

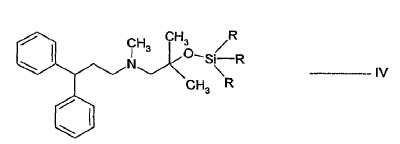
- b) hacer reaccionar el alcohol sililado de fórmula IV con el cloruro de ácido de fórmula V:
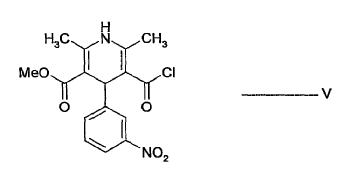
para dar lercanidipina de fórmula I y opcionalmente lercanidipina convertida que se forma en sales de lercanidipina de adición de ácido farmacéuticamente aceptables.
Los compuestos de sililo de la fórmula IV son nuevos y forman parte de la invención.
Descripción detallada de la invención
Según la presente invención, se proporciona un procedimiento mejorado para preparar lercanidipina de fórmula I:
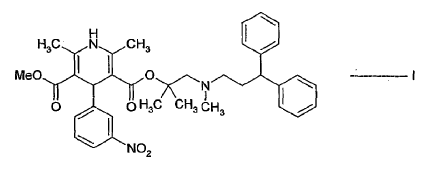
o una sal de la misma farmacéuticamente aceptable;
que comprende:
- a) hacer reaccionar el alcohol de fórmula II:
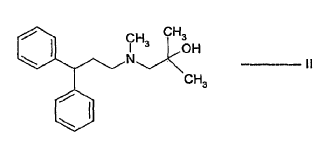
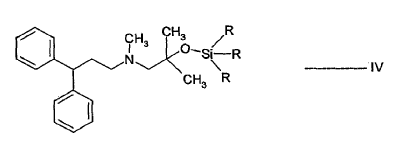
- b) hacer reaccionar el alcohol sililado de fórmula IV con el cloruro de ácido de fórmula V:
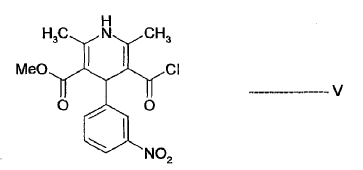
para dar lercanidipina de fórmula I y opcionalmente lercanidipina convertida que se forma en sales de lercanidipina de adición de ácido farmacéuticamente aceptables.
Preferiblemente R es independientemente metilo o etilo y más preferiblemente R es metilo.
El disolvente aprótico se selecciona preferiblemente entre disolventes clorados tales como cloruro de metileno, cloruro de etileno y cloroformo; y disolventes de hidrocarburos tales como n-hexano y ciclohexano. El disolvente más preferible es cloruro de metileno o n-heptano.
La reacción en la etapa (a) se lleva a cabo en presencia de una base orgánica, preferiblemente aminas tales como trietilamina, trimetilamina o N,N-diisopropiletil amina, y más preferiblemente trietilamina.
La reacción se lleva a cabo preferiblemente de -10ºC a 0ºC, más preferiblemente de -5ºC a 0ºC.
La sililación se termina normalmente en menos de 5 horas, habitualmente de 1 hora 30 minutos a 3 horas.
Los compuestos de sililo de la fórmula IV son nuevos y forman parte de la invención.
Son preferibles los compuestos de fórmula IV en los que R es independientemente metilo o etilo. El compuesto de fórmula IV, en el que R es metilo es más preferible.
La reacción (etapa b) del compuesto de sililo de fórmula IV con el cloruro de ácido de fórmula V se termina normalmente en menos de 5 horas, habitualmente 1 hora 30 minutos a 3 horas.
El medio de reacción de la etapa (a) que contiene el compuesto de sililo preferiblemente se puede usar directamente, o el compuesto de sililo se puede aislar del medio de reacción por ejemplo destilando el disolvente y se puede usar luego en la etapa (b).
El medio de reacción obtenido convirtiendo el correspondiente ácido carboxílico de fórmula V en cloruro de ácido mediante procedimientos conocidos se puede usar como fuente del cloruro de ácido de fórmula V. La reacción se lleva a cabo preferiblemente a 0 - 80ºC y más preferiblemente a 0 - 40ºC.
La reacción se termina normalmente dentro de 4 horas, habitualmente menos de 4 horas, habitualmente dentro de 2 horas. Después de que se termina la reacción, la masa de reacción se lava con agua para eliminar subproductos y sales, se cristaliza...
Reivindicaciones:
1. Un procedimiento de preparación de lercanidipina de fórmula I:
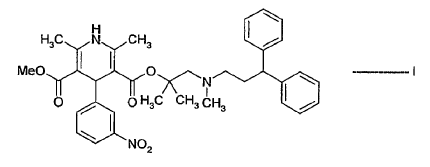
o una sal de la misma farmacéuticamente aceptable;
que comprende:
- a) hacer reaccionar el alcohol de fórmula II:
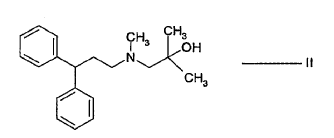
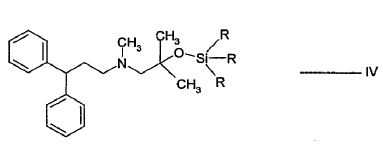
- b) hacer reaccionar el alcohol sililado de fórmula IV con el cloruro ácido de fórmula V:
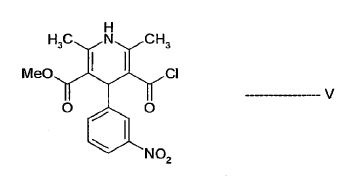
para dar lercanidipina de fórmula I y opcionalmente lercanidipina convertida que se forma en sales de lercanidipina de adición de ácido farmacéuticamente aceptables.
2. El procedimiento según la reivindicación 1, en el que la etapa (a) se lleva a cabo en presencia de una base orgánica.
3. El procedimiento según la reivindicación 2, en el que la base orgánica es una amina.
4. El procedimiento según la reivindicación 3, en el que la amina es trietilamina, trimetilamina o N,N-diisopropiletil amina.
5. El procedimiento según la reivindicación 4, en el que la amina es trietilamina.
6. El procedimiento según la reivindicación 1, en el que el disolvente aprótico es un disolvente clorado o un disolvente de hidrocarburo.
7. El procedimiento según la reivindicación 6, en el que el disolvente clorado se selecciona entre cloruro de metileno y cloroformo.
8. El procedimiento según la reivindicación 7, en el que el disolvente clorado es cloruro de metileno.
9. El procedimiento según la reivindicación 6, en el que el disolvente de hidrocarburo se selecciona entre n-hexano, ciclohexano y n-heptano.
10. El procedimiento según la reivindicación 9, en el que el disolvente de hidrocarburo es n-hexano.
11. El procedimiento según la reivindicación 1, en el que la reacción de sililación se lleva a cabo de -10ºC a 0ºC.
12. El procedimiento según la reivindicación 11, en el que la reacción de sililación se lleva a cabo de -5ºC a 0ºC.
13. El procedimiento según la reivindicación 1, en el que la R de la fórmula III es independientemente metilo o etilo.
14. El procedimiento según la reivindicación 13, en el que la R es metilo.
15. El procedimiento según la reivindicación 1, en el que la X es Cl.
16. El procedimiento según la reivindicación 1, en el que la etapa (b) se lleva a cabo en un disolvente aprótico.
17. El procedimiento según la reivindicación 16, en el que el disolvente aprótico es un disolvente clorado o un disolvente de hidrocarburo.
18. El procedimiento según la reivindicación 17, en el que el disolvente clorado es cloruro de metileno o cloroformo.
19. El procedimiento según la reivindicación 18, en el que el disolvente clorado es cloruro de metileno.
20. El procedimiento según la reivindicación 17, en el que el disolvente de hidrocarburo es n-hexano, ciclohexano o n-heptano.
21. El procedimiento según la reivindicación 1, en el que la etapa (b) se lleva a cabo a 0-80ºC.
22. El procedimiento según la reivindicación 21, en el que la reacción se lleva a cabo a 0-40ºC.
23. Compuesto de fórmula IV:
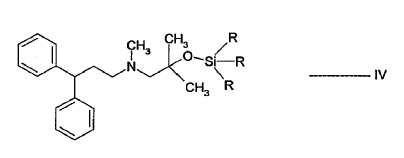
en la que R es alquilo.
24. El compuesto de la reivindicación 23, en el que R es independientemente metilo o etilo.
25. El compuesto de la reivindicación 24, en el que R es metilo.
Patentes similares o relacionadas:
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter, del 20 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter. Derivados de 4-fenildihidropiridina de fórmula […]
Clorhidrato de lercanidipino amorfo, del 13 de Noviembre de 2019, de RECORDATI IRELAND LIMITED: Hidrocloruro de lercanidipino amorfo que presenta una pureza de por lo menos el 95%.
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 13 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero o una sal farmaceuticamente aceptable, en la que: indica un enlace simple […]
Arilhidrazidas que contienen una fracción de 2-piridona como agentes antibacterianos selectivos, del 29 de Octubre de 2018, de ABAC THERAPEUTICS, S.L: Un compuesto de la fórmula (I): **Fórmula** una sal, solvato, isótopo, polimórfo o tautómero farmacéuticamente aceptable del mismo, en donde A es […]
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 18 de Mayo de 2016, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable o un solvato del mismo, en la que: […]
Preparación de dihidropiridinas, del 10 de Febrero de 2016, de LABORATORIOS LESVI, S.L.: Un proceso para la preparación de butirato de clevidipina que comprende la etapa: (i) hacer reaccionar un compuesto de fórmula (I): **Fórmula** […]
 Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]
Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]