Medición de una población de ácidos nucléicos, en particular mediante PCR en tiempo real.
Procedimiento de medición de la cantidad de ácidos nucleicos de una secuencia diana en una muestra de interés,
que comprende las etapas de:
a. someter la muestra de interés a un tratamiento de amplificación, con un lote de reactivos que comprenden al menos un marcador de ácido (s) nucleico (s) específico para dicha secuencia diana, dicho tratamiento de amplificación que comprende ciclos de amplificación sucesivos, i; de 1 a n,
b. medir una magnitud física Fi representativa de la evolución del marcador durante al menos una parte de los ciclos de amplificación,
c. expresar un parámetro F0 representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación, utilizando las mediciones llevadas a cabo en la etapa b.,
d. estimar el número inicial N0mues. de ácido (s) nucleico (s) de la secuencia diana utilizando una ley de conversión, que comprende parámetros contextuales, y aplicada a dicho parámetro F0 expresado en la etapa c, .
caracterizado porque:
- en la etapa d., dichos parámetros contextuales son unos parámetros de referencia pre-registrados, siendo estos parámetros sensiblemente independientes de al menos una parte de las condiciones experimentales, y estando determinados de antemano a partir del comportamiento de al menos una muestra de referencia del mismo formato biológico que la muestra de interés y el número inicial conocido N0ref de ácido (s) nucleico (s) .
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2008/001488.
Solicitante: BIO-RAD PASTEUR.
Nacionalidad solicitante: Francia.
Dirección: 3, BOULEVARD RAYMOND POINCARÉ 92430 MARNES-LA-COQUETTE FRANCIA.
Inventor/es: JAHAN,Virginie, KAMlNSKI,Karine.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G06F19/00
- G06F19/10
PDF original: ES-2380278_T3.pdf
Fragmento de la descripción:
Medición de una población de ácidos nucléicos, en particular mediante pcr en tiempo real La presente invención se refiere a un procedimiento de medición de una cantidad inicial de ácidos nucleicos contenidos en una muestra de interés y sometida a una amplificación. La invención encuentra especialmente una aplicación ventajosa en el seguimiento terapéutico de las enfermedades infecciosas, pero también en el ámbito de la genética y de la oncología, y de un modo más general, cualquiera que sea el ámbito de aplicación, como por ejemplo el ámbito veterinario, el agroalimentario, y el ámbito vegetal.
El ámbito en cuestión es el de las técnicas de amplificación génica que permiten determinar una cantidad inicial de una secuencia de ácidos nucleicos de interés presentes en una muestra y especialmente las técnicas de amplificación que permiten la cuantificación en tiempo real, como la técnica de la PCR (reacción en cadena de la polimerasa, en inglés "Polymerase Chain Reaction") en tiempo real, por ejemplo.
La presente invención encuentra una aplicación ventajosa pero no limitante en la determinación de la cantidad inicial de ácidos nucleicos en una muestra sometida a una reacción de PCR en tiempo real para evaluar el número de copias de ácidos nucleicos de agentes infecciosos (virus, bacterias, levaduras, etc.) presentes en una muestra biológica (suero, plasma, sangre, expectoraciones, etc.) . Esta técnica puede funcionar con ADN o ARN. Aquí se hará referencia en general, y salvo indicación contraria, al ADN, sin estar restringida a este ácido nucleico.
La PCR hace intervenir unas variaciones de temperatura que permiten la disociación del ADN en dos cadenas ("desnaturalización") , y la hibridación de un cebador sobre cada cadena del ADN desnaturalizado. Cada cebador es pues pues específico, y complementario de una de las dos cadenas del ADN. La acción de una ADN polimerasa da lugar a la síntesis de nuevas cadenas complementarias de cada cadena utilizada inicialmente como matriz. Esto constituye una serie de etapas de "desnaturalización / hibridación / síntesis de cadenas", que se repite cíclicamente.
La PCR en tiempo real es una técnica que permite la amplificación y detección simultánea de una o varias secuencias diferentes de ácidos nucleicos diana. La detección se puede llevar a cabo a lo largo del tiempo y puede ser cuantitativa.
La técnica de la PCR cuantitativa en tiempo real hace intervenir uno o varios marcadores de ADN, por ejemplo fluorescentes, que permiten la cuantificación de la secuencia nucléica (o las secuencias nucleicas) a detectar. En general esta técnica utiliza la comparación de la muestra a analizar con un patrón, o con una gama de patrones. Un patrón es una muestra que contiene una cantidad conocida de ácidos nucleicos. En principio se somete a los mismos tratamientos que la muestra a analizar. Tanto para la muestra de interés como para el patrón, la fluorescencia varía proporcionalmente con la cantidad de ácidos nucleicos presentes en la muestra antes y durante la reacción. Esto se explicará de manera detallada más adelante en la siguiente descripción.
Por otra parte, la PCR cuantitativa en tiempo real se desarrolla en varias fases, en las que las dinámicas de reacción son diferentes, como se verá a continuación. Por consiguiente, en general se utilizan varios puntos de medición, con el fin de realizar un seguimiento de la dinámica de reacción.
Todo esto hace que las técnicas de PCR en tiempo real para la cuantificación de una muestra de interés sean difíciles de poner en práctica, lo cual afecta a la generalización de su utilización, en el caso de que su interés sea manifiesto.
La presente invención permite mejorar la situación.
Para este fin, la invención viene a introducir un procedimiento de medición de la cantidad de ácidos nucleicos de una secuencia diana en una muestra de interés, que comprende las etapas de:
a. Someter la muestra de interés a un tratamiento de amplificación, con un lote de reactivos que comprenden al menos un marcador de ácido (s) nucleico (s) específico para dicha secuencia diana, comportando dicho tratamiento de amplificación unos ciclos de ampliación sucesivos (i; de 1 a n) ,
b. Medir una magnitud física (Fi) representativa de la evolución del marcador durante al menos una parte de los ciclos de amplificación,
c. Expresar un parámetro (F0) representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación, utilizando las mediciones tomadas en la etapa b.,
d. Estimar el número inicial (N0mues.) de ácido (s) nucleico (s) de la secuencia diana con la ayuda de una ley de conversión, que comprende unos parámetros contextuales, y aplicada a dicho parámetro (F0) expresado en la etapa c.,
En la etapa d., dichos parámetros contextuales son los parámetros de referencia pre-registrados, son parámetros sensiblemente independientes de al menos una parte de las condiciones experimentales.
Los parámetros de referencia anteriormente mencionados se determinan de antemano basándose en el comportamiento de al menos una muestra de referencia del mismo formato biológico que la muestra de interés y del número inicial conocido N0ref de ácido (s) nucleico (s) .
Según un modo de realización, la ley de conversión de la etapa d., se puede aplicar directamente, sin necesidad de corrección para la ejecución en paralelo de las etapas a., b. y c. para al menos un calibrador.
Este modo de realización simplifica por tanto la puesta en práctica del procedimiento para el operario final reduciendo los tiempos de funcionamiento y también da lugar a una reducción significativa de los costes de los reactivos, no despreciables, especialmente en el ámbito de la salud pública. Además, gracias a los parámetros de referencia pre-registrados, se evita una manipulación de elementos que habitualmente acompañan a una reacción de amplificación. En particular se evita la utilización de muestras patrón, lo que permite aumentar el número de pocillos disponibles para someter a ensayo las muestras a analizar (ganancia de espacio) .
Otro modo de realización prevé que la etapa d. comprenda una corrección del número inicial (N0mues.) estimado. Esta corrección se funda en una ejecución de antemano de las etapas a., b. y c. para al menos un calibrador (EQC) del número inicial de ácido (s) nucleico (s) y del parámetro (F0EQC) representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación conocido.
Esta corrección del número inicial (N0mues.) estimado se puede llevar a cabo mediante las siguientes etapas:
- establecer una ley correctora entre:
• dicho parámetro conocido (F0EQC) representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación, en primer lugar y,
• el parámetro expresado efectivamente (F0EQCmedido) representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación por el calibrador,
- aplicar dicha ley correctora a la citada ley de conversión que comporta los parámetros contextuales de la etapa d., para la estimación de dicho número inicial (N0mues.) de ácido (s) nucleico (s) de la secuencia diana presente en el muestra de interés.
Para la corrección anteriormente mencionada, el calibrador (EQC) de un número inicial conocido se funda en una sustancia biológica capaz de formar un control positivo para la muestra de interés.
En este modo de realización, la corrección no genera pues la adición de tubos de reacción suplementarias, lo cual es ventajoso en relación a las técnicas de cuantificación conocidas de la técnica anterior.
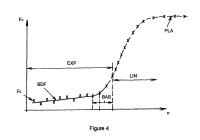
En la etapa c. del procedimiento la expresión del parámetro (F0) hace intervenir al menos:
- un parámetro relativo a la basculación entre una primera fase de rendimiento de amplificación constante y una segunda fase de rendimiento de amplificación no constante,
- un parámetro relativo al rendimiento de amplificación constante en dicha primera fase, y
- un parámetro relativo al rendimiento de amplificación no-constante en dicha segunda fase. El marcador de ácidos nucleicos puede ser un marcador fluorescente. La muestra de interés puede ser una muestra biológica susceptible
de comprender un agente patógeno. La reacción de amplificación utilizada puede ser una... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de medición de la cantidad de ácidos nucleicos de una secuencia diana en una muestra de interés, que comprende las etapas de:
a. someter la muestra de interés a un tratamiento de amplificación, con un lote de reactivos que comprenden al menos un marcador de ácido (s) nucleico (s) específico para dicha secuencia diana, dicho tratamiento de amplificación que comprende ciclos de amplificación sucesivos, i; de 1 a n,
b. medir una magnitud física Fi representativa de la evolución del marcador durante al menos una parte de los ciclos de amplificación,
c. expresar un parámetro F0 representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación, utilizando las mediciones llevadas a cabo en la etapa b.,
d. estimar el número inicial N0mues. de ácido (s) nucleico (s) de la secuencia diana utilizando una ley de conversión, que comprende parámetros contextuales, y aplicada a dicho parámetro F0 expresado en la etapa c, .
caracterizado porque:
- en la etapa d., dichos parámetros contextuales son unos parámetros de referencia pre-registrados, siendo estos parámetros sensiblemente independientes de al menos una parte de las condiciones experimentales, y estando determinados de antemano a partir del comportamiento de al menos una muestra de referencia del mismo formato biológico que la muestra de interés y el número inicial conocido N0ref de ácido (s) nucleico (s) .
2. Procedimiento según la reivindicación 1, caracterizado porque la ley de conversión en la etapa d. se aplica directamente, sin la necesidad de corrección por la ejecución en paralelo de las etapas a., b. y c. para al menos un calibrador.
3. Procedimiento según la reivindicación 1, caracterizado porque la etapa d. comprende además una corrección del número inicial estimado N0mues., estando esta corrección basada en una ejecución de antemano de las etapas a., b. y
c. para al menos un calibrador EQC de número inicial conocido de ácido (s) nucleico (s) y del parámetro conocido F0EQC representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquier ciclo de amplificación.
4. Procedimiento según la reivindicación 3, caracterizado porque la corrección del número inicial estimado N0mues. comprende las etapas de:
- establecer una ley correctora entre:
• dicho parámetro conocido N0EQC representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cada ciclo de amplificación, en primer lugar y,
• el parámetro efectivamente expresado N0EQCmedido representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cada ciclo de amplificación del calibrador,
- aplicar dicha ley correctora a la citada ley de conversión que comprende los parámetros contextuales de la
mues.
etapa d., con el fin de estimar dicho número inicial N0 de ácido (s) nucleico (s) en la secuencia diana, presente (s) en la muestra de interés.
5. Procedimiento según una cualquiera de las reivindicaciones 3 ó 4, caracterizado porque dicho calibrador EQC de número inicial conocido se basa en una sustancia biológica capaz de formar un control positivo para la muestra de interés.
6. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la expresión del parámetro F0 hace intervenir al menos:
- un parámetro relativo al basculamiento entre una primera fase de rendimiento de amplificación constante y una segunda fase de rendimiento de amplificación no constante,
- un parámetro relativo al rendimiento de amplificación constante durante dicha primera fase, y
- un parámetro relativo al rendimiento de amplificación no constante durante dicha fase segunda.
7. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque el marcador de ácidos nucleicos es un marcador fluorescente.
8. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la muestra de interés comprende una extracción biológica, susceptible de comprender un agente patógeno.
9. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la reacción de amplificación es una reacción en cadena de la polimerasa, PCR, en tiempo real.
10. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque dichos parámetros de referencia son independientes de al menos uno de los elementos del grupo de condiciones experimentales siguientes: aparato utilizado, tipo de aparato utilizado, operario, período de validez del lote de reactivos, modo de extracción de los ácidos nucleicos de la secuencia diana.
11. Procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la muestra de interés comprende varias secuencias diana distintas.
12. Aparato (AP) para medir la cantidad de ácidos nucleicos de al menos una secuencia diana en una muestra de interés, que comprende:
a. un elemento de soporte (U.SUP) para soportar al menos una muestra (PROBE) que comprende un lote de reactivos y la secuencia diana con al menos un marcador de ácido (s) nucleico (s) específico para dicha secuencia diana,
b. una unidad de amplificación (U.AMP) para someter la muestra de interés a un tratamiento de amplificación que comprende unos ciclos de amplificación sucesivos, i; de 1 a n,
c. una unidad de medición (U.MES) para medir una magnitud física Fi representativa de la evolución de dicho marcador durante al menos una parte de los ciclos de amplificación,
d. una unidad de procesamiento (U.TRT) que comprende una memoria y organizada para:
iii. expresar un parámetro F0 representativo de la magnitud física del marcador de ácido (s) nucleico (s) antes de cualquiera de los ciclos de amplificación, sobre la base de mediciones de la magnitud física,
mues.
iv. estimar el número inicial N0 de ácido (s) nucleico (s) de una secuencia diana presente en la muestra de interés utilizando una ley de conversión, sobre la base de parámetros contextuales, y aplicada a dicho parámetro F0, e. un controlador (CNTR) organizado de tal manera que, cuando una muestra de interés (PROBE) es recibido en el elemento de soporte (U.SUP) , para la aplicación de la unidad de amplificación (U.AMP) y la unidad de medición (U.MES) a dicha muestra (PROBE) recibida, y para hacer una llamada a la unidad de tratamiento (U.TRT) con las mediciones obtenidas por dicha unidad de medición (U.MES) , caracterizado porque dichos parámetros contextuales son unos parámetros de referencia sensiblemente independientes de al menos una parte de las condiciones experimentales y están pre-registrados en la unidad de tratamiento (U.TRT) , y que se determinan de antemano a partir del comportamiento de al menos una muestra de referencia del mismo formato biológico que la muestra de interés y del número inicial conocido N0ref de ácido (s) nucleico (s) .
13. Producto de programa de ordenador que comprende las instrucciones para la puesta en práctica del procedimiento según una cualquiera de las reivindicaciones 1 a 11, y destinado a ser almacenado en la memoria de la unidad de tratamiento (U.TRT) en el aparato (AP) , según la reivindicación 12.
14. Soporte para el almacenamiento de datos, caracterizado porque comprende las instrucciones para la puesta en práctica del procedimiento según una cualquiera de las reivindicaciones 1 a 11.
DOCUMENTOS INDICADOS EN LA DESCRIPCIÓN
En la lista de documentos indicados por el solicitante se ha recogido exclusivamente para información del lector, y no es parte constituyente del documento de patente europeo. Ha sido recopilada con el mayor cuidado; sin embargo, la EPA no asume ninguna responsabilidad por posibles errores u omisiones.
Documentos de patente indicados en la descripción
Literatura no citada en la descripción
Patentes similares o relacionadas:
Sistemas y métodos para tratar, diagnosticar y predecir la aparición de una afección médica, del 15 de Julio de 2020, de Fundação D. Anna Sommer Champalimaud E Dr. Carlos Montez Champalimaud: Aparato para evaluar si es probable que un paciente tenga un estadio patológico favorable de cáncer de próstata, el aparato comprende: (a) un dispositivo de obtención […]
Dispositivo de procesamiento de datos para el procesamiento de valores de medición, del 22 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Dispositivo de procesamiento de datos para el procesamiento de valores de medición de un equipo de medición médico, con una unidad de entrada , una […]
Sistema de análisis apuntador de acontecimientos y de gestión de medicación, del 30 de Octubre de 2019, de CAREFUSION 303, INC: Un método para reducir el riesgo de errores de medicación, el método comprende las etapas de: recibir en un dispositivo móvil un primer valor de un parámetro […]
Sistema y método de visualización en 2D y 3D para la inspección de un tubo de horno, del 11 de Septiembre de 2019, de Quest Integrity USA, LLC: Un sistema para la visualización de datos de inspección recogidos de un horno con una geometría física especificada, en donde dicho horno comprende […]
 Reconocimiento anatómico y análisis dimensional para asistir en la cirugía de mama, del 25 de Julio de 2019, de ALLERGAN, INC.: Método implementado por ordenador de determinación de mediciones de la mama de manera automática a partir de una representación tridimensional (3-D) de la parte superior […]
Reconocimiento anatómico y análisis dimensional para asistir en la cirugía de mama, del 25 de Julio de 2019, de ALLERGAN, INC.: Método implementado por ordenador de determinación de mediciones de la mama de manera automática a partir de una representación tridimensional (3-D) de la parte superior […]
Sistemas y métodos para tratar, diagnosticar y predecir la aparición de una afección médica, del 24 de Julio de 2019, de Fundação D. Anna Sommer Champalimaud E Dr. Carlos Montez Champalimaud: Un aparato para evaluar un riesgo de fallo clínico en un paciente después de que el paciente se haya sometido a una prostatectomía radical, y el aparato […]
 Aparato médico controlado remotamente, del 24 de Julio de 2019, de GAMBRO LUNDIA AB: Una unidad de diálisis adaptada para tratar la sangre de un paciente (P) según una terapia prescrita, la unidad de diálisis presenta una interfaz inalámbrica […]
Aparato médico controlado remotamente, del 24 de Julio de 2019, de GAMBRO LUNDIA AB: Una unidad de diálisis adaptada para tratar la sangre de un paciente (P) según una terapia prescrita, la unidad de diálisis presenta una interfaz inalámbrica […]
Interfaces de usuario gráficas (IUG), procedimientos y aparato para la presentación de datos, del 10 de Julio de 2019, de DUNE MEDICAL DEVICES LTD.: Un sistema de análisis de sustrato, comprendiendo el sistema: (a) una sonda que está configurada y operable para explorar un sustrato y determinar uno o más parámetros […]