COMPOSICIONES FARMACEUTICAS DE AGENTES ESTROGENICOS.
Composición farmacéutica que comprende, en peso:
a) de 0,1 a 25% de 1-[4-(2-azepan-1il-etoxi)bencil]-2-(4-hidroxifenil)-3-metil-1H-indol-5-ol o 2-[4-hidroxifenil)-3-metil-1-(4-(2-piperidin-1-il-etoxi)bencil]-1H-indol-5-ol,
o una sal farmacéuticamente aceptable de los mismos;
b) de 20% a aproximadamente 80% de lactosa;
c) de 4% a aproximadamente 40% de almidón pregelatinizado;
d) de 0,2% a aproximadamente 5% de laurilsulfato sódico;
e) de aproximadamente 0,5% a aproximadamente 15% de ácido ascórbico;
f) de 0,1% a aproximadamente 10% dióxido de silicio; y
g) de 0,2% a aproximadamente 10% de estearato de magnesio
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US01/20993.
Solicitante: WYETH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE GIRALDA FARMS,MADISON, NEW JERSEY 07940-0874.
Inventor/es: BENJAMIN, ERIC JOEL, DULIN,WENDY,ANN, SURYAWANSHI,JIWAJI,GULABRAO.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/404 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Indoles, p. ej. pindolol.
- A61K47/12 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Acidos carboxílicos; Sus sales o anhídridos.
Clasificación PCT:
- A61K31/404 A61K 31/00 […] › Indoles, p. ej. pindolol.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
Clasificación antigua:
- A61K31/404 A61K 31/00 […] › Indoles, p. ej. pindolol.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
Fragmento de la descripción:
Composiciones farmacéuticas de agentes estrogénicos.
La presente memoria se refiere a composiciones farmacéuticas que utilizan compuestos con actividad como agentes estrogénicos. La presente invención se refiere en particular a nuevas composiciones farmacéuticas orales que comprenden uno o más agentes farmacológicos activos seleccionados de entre TSE-424 y ERA-923, y uno o más portadores o excipientes aceptables.
Antecedentes de la invención
El documento EP 0 802 183 A1 y la patente US nº 5.780.497 describen compuestos de indol sustituidos con la siguiente fórmula general:

así como también su utilización como agentes estrogénicos, incluyendo el tratamiento de la pérdida de hueso, las enfermedades coardiovasculares, las enfermedades asociadas con, o resultantes de la proliferación o el desarrollo anormal del tejido endometrial o semejante al endometrial, y los trastornos o síndromes asociados a la deficiencia de estrógenos.
El documento EP 0 802 184 A1, publicado el 22 de Octubre 1997, describe utilizaciones comparables de los sustitutos de los compuestos de indol de las siguientes fórmulas general:
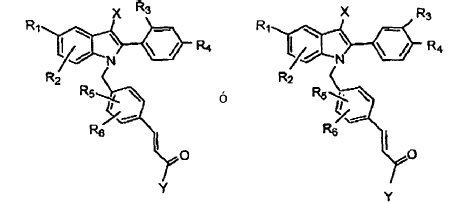
En la patente US nº 5.880.137 (Miller et al.) se describen compuestos de indol semejantes de fórmula general:
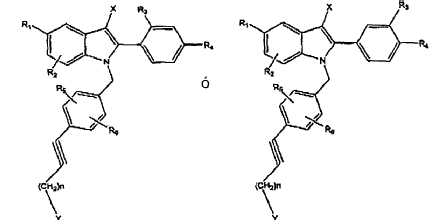
La patente US nº 5.811.120 (Gibson LL et al.), titulada Solid oral administrable raloxifene hydrochloride pharmaceutical formulation
(Eli Lilly and Company), describe una composición y procedimiento para pastillas de clorhidrato de raloxieno que comprenden un tensioactivo que es el éster de ácido graso de sorbitano o éster de ácido graso de polioxietilensorbitano, polivinilpirrolidona (PVP) y un diluyente soluble en agua que es un azúcar poliólico. El raloxifeno es poco soluble en agua. La patente de la composición de Gibson et al. reivindica la inclusión de PVP y un disolvente soluble en agua con el fin de lograr una solubilidad adecuada del raloxifeno.
La patente US nº 5.747.510 (Draper) describe formulaciones farmacéuticas que comprenden raloxifeno en una dosis comprendida entre aproximadamente 55 y aproximadamente 150 mg. La patente US nº 5.747.510 (Gibson et al.) proporciona formulaciones de raloxifeno que utilizan un tensioactivo, polivinilpirrolidona y un diluyente soluble en agua, en particular en las que el tensioactivo es un éster de graso de sorbitano o un éster de ácido graso de polioxietilensorbitano.
La patente US nº 5.510.358 (Palkowitz) y la patente US nº 5.919.800 (Palkowitz) describen la síntesis y la utilización del Arzoxifeno, sus análogos y sus formas de sal, con o sin combinación con estrógeno, para el tratamiento de la osteoporosis, síndrome posmenopáusico, estados patológicos con relación cardiovascular y el cáncer relacionado al estrógeno.
Las patentes US nº 5.332.727 y US nº 5.480.652 dan a conocer la utilización de un antioxidante tal como el ácido ascórbico en una composición farmacéutica con el fin de estabilizar el fármaco. En el caso de las formulaciones de NADH y NADPH, los estabilizantes añadidos a la formulación comprenden NaHCO3 y PVP además de ácido ascórbico y no se añaden a la composición por su efecto antioxidante en sí. En el caso del iboprufeno, el antioxidante debe estar en contacto íntimo con el agente farmacéutico activo antes de su incorporación en la formulación para que logre su efecto protector. Este efecto solamente se necesita en presencia de carbonatos alcalinos en estas formulaciones efervescentes.
El documento WO 96/21656 (Cameron et al.) da a conocer compuestos nuevos, que comprenden CP 336156 y su utilización en el tratamiento o la prevención de la obesidad, el cáncer de mama, la osteoporosis, la endometriosis, las enfermedades cardiovasculares y las enfermedades prostáticas.
Sawicka, J. The influence of excipientes and technological process on cholecalciferol stability and its liberation from tablets
Pharmazie 46 H. 7. :519-521 (1991) describe la estabilización del colecalciferol con múltiples antioxidantes en estado sólido. El mejor sistema de antioxidantes descrito, sin embargo, solamente produjo el 87,6% del contenido original después de 1 año de almacenamiento y la disolución del material activo también fue muy lenta. Por consiguiente, se necesitan mejoras para la estabilización de los fármacos sólidos inestables.
A partir de la técnica anterior, todavía existe la necesidad de mejorar las cualidades de solubilidad, estabilidad y absorción de los agentes farmacéuticos poco solubles.
Descripción de la presente invención
La presente invención proporciona preparaciones de administración oral que optimizan la estabilidad e incrementan la solubilidad del los agentes farmacéuticos poco solubles TSE-424 y ERA-923. Se han utilizado múltiples formulaciones con el fin de producir la disolución rápida de de los fármacos poco solubles, tales como formas disolventes (por ejemplo cápsulas de gelatina blanda) o formas de elevada energía (por ejemplo dispersiones sólidas). Estos procedimientos utilizan equipos y/o procedimientos especiales. La presente invención proporciona composiciones farmacéuticamente útiles que producen una disolución rápida de estos fármacos poco solubles de una forma de dosis sólida farmacéutica mediante componentes y procedimientos comúnmente utilizados.
La presente invención comprende formulaciones orales sólidas o composiciones de una dosis farmacéuticamente efectiva de un compuesto farmacológico activo seleccionado de entre TSE-424 y ERA-923 o una sal farmacéuticamente aceptable de los mismos, y un sistema de portador o excipiente tal como se describe en la presente memoria.
Mientras las formulaciones descritas en la presente memoria se pueden utilizar en una forma sólida sin recubrimiento o no-encapsulada, preferentemente las composiciones finales se recubren o encapsulan. Las composiciones farmacológicas pueden, opcionalmente, estar recubiertas con una película de recubrimiento que preferentemente comprende entre aproximadamente el 0,3% y aproximadamente el 8% en peso de la composición total. Las películas de recubrimiento de utilidad en la presente formulación son conocidas en la materia y generalmente comprenden un polímero (generalmente un polímero de tipo celulósico), un colorante y un plastificante. Adicionalmente las formulaciones de películas de recubrimiento pueden comprender ingredientes tales como agentes humectantes, azúcares, sabores, aceites y lubricantes con el fin de impartir ciertas características a la película de recubrimiento. Las composiciones y formulaciones de la presente memoria también se pueden combinar y tratar como un sólido, a continuación ponerse en una forma de cápsula, tal como una cápsula de gelatina.
Descripción detallada de la presente invención
Una composición farmacéutica proporcionada por la presente invención comprende en peso:
Reivindicaciones:
1. Composición farmacéutica que comprende, en peso:
2. Composición farmacéutica que comprende, en peso:
Patentes similares o relacionadas:
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]