Proceso para el control metabólico y la elevada depuración de solutos y soluciones para usar en éste.
Un kit de tratamiento de terapia de reemplazo que consiste en
- una solución de reemplazo que contiene 15-25 mmol/L de citrato y 130-150 mmol/L de sodio,
y una solución de dializado que contiene entre aproximadamente 110 y aproximadamente 130 mmol/L de cloruro, entre aproximadamente 20 y aproximadamente 35 mmol/L de bicarbonato, entre aproximadamente 2 y aproximadamente 4 mmol/L de potasio, y entre aproximadamente 0.5 y aproximadamente 0.7 mmol/L de magnesio.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/044219.
Solicitante: THE UAB RESEARCH FOUNDATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1120 G. ADMINISTRATION BUILDING, 701 20TH ST. SOUTH BIRMINGHAM, AL 35294-0110 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TOLWANI,ASHITA, SPEER,RAJESH, STOFAN,BRENDA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/194 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen dos o más grupos carboxilo, p. ej. ácidos succínico, maléico o ftálico.
- A61K33/00 A61K […] › Preparaciones medicinales que contienen ingredientes activos inorgánicos.
PDF original: ES-2547607_T3.pdf

Fragmento de la descripción:
Proceso para el control metabólico y la elevada depuración de solutos y soluciones para usar en éste
La presente solicitud reivindica prioridad para y en beneficio de la solicitud no provisional US Nº 10/273.290, presentada el 14 de noviembre de 2005.
Área de la divulgación 5
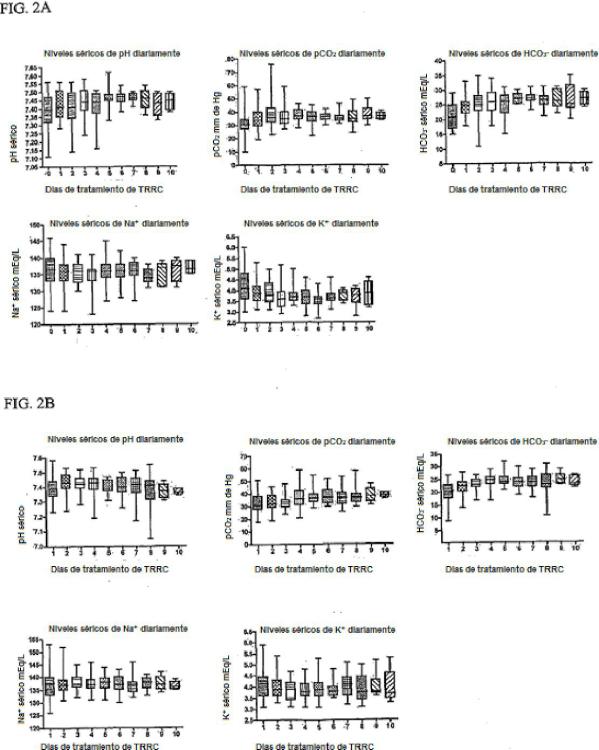
La presente divulgación se refiere en general al campo de la función renal y la enfermedad renal. La presente divulgación se refiere específicamente al uso de una solución de citrato trisódico regional definida diluida durante la terapia de reemplazo renal continua para el tratamiento de la enfermedad renal.
Antecedentes La terapia de reemplazo renal continua (TRRC) está bien establecida como una modalidad para el manejo de la 10 insuficiencia renal en el paciente críticamente enfermo. Cuando se desarrolló primero la TRRC, las principales indicaciones de uso fueron el retiro de líquidos y de solutos asociados a la insuficiencia renal, como en los pacientes que presentan insuficiencia renal aguda (IRA) . La insuficiencia renal aguda (IRA) es raramente un proceso aislado sino a menudo una complicación de afecciones subyacentes como septicemia, traumatismo y disfunción multiorgánica en pacientes críticamente enfermos. Como tales, las afecciones clínicas concomitantes afectan 15 significativamente el desenlace del paciente. Las aplicaciones de TRRC han evolucionado con el tiempo para incluir el uso en pacientes con insuficiencia renal crónica (IRC) y otras indicaciones. La terapia de reemplazo renal continua (TRRC) ha emergido recientemente como la técnica de diálisis de elección para pacientes críticamente enfermos con insuficiencia renal aguda (IRA) . Existen varios tipos de terapia TRRC, entre otras, la hemofiltración venovenosa continua (HVVC) . Se reconoce que en general la TRRC ofrece ventajas significativas a la diálisis intermitente para el 20 control metabólico y de líquidos (1) . Además, las elevadas velocidades de ultrafiltración (mayor o igual a 35 ml/kg/h) que utiliza la TRRC, como la HVVC, se han asociado a una mayor supervivencia de los pacientes (2) .
Durante los procedimientos de TRRC, se deben añadir soluciones para mantener la sangre fluyendo a través del dispositivo de CRRT y evitar la coagulación. La heparina sódica es el anticoagulante más comúnmente utilizado para la TRRC. Los sistemas se limpian con frecuencia haciendo pasar heparina diluida por el sistema durante el 25 procedimiento de cebado (5000-10 000 U/L de solución salina normal) seguido de un suministro constante de heparina durante la terapia. Durante muchos años, fue el anticoagulante de elección para todas las formas de diálisis que utilizaban una ruta sanguínea. Sin embargo, a medida que la TRRC se aplicaba a pacientes más profundamente enfermos, se encontró que la heparina se asociaba a las complicaciones ocasionadas por trastornos de la coagulación en los enfermos críticos. Los efectos secundarios que se pueden observar incluyen, pero no 30 exclusivamente, anticoagulación sistémica, trombocitopenia y supresión de la secreción de aldosterona. Los efectos sobre la coagulación sistémica tornan problemática la administración de heparina en pacientes con hemorragia gastrointestinal o una lesión traumática en la cual la hemostasia está deteriorada debido al consumo del factor de coagulación o hemorragia oculta proveniente de heridas o sitios de punción vascular. El monitoreo frecuente de los estudios de coagulación y el recuento de plaquetas así como la vigilancia continua para determinar complicaciones 35 hemorrágicas es esencial para cualquier paciente sometido a anticoagulación con heparina del sistema de TRRC. Los pacientes no requieren la aplicación de bolos de heparina antes de la iniciación de la terapia, ya que el objetivo no es anticoagular a los pacientes sino más bien proporcionar una anticoagulación regional para el sistema. Si la heparina utilizada para el cebado no se enjuaga completamente del sistema, los pacientes recibirán aún un pequeño bolo de heparina del volumen de cebado. 40
El citrato trisódico se ha utilizado durante muchos años como anticoagulante para productos hemáticos. Se introdujo en la TRRC como un anticoagulante regional al comienzo de la década de 1990. Se requiere una función hepática relativamente normal para metabolizar el citrato de sodio.
Por consiguiente, el citrato trisódico se ha utilizado para proporcionar anticoagulación de la sangre en el circuito extracorpóreo durante la TRRC. El citrato afecta la anticoagulación mediante la unión con el calcio tornándolo no 45 disponible para la cascada de coagulación. Puesto que varios pasos de la cascada de coagulación son dependientes de calcio, la ausencia de calcio evita la coagulación. Una vez que se retorna la sangre del circuito extracorpóreo al paciente, ésta se mezcla con la sangre venosa central que contiene calcio y el efecto anticoagulante se neutraliza. En otras palabras, el citrato cuando se retorna al paciente desde el circuito extracorpóreo ya no es un anticoagulante. Generalmente, se administra calcio al paciente de manera continua para 50 evitar el agotamiento de las reservas de calcio que se puede producir como resultado de la unión del citrato al calcio y la pérdida de calcio a través del circuito extracorpóreo.
El estado anterior de la técnica ha reconocido que pueden surgir complicaciones cuando se usa citrato trisódico como anticoagulante regional. La toxicidad de este método incluye alcalosis metabólica debido a la acumulación de citrato y su posterior metabolismo a bicarbonato y los efectos del calcio ionizado sistémico reducido. Subjetivamente 55 el paciente puede experimentar palpitaciones, hormigueo perioral y calambres estomacales. Las características objetivas de la toxicidad por citrato incluyen depresión miocárdica, arritmias y alcalosis sistémica que puede o no incluir un vacío aniónico (anion gap) . La vigilancia adecuada de la velocidad de administración del citrato y el monitoreo y la corrección del calcio ionizado sistémico pueden evitar estos efectos. Puesto que es necesaria una función hepática normal para el metabolismo del citrato trisódico, los pacientes con enfermedad hepática pueden ser propensos a desarrollar toxicidad por citrato y se debe tener precaución al tratar a estos pacientes con citrato.
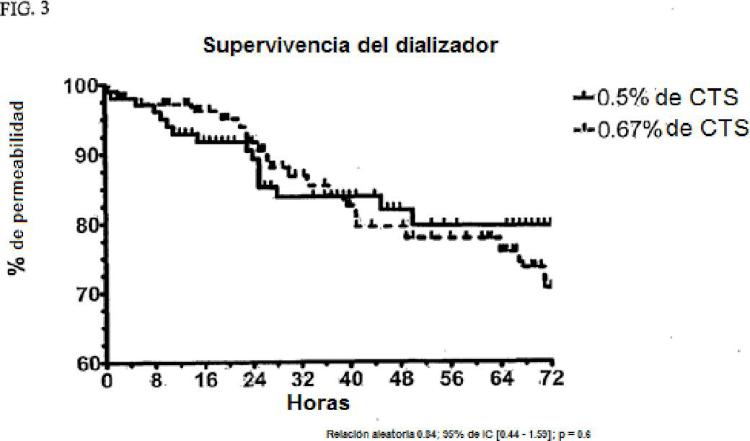
Aunque el uso de citrato para la anticoagulación regional ha demostrado ser superior al de la heparina (4) , a menudo complica la TRRC. Un pequeño número de protocolos de anticoagulación regional con citrato ofrecen una elevada 5 depuración de solutos pero también requieren varias soluciones personalizadas (5, 6, 7, 8, 9, 10) . La personalización de las soluciones, con los ajustes posteriores basados en el estado clínico del paciente o determinados por éste, consume los recursos de la farmacia en la preparación de las soluciones y aumenta el riesgo de error en la preparación de las mismas y en su administración (11) . Esta personalización de las soluciones puede variar no sólo entre los diferentes pacientes, sino que puede variar en el mismo paciente basado en los cambios en el estado 10 clínico de éste. Además, si el estado clínico de un paciente cambia a lo largo del tratamiento, las soluciones preparadas previamente tendrán que ser descartadas, aumentando así el costo del tratamiento. En 2004, dos pacientes que recibieron TRRC murieron después de que por error se agregó cloruro de potasio, en lugar de cloruro de sodio, a un dializado preparado a medida (12, 13) . Dado que en la actualidad la FDA no requiere el análisis de control de calidad de los lotes, pueden pasar desapercibidos errores potencialmente peligrosos en la solución de 15 TRRC. En una reciente encuesta internacional sobre el manejo de pacientes con IRA críticamente enfermos, las mayores preocupaciones con respecto a la TRRC incluyeron la anticoagulación, la coagulación en el dializador, la carga de trabajo del personal de enfermería, la falta de normas y los costos (3) .
Tobe et al (Journal of Critical Care, vol. 18, Nº 2, páginas 121-129) describen un nuevo protocolo de anticoagulación regional con citrato para la TRRC empleando únicamente soluciones comerciales. 20
Bihorac et al (American Journal of Kidney Diseases, Vol. 46, Nº 5, páginas 909-918) describen la hemofiltración venovenosa continua con líquido de reemplazo a base de citrato.
El protocolo ideal de la TRRC debe proporcionar control del volumen, control metabólico (ácido-base y electrolitos) y adecuada depuración de solutos, sin complicaciones significativas relacionadas con hemorragia o coagulación y debe ser versátil para permitir el ajuste independiente de los parámetros anteriores. Además, el protocolo de la 25 TRRC debe usar soluciones estandarizadas y no debe requerir... [Seguir leyendo]
Reivindicaciones:
1. Un kit de tratamiento de terapia de reemplazo que consiste en - una solución de reemplazo que contiene 15-25 mmol/L de citrato .
13. 150 mmol/L de sodio, y una solución de dializado que contiene entre aproximadamente 110 y aproximadamente 130 mmol/L de cloruro, entre aproximadamente 20 y aproximadamente 35 mmol/L de bicarbonato, entre aproximadamente 2 y 5 aproximadamente 4 mmol/L de potasio, y entre aproximadamente 0.5 y aproximadamente 0.7 mmol/L de magnesio.
2. El kit de acuerdo con la reivindicación 1, en el que la solución de dializado contiene 140 mmol/L de sodio, 118.5 mmol/L de cloruro, 25 mmol/L de bicarbonato, 4.0 mmol/L de potasio y 0.58 mmol/L de magnesio.
3. El kit de acuerdo con la reivindicación 1 o 2, que comprende además una solución de calcio que contiene entre 10 aproximadamente 20 y aproximadamente 50 mmol/L de gluconato de calcio.
4. El kit de acuerdo con la reivindicación 3, en el que la solución de calcio contiene 38.75 mmol/L de gluconato de calcio.
5. El kit de acuerdo con cualquier reivindicación precedente, en el que el kit de tratamiento de TRRC es un kit de tratamiento de HDFVVC. 15
6. Un kit de TRRC para utilizar en el tratamiento de una enfermedad renal, que consiste en el kit de acuerdo con cualquier reivindicación precedente.
7. Un kit de TRRC para usar en terapia de anticoagulación regional, que consiste en el kit de acuerdo con cualquiera de las reivindicaciones 1 a 5.
8. Un kit de TRRC para usar en tratamiento de HDFVVC, que comprende una solución de reemplazo que contiene 20 15-25 mmol/L de citrato .
13. 150 mmol/L de sodio, y una solución de dializado que contiene entre aproximadamente 110 y aproximadamente 130 mmol/L de cloruro, entre aproximadamente 20 y aproximadamente 35 mmol/L de bicarbonato, entre aproximadamente 2 y aproximadamente 4 mmol/L de potasio, y entre aproximadamente 0.5 y aproximadamente 0.7 mmol/L de magnesio.
Patentes similares o relacionadas:
Composición farmacéutica basada en nanoestructura de grafeno para prevenir o tratar enfermedades neurodegenerativas, del 22 de Julio de 2020, de Seoul National University R & DB Foundation: Una composición farmacéutica para su uso en la prevención o el tratamiento de enfermedades neurodegenerativas, que comprende puntos cuánticos de grafeno como […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Derivados de celastrol para el tratamiento de la obesidad, del 3 de Junio de 2020, de THE CHILDREN'S MEDICAL CENTER CORPORATION: Una formulación farmacéutica para su uso en inducir pérdida de peso o reducir la grasa corporal, o una combinación de las mismas, en un paciente pre-obeso, obeso […]
Polimerosomas de gradiente de pH transmembrana y su uso en la eliminación del amoníaco y sus análogos metilados, del 27 de Mayo de 2020, de ETH ZURICH: Un polimerosoma que comprende (a) una membrana, que comprende un copolimero en bloque de poli(estireno) (PS) y poli(oxido de etileno) (PEO), en […]
Composiciones y métodos para tratar afecciones de la piel con luz y ácidos policarboxílicos, del 25 de Marzo de 2020, de JOHNSON & JOHNSON CONSUMER INC: Un kit que comprende: (a) una composición tópica que comprende hasta aproximadamente 5 por ciento en peso de al menos un ácido policarboxílico C2 a […]
Composición como medio auxiliar para medicación oral, del 18 de Marzo de 2020, de Paxtree Ltd: Una composición en forma de gelatina, que comprende carragenina iota, ácido cítrico y maltodextrina, en la que la cantidad de maltodextrina en la composición está en el intervalo […]
Un envase para un concentrado de fluido de diálisis ácido que contiene citrato y glucosa, del 18 de Marzo de 2020, de GAMBRO LUNDIA AB: Un envase que incluye un concentrado que contiene citrato ácido que comprende una concentración total de citrato de 28-45 mM; ácido […]
Un procedimiento para la preparación de una formulación de polvo seco que comprende un anticolinérgico, un corticoesteroide y un beta-adrenérgico, del 4 de Marzo de 2020, de CHIESI FARMACEUTICI S.P.A.: Un procedimiento de preparación de una formulación de polvo para inhalación para su uso en un inhalador de polvo seco, comprendiendo dicha formulación […]