Potenciación de la coagulación o reducción de la fibrinólisis.
Una molécula liberadora de monóxido de carbono (CORM) para su uso para potenciar la coagulación o reducir la fibrinólisis en un sujeto en necesidad de coagulación potenciada o fibrinólisis reducida,
en la que la potenciación o reducción comprende la administración de CORM al sujeto.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2010/026377.
Solicitante: THE UAB RESEARCH FOUNDATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1720 2nd Avenue South, Administration Building 770 Birmingham, AL 35294-0107 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NIELSEN,VANCE G, GEORGE,JAMES F, KIRKLIN,JAMES K.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/416 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas carbocíclicos, p. ej. indazol.
- A61K31/69 A61K 31/00 […] › Compuestos del boro.
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
- A61P7/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antihemorrágicos; Procoagulantes; Hemostáticos; Antifibrinolíticos.
- A61P9/12 A61P […] › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
PDF original: ES-2512066_T3.pdf




Fragmento de la descripción:
Potenciación de la coagulación o reducción de la fibrinólisis 5 Referencia cruzada a solicitudes de prioridad
[1] La presente solicitud reivindica prioridad a la solicitud provisional de EE.UU. n° 61/157.719 presentada el 5 de marzo de 29.
Antecedentes
[2] La hemorragia debe controlarse bajo una variedad de circunstancias. Por ejemplo, lesión, enfermedad o cirugía pueden producir hemorragia, y los profesionales clínicos usan una variedad de medidas para controlar tal hemorragia en sus pacientes. Tal control, sin embargo, puede ser particularmente difícil si el paciente está tomando
ciertas medicaciones o tiene ciertas afecciones, tales como hemofilia.
Resumen
[3] En el presente documento se proporcionan composiciones para controlar la hemorragia en un sujeto. La 2 potenciación de la coagulación y la reducción de la fibrinólisis se usan en todas partes como medios para controlar la
hemorragia en un sujeto. Los procedimientos incluyen seleccionar un sujeto en necesidad de coagulación potenciada o fibrinólisis reducida y administrar al sujeto una molécula liberadora de monóxido de carbono (CORM) o una sal farmacéuticamente aceptable de la misma. Ejemplos de CORM y sales farmacéuticamente aceptables de las mismas útiles con los procedimientos descritos en el presente documento incluyen dímero de 25 tricarbonildiclororutenio (II) (es decir, CORM-2), tricarbon¡lcloro(glic¡nato)rutenio (II) (es decir, CORM-3), boranocarbonato de sodio, decacarbonilo de dimanganeso, pentacarbonilo de hierro, y derivados de los mismos. También se proporcionan composiciones que incluyen una CORM o una sal farmacéuticamente aceptable de la misma y un hemoderivado. El hemoderivado es un crioprecipitado o plasma fresco congelado. Se proporciona tratamiento de un sujeto en necesidad de un hemoderivado, que incluye administrar al sujeto la composición que 3 comprende la CORM o una sal farmacéuticamente aceptable de la misma y un hemoderivado. 4 5
[4] Los detalles de uno o más ejemplos de las composiciones y procedimientos se exponen en los dibujos adjuntos y la descripción más adelante. Otras características, objetivos y ventajas serán evidentes a partir de la descripción y dibujos, y de las reivindicaciones.
Descripción de los dibujos
[5]
La Figura 1 es una gráfica que muestra la potenciación por CORM-2 y CORM-2 inactivada (iCORM-2) de la cinética de coagulación en plasma deficiente en FXIII. En comparación con plasma sin exponer normal (traza en rejilla gris clara), el plasma expuesto a CORM-2 1 pM (traza negra) o ¡CORM (traza gris) tiene un aumento significativo en tanto la velocidad de formación del coágulo como la fortaleza del coágulo.
La Figura 2 es una gráfica que ilustra las definiciones de variables del modelo de duración del coágulo.
TCC = tiempo de crecimiento del coágulo (s), definido como el tiempo cuando la formación del coágulo comienza (fortaleza del coágulo de 12 dinas/cm2 [amplitud de 2 mm]) a cuando se observa la máxima fortaleza del coágulo; TLC = el tiempo de lisis del coágulo (s) empieza cuando se observa la máxima fortaleza del coágulo y continúa hasta que la lisis convierte la fortaleza del coágulo igual a 12 dinas/cm2; DC = duración del coágulo (s) es la suma de TCC y TLC; TMVGT = tiempo hasta la máxima velocidad de generación de 5 trombos (s); MVGT = máxima velocidad de generación de trombos (dinas/cm2/s); GTT = generación total de trombos (dinas/cm2); TML = tiempo hasta la máxima velocidad de lisis (s); MVL = máxima velocidad de lisis (- dinas/cm2/s); ACL = área bajo la curva de la lisis (-dinas/cm2).
La Figura 3 muestra relaciones de concentración-respuesta de la cinética de crecimiento del coágulo y fortaleza con concentración de CORM-2 creciente. CORM-2 disminuyó el tiempo hasta la máxima velocidad de 55 generación de trombos (TMVGT) (panel superior), aumentó la máxima velocidad de generación de trombos (MVGT) (panel central) y aumentó la generación total de trombos (GTT) (panel inferior) de un modo dependiente de la concentración.
La Figura 4 muestra relaciones de concentración-respuesta de la cinética fibrinolítica del coágulo con concentración de CORM-2 creciente. CORM-2 prolongó el tiempo hasta la máxima velocidad de lisis (TMVL) 6 (panel superior) y aumentó la máxima velocidad de lisis (MVL) (panel inferior) de un modo dependiente de la concentración.
La Figura 5 muestra relaciones de concentración-respuesta del tiempo de crecimiento del coágulo (panel superior), tiempo de lisis del coágulo (panel central) y duración del coágulo (panel inferior) con concentración de CORM-2 creciente. CORM-2 aumentó el tiempo de crecimiento del coágulo (TCC), tiempo de lisis del 65 coágulo (TLC) y duración del coágulo (DC) de un modo dependiente de la concentración.
La Figura 6 es una gráfica que muestra el efecto de CORM-2 sobre el crecimiento/disgregación del coágulo en plasma normal. La exposición de plasma normal a CORM-2 1 pM (traza gris) produjo trombos significativamente más fuertes que duraron más tiempo en comparación con plasma sin exponer (traza negra). La Figura 7 es una gráfica que muestra el efecto de CORM-2 sobre el crecimiento/disgregación del coágulo en plasma deficiente en FXIII. Al igual que con plasma normal, la exposición de plasma deficiente en FXIII a CORM-2 1 pM (traza gris) produjo trombos significativamente más fuertes que duraron más tiempo en comparación con el plasma sin exponer (traza negra).
La Figura 8 es una gráfica que muestra el efecto de CORM-2 sobre el crecimiento/disgregación del coágulo en plasma deficiente en PAI-1. La exposición de plasma deficiente en PAI-1 a CORM-2 1 pM (traza gris) produjo trombos significativamente más fuertes que duraron más tiempo en comparación con plasma sin exponer (traza negra). Sin embargo, el grado de potenciación de la coagulación y atenuación de la fibrinólisis por CORM-2 fue inferior al observado en plasma normal.
La Figura 9 es una gráfica que muestra el efecto de CORM-2 sobre el crecimiento/disgregación del coágulo en plasma deficiente en IFAT. La exposición de plasma deficiente en IFAT a CORM-2 1 pM (traza gris) produjo trombos significativamente más fuertes que duraron más tiempo en comparación con plasma sin exponer (traza negra). Sin embargo, el grado de potenciación de la coagulación y atenuación de la fibrinólisis por CORM-2 fue inferior al observado en plasma normal, pero similar al observado en plasma deficiente en PAI-1.
La Figura 1 es una gráfica que muestra el efecto de CORM-2 sobre el crecimiento/disgregación del coágulo en plasma deficiente en a2-ant¡plasm¡na. La exposición de plasma deficiente en a2-antiplasmina a CORM-2 1 pM (traza gris) produjo muy poco cambio en tanto la coagulación como la cinética fibrinolítica en comparación con plasma sin exponer (traza negra). Este resultado fue notablemente diferente de todos los otros tipos de plasma probados.
La Figura 11 contiene imágenes que muestran los efectos de CORM-2 sobre la ultraestructura del trombo en plasma normal a poco aumento. El aumento para ambos paneles fue 5. veces del normal. El panel A muestra plasma normal no expuesto a CORM-2 y el panel B muestra plasma normal expuesto a CORM-2 1 pM. La barra blanca en la esquina inferior derecha de ambos paneles representa 2 micrómetros. Una diferencia entre los dos paneles fue la reducción de la formación de fibra gruesa tras la exposición a CORM-2.
La Figura 12 contiene imágenes que muestran los efectos de CORM-2 sobre la ultraestructura del trombo en plasma normal a gran aumento. El aumento para ambos paneles fue 6. veces del normal. El panel A muestra plasma normal no expuesto a CORM-2 y el panel B muestra plasma normal expuesto a CORM-2 1 pM. La barra blanca en la esquina Inferior derecha de ambos paneles representa 5 nanómetros. Hubo poca diferencia en la arquitectura de la fibra delgada tras la exposición a CORM-2.
La Figura 13 contiene Imágenes que muestran los efectos de CORM-2 sobre la ultraestructura del trombo en plasma deficiente en FXIII a poco aumento. El aumento para ambos paneles fue 5. veces del normal. El panel A muestra plasma deficiente en FXIII no expuesto a CORM-2 y el panel B muestra plasma deficiente en FXIII expuesto a CORM-2 1 pM. La barra blanca en la esquina inferior derecha de ambos paneles representa 2 micrómetros. La exposición a CORM-2 disminuyó la formación de fibra gruesa y aumentó el contenido de matriz de fibra delgada en el coágulo deficiente en FXIII. Cuando se comparó con el panel A en la Figura 11, la exposición a CORM-2 "normalizó" la ultraestructura del trombo en plasma deficiente en FXIII como se representa en el panel B de esta figura.
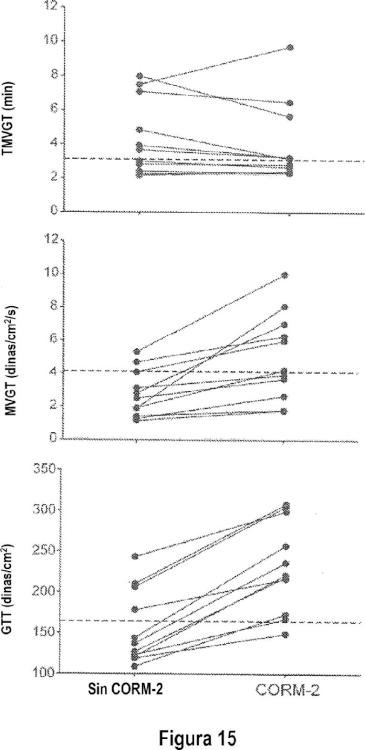
La Figura 14 contiene... [Seguir leyendo]
Reivindicaciones:
1. Una molécula liberadora de monóxido de carbono (CORM) para su uso para potenciar la coagulación o reducir la fibrinólisis en un sujeto en necesidad de coagulación potenciada o fibrinólisis reducida, en la que la potenciación o
reducción comprende la administración de CORM al sujeto.
2. La CORM de la reivindicación 1 para el uso de la reivindicación 1, en la que la CORM se selecciona del grupo que consiste en un dímero de tricarbonildiclororutenio (II), tricarbonilcloro(glicinato)rutenio (II), boranocarbonato de sodio, decacarbonilo de dimanganeso y pentacarbonilo de hierro.
3. La CORM de las reivindicaciones 1 ó 2 para el uso de la reivindicación 1 para administración de una dosis única de la CORM al sujeto.
4. La CORM de la reivindicación 3 para el uso de la reivindicación 1, en la que la dosis comprende de 25 pM a 2 15 pM de la CORM.
5. La CORM de cualquiera de las reivindicaciones 1-4 para el uso de la reivindicación 1, en la que la CORM es para administración en o cerca de un sitio de hemorragia, y/o en la que la CORM es para administración tópica o para administración por inyección local, intravenosa o intramuscular.
6. La CORM de cualquiera de las reivindicaciones 1-5 para el uso de la reivindicación 1, en la que la CORM se formula para administración por un espray en aerosol, una pomada, una venda, un apósito quirúrgico, un relleno de herida, un hisopo, un líquido, una pasta, una crema, una loción, una espuma, un gel, una emulsión, un polvo, hilo dental, un instrumento dental o una aguja.
7. La CORM de cualquiera de las reivindicaciones 1-6 para el uso de la reivindicación 1, en la que la CORM es para co-administración con un agente terapéutico seleccionado del grupo que consiste en un antibiótico, un anestésico, un analgésico, un antihistamínico, un antimicrobiano, un antifúngico, un antiviral y un agente antiinflamatorio, o para la co-administración con un agente hemostático, un coagulante, una medicación antifibrinolítica, fibrina, trombina,
factor Vil activado recombinante, concentrado de complejo de protrombina, FEIBA o un factor de coagulación sanguíneo, en la que opcionalmente el factor de coagulación sanguíneo es factor VIII, factor IX, factor XIII o factor de von Willebrand.
8. La CORM de cualquiera de las reivindicaciones 1-7 para el uso de la reivindicación 1, en la que el sujeto tiene una 35 enfermedad o afección asociada a hemorragia, en la que opcionalmente la enfermedad o afección asociada a
hemorragia es hemofilia, trombocitopenia, enfermedad de von Willebrand, telangiectasia hemorrágica hereditaria o coagulación intravascular diseminada o una herida abierta.
9. La CORM de la reivindicación 8 para el uso de la reivindicación 1, en la que la herida abierta se produce por 4 traumatismo o lesión o es debida a un procedimiento quirúrgico.
1. La CORM de cualquiera de las reivindicaciones 1-9 para el uso de la reivindicación 1, en la que el sujeto está sometiéndose a cirugía o hemodilución, o en la que el sujeto tiene la necesidad de formación elevada de coágulos de sangre.
11. La CORM de la reivindicación 1 para el uso de la reivindicación 1, en la que el sujeto está siendo tratado con un anticoagulante, una medicación antiplaquetaria, una antitrombina o una medicación fibrinolítica.
12. Una composición que comprende una CORM y un producto sanguíneo, en la que el producto sanguíneo se 5 selecciona de crioprecipitado o plasma fresco congelado.
13. La composición de la reivindicación 12, en la que la CORM se selecciona del grupo que consiste en dímero de tricarbonildiclororutenio (II), tricarbonilcloro(glicinato)rutenio (II), boranocarbonato de sodio, decacarbonilo de dimanganeso y pentacarbonilo de hierro.
14. La composición de la reivindicación 12 para su uso para tratar un sujeto en necesidad de un producto sanguíneo, en la que el tratamiento comprende administración de la composición al sujeto.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Ciclodextrinas como procoagulantes, del 22 de Abril de 2020, de Alveron Pharma B.V: Una ciclodextrina sustituida de la fórmula (I): **(Ver fórmula)** en donde n es un número entero de 3 a 7 y R se selecciona del grupo […]
Anticuerpos que son capaces de unirse específicamente al inhibidor de la vía del factor tisular, del 8 de Abril de 2020, de NOVO NORDISK A/S: Un anticuerpo que se une específicamente dentro de los aminoácidos 186-276 del TFPI (SEQ ID NO: 1), en donde la cadena pesada comprende: • una secuencia […]
Cristales del compuesto 2-acilaminotiazol, del 25 de Marzo de 2020, de ASTELLAS PHARMA INC.: 1. Un cristal de la sal de ácido maleico del ácido 1-(3-cloro-5-{[4-(4-clorotiofen-2-il)-5-(4-ciclohexil piperazin-1-il)tiazol- 2-il]carbamoil} […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Preparación líquida anhidra de melatonina, del 26 de Febrero de 2020, de Worphmed Srl: Una solución parenteral a granel sustancialmente libre de agua que consiste en una preparación líquida anhidra de melatonina que contiene al menos: a) […]
Métodos para aumentar la producción de células madre hematopoyéticas y plaquetas, del 22 de Enero de 2020, de Janssen Pharmaceuticals, Inc: Una composición farmacéutica para su uso en un método de (i) proporcionar células madre hematopoyéticas a un sujeto; (ii) reducir el tiempo de injerto […]