Procedimiento para purificar proteínas.
Un método para purificar una proteína recombinante procedente de una muestra de células hospedadoras bacterianas gram-negativas o un extracto de la misma en donde dicha célula hospedadora expresa una proteína recombinante y una disulfuro isomerasa recombinante DsbC;
en donde el método comprende:
a) ajustar el pH de la muestra de células hospedadoras o de un extracto de la misma a un pH de 5 o inferior para precipitar la disulfuro isomerasa recombinante; y
b) separar la disulfuro isomerasa recombinante precipitada de la proteína recombinante para producir una muestra de proteína recombinante.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2011/001129.
Solicitante: UCB Biopharma SPRL.
Inventor/es: WILD,GAVIN BARRY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K1/36 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › por una combinación de varios procesos de diferentes tipos.
- C07K16/24 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
PDF original: ES-2537877_T3.pdf



Fragmento de la descripción:
Procedimiento para purificar proteínas Esta invención se refiere a un procedimiento para purificar una proteína recombinante procedente de una muestra de células hospedadoras gram-negativas o de su extracto. Más específicamente, la muestra de células 5 hospedadoras gram-negativas o su extracto se ajusta a un pH bajo para efectuar la precipitación de la proteína disulfuro isomerasa.
Se han desarrollado rápidamente técnicas de ADN recombinante y son particularmente útiles en la producción de anticuerpos, en particular de anticuerpos terapéuticos. Los sistemas para la expresión de genes recombinantes son bien conocidos por el experto en la técnica en el campo en cuestión. Estos incluyen la expresión en células de 10 mamífero, células de insectos, células micóticas, células bacterianas y animales y plantas transgénicos. La elección del sistema de expresión depende de las características de la proteína codificada, por ejemplo las modificaciones tras la traducción. Otras consideraciones incluyen el tiempo y, en particular, el coste implicado en la producción de la cantidad deseada de material de la calidad requerida. Estas últimas consideraciones son particularmente importantes en la producción de anticuerpos terapéuticos de la calidad requerida para la aprobación reglamentaria y en las cantidades necesarias para el tratamiento de un gran número de pacientes.
Un sistema ampliamente utilizado para la producción de proteínas recombinantes se basa en la expresión en Escherichia coli (E. coli) . Un problema específico encontrado con la utilización de E. coli es la dificultad de producir material de la calidad requerida en cantidades necesarias para tratamiento. En particular, el tiempo y los costes implicados pueden ser prohibitivos. Un problema específico a destacar es la pérdida incurrida en el rendimiento de anticuerpos durante la purificación de los anticuerpos de E. coli.
Aunque, proporcionalmente, los costes de purificación son una fracción del coste total de un producto de anticuerpo terapéutico, la proporción del coste de purificación aumentará más a medida que los costes de producción aguas arriba sean más económicos. Por lo tanto, las mejoras en la recuperación y purificación de anticuerpos conducirán a costes de producción más hacia abajo con independencia de los medios de producción (Humphreys & Glover, Curr.
Opin. Drug Discover y & Development, 20014:172-185) . Por consiguiente, hay necesidad de métodos que introduzcan ahorros de tiempo y/o de costes en la producción de anticuerpos terapéuticos y, en particular, en la purificación, por ejemplo aumentando la recuperación de productos y/o mejorando la calidad de la corriente del producto.
El bajo rendimiento en productos es con frecuencia un problema específico observado durante las etapas de purificación aguas abajo. Un problema específico en la purificación aguas abajo se refiere a la separación de proteínas de células hospedadoras (PCH) que se liberan tras la extracción del anticuerpo terapéutico de las células hospedadoras. Numerosas modificaciones del procedimiento se han intentado con objeto de estudiar este problema. Ejemplos de dichos procedimientos comprenden los siguientes:
La proteína de interés puede precipitarse y separarse a continuación de otros contaminantes de las PCH. Sin embargo, la precipitación de un anticuerpo terapéutico puede producir daño irreversible al anticuerpo. Las técnicas que precipitan específicamente la proteína de interés con frecuencia producen la oclusión de los contaminantes no proteicos en el precipitado, haciendo la separación ineficaz.
Alternativamente, las PCH pueden precipitarse fuera del anticuerpo terapéutico. El documento US7169908 describe la adición de una solución de lactato de etacridina para precipitar impurezas de células hospedadoras. Sin embargo, la utilización de un agente tal como lactato de etacridina no es adecuada para la producción de proteínas terapéuticas porque se ha utilizado como agente abortivo y puede ser perjudicial para el paciente si no se elimina completamente. Las PCH de un cultivo celular CHO se han precipitado utilizando una pequeña molécula y ajuste de pH con objeto de purificar una proteína (Arunakumari A. et al. Advances in Non-Protein A Purification Processes for Human Monoclonal Antibodies Supplement to BioPharm International marzo de 2009 págs. 22-26) .
HU et al.: "Optimisation of production of a domoic acid-binding scFv antibody fragment in Escherichia coli using molecular chaperones and functional immobilisation on a mesoporous silicate support", Protein Expression and Purification, vol. 52, nº 1, 8 de enero de 2007, páginas 194-201 y HU et al.: "Cloning, expression and characterisation of a single-chain Fv antibody fragment against domoic acid in Escherichia coli", Journal of Biotechnology, vol. 120, nº 1, 17 de octubre de 2005, páginas 38-45, describen un método para purificar una proteína recombinante procedente 50 de una muestra de células hospedadoras bacterianas gram-negativas en donde dicha célula hospedadora expresa un fragmento scFv de anticuerpo monocatenario recombinante y una disulfuro isomerasa recombinante DsbC para aumentar el rendimiento de la proteína diana recombinante. Sin embargo, ambos documentos no describen el ajuste del pH de la muestra de células hospedadoras a un pH de 5 o menos para precipitar la disulfuro isomerasa recombinante antes del tratamiento ulterior.
Mientras dichos métodos han contribuido a ayudar a purificar anticuerpos terapéuticos de contaminantes de células hospedadoras existe todavía una necesidad de proporcionar mejores métodos para reducir la cantidad de PCH de los sistemas de células hospedadoras microbianas sin afectar negativamente las propiedades del anticuerpo terapéutico con objeto de facilitar el ulterior tratamiento aguas abajo.
Además los inventores han descubierto que la expresión de algunas proteínas chaperonas, por ejemplo una disulfuro isomerasa, tal como DsbC, por el hospedador puede ser útil en el aumento de los niveles de expresión de anticuerpos o de uno de sus fragmentos. Sin embargo, la proteína chaperona se expresa a niveles significativos y llega a ser un gran subproducto del procedimiento que requiere eliminación.
Eliminar grandes cantidades de contaminantes puede ser desafiante porque métodos tales como la cromatografía en columna encuentran dificultades para eliminar grandes cantidades de una proteína contaminante debido al ensuciamiento de la columna y la necesidad de utilizar grandes cantidades de reactivos o disolventes.
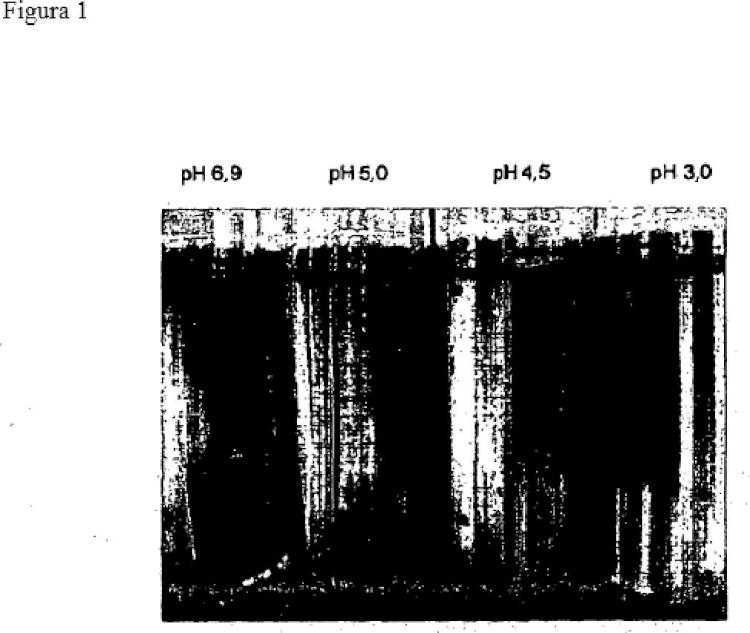
Cuando la DsbC está aislada se prueba que es soluble a pH bajos tales como pH 3. Sin embargo, los presentes inventores han descubierto sorprendentemente que el ajuste de pH de 5 o menos puede utilizarse para precipitar disulfuro isomerasa recombinante de una célula hospedadora bacteriana gram-negativa y de este modo facilitar el ulterior tratamiento de una proteína recombinante de interés, tal como un anticuerpo terapéutico.
Compendio de la Invención En uno aspecto se proporciona un método para purificar una proteína recombinante procedente de una célula hospedadora, por ejemplo una muestra de células hospedadoras bacterianas gram-negativas que expresan una proteína recombinante y una disulfuro isomerasa recombinante o de un extracto de la misma; que comprende:
a. ajustar el pH de la muestra de células hospedadoras o de un extracto de la misma a un pH de 5 o inferior para precipitar la disulfuro isomerasa recombinante; y
b. separar la disulfuro isomerasa recombinante precipitada de la proteína recombinante para proporciona una muestra de proteína recombinante.
La presente invención proporciona además la utilización de una etapa de ajuste del pH de una muestra de células hospedadoras bacterianas gram-negativas transformadas con un vector de expresión que codifica una proteína recombinante o de un extracto de la misma a un pH de 5 o inferior para precipitar disulfuro isomerasa recombinante de célula hospedadora, seguida de separación de la disulfuro isomerasa recombinante de la célula hospedadora precipitada procedente de la proteína recombinante y proporciona una muestra de proteína recombinante purificada.
En una realización se proporciona un método para purificar un anticuerpo recombinante o uno de sus fragmentos de fijación procedente de una muestra de células hospedadoras bacterianas gram-negativas o un extracto de dichas células hospedadoras en donde dichas células hospedadoras expresan el anticuerpo recombinante o uno de sus fragmentos de fijación y una disulfuro isomerasa recombinante DsbC; en donde el método comprende:
a. ajustar el pH de la muestra de células hospedadoras o de... [Seguir leyendo]
Reivindicaciones:
1. Un método para purificar una proteína recombinante procedente de una muestra de células hospedadoras bacterianas gram-negativas o un extracto de la misma en donde dicha célula hospedadora expresa una proteína recombinante y una disulfuro isomerasa recombinante DsbC; en donde el método comprende:
a) ajustar el pH de la muestra de células hospedadoras o de un extracto de la misma a un pH de 5 o inferior para precipitar la disulfuro isomerasa recombinante; y b) separar la disulfuro isomerasa recombinante precipitada de la proteína recombinante para producir una muestra de proteína recombinante.
2. El método según la reivindicación 1, en donde el pH de la muestra de células hospedadoras o de un extracto de la 10 misma se ajusta a un pH de 4, 5 o inferior.
3. El método según la reivindicación 2, en donde el pH de la muestra de células hospedadoras o de un extracto de la misma se ajusta a un pH de 4, 5 a 3, 0.
4. El método según la reivindicación 2, en donde el pH de la muestra de células hospedadoras o de un extracto de la misma se ajusta a un pH de 3 o inferior.
6. El método según cualquier reivindicación anterior, en donde la disulfuro isomerasa comprende una etiqueta de histidina. 8. El método según cualquier reivindicación anterior, en donde la célula hospedadora comprende Fkpa y/o Skp. 9. El método según cualquier reivindicación anterior, en donde en la etapa a) el pH de la muestra de células hospedadoras o de un extracto de la misma se ajusta a un pH inferior a 5 utilizando ácido acético glacial. 10. El método según cualquier reivindicación anterior, en donde la muestra de células hospedadoras o de un extracto de la misma se mantiene a un pH de 5 o menos durante una hora o menos. 11. El método según cualquier reivindicación anterior, en donde la separación en la etapa b) comprende centrifugación y/o filtración. 12. El método según cualquier reivindicación anterior, en donde tras la etapa b) el método comprende una etapa de 30 purificación adicional para someter la muestra de proteína recombinante a cromatografía. 13. El método según la reivindicación 11, en donde la cromatografía es la cromatografía de intercambio iónico. 14. El método según cualquier reivindicación anterior, en donde después de la etapa b) el pH de la muestra de proteína recombinante se ajusta a un pH de 5 a 7. 15. El método según cualquier reivindicación anterior, en donde antes de la etapa a) se añade un tampón de 35 extracción a la muestra de células hospedadoras o a un extracto de la misma y la muestra de células hospedadoras o un extracto de la misma se somete a una etapa de tratamiento térmico. 16. El método según cualquier reivindicación anterior, en donde la proteína recombinante tiene un pI de 6 a 9. 17. El método según la reivindicación 16, en donde la proteína recombinante tiene un pI de 8 a 9. 18. El método según cualquier reivindicación anterior, en donde la proteína recombinante es un anticuerpo 40 recombinante. 19. El método según la reivindicación 18, en donde el anticuerpo recombinante es un anticuerpo monoclonal, humanizado o híbrido, o uno de sus fragmentos, tal como uno de sus fragmentos de fijación. 20. El método según la reivindicación 18 o la reivindicación 19, en donde el anticuerpo recombinante es un fragmento Fab o Fab'. 21. El método según cualquiera de las reivindicaciones 18 a 20, en donde el anticuerpo recombinante es específico para FNT humano. 22. El método según la reivindicación 21, en donde el anticuerpo comprende una cadena pesada en donde el dominio variable comprende una RDC que tiene la secuencia dada en SEQ. ID. nº: 1 para RDCH1, SEQ. ID. nº: 2, para RDCH2 y SEQ. ID. nº: 3 para RDCH3 y una cadena ligera en donde el dominio variable comprende una RDC que tiene la secuencia dada en SEQ. ID. nº: 4 para RDCL1, SEQ. ID. nº: 5 para RDCL2 y SEQ. ID. nº: 6 para RDCL3. 23. El método según la reivindicación 22, en donde el anticuerpo comprende secuencia de la zona variable de la cadena ligera dada en SEQ. ID. nº: 7 y la zona variable de la cadena pesada dada en SEQ. ID. nº: 8. 24. El método según la reivindicación 23, en donde el anticuerpo es un fragmento Fab y comprende una cadena pesada que tiene la secuencia dada en SEQ. ID. nº: 10 y una cadena ligera que tiene la secuencia dada en SEQ. ID. 10 nº: 9. 25. Utilización de una etapa de ajuste del pH de una muestra de células hospedadoras bacterianas gram-negativas o de uno de sus extractos transformada con un vector de expresión que codifica una proteína recombinante a un pH de 5 o menos para precipitar disulfuro isomerasa recombinante de célula hospedadora, separar la disulfuro isomerasa recombinante de célula hospedadora precipitada de la proteína recombinante y producir una muestra de proteína recombinante purificada. 5. El método según la reivindicación 4, en donde en la etapa a) la proteína de fijación al dipéptido de la célula hospedadora se precipita además y en la etapa b) la proteína de fijación al dipéptido de la célula hospedadora se separa además de la proteína recombinante.
7. El método según cualquier reivindicación anterior, en donde la célula hospedadora bacteriana gram-negativa es E. coli.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Uso de reslizumab para tratar el asma eosinofílica moderada a grave, del 24 de Junio de 2020, de CEPHALON, INC.: Reslizumab para su uso en el tratamiento del asma eosinofílica, en donde: se proporcionan 3 mg/kg de reslizumab por vía intravenosa una […]
Anticuerpos anti-IL-23 humanos, composiciones, procedimientos y usos, del 17 de Junio de 2020, de Janssen Biotech, Inc: un anticuerpo para IL-23p19 aislado, en donde dicho anticuerpo se genera completamente humano a partir de expresión de fagos y se une a […]
Aislamiento y purificación de anticuerpos anti-IL-13 usando cromatografía de afinidad a Proteína A, del 27 de Mayo de 2020, de AbbVie Inc: Un método para producir una preparación de anticuerpo anti-IL-13 reducido en proteínas de célula hospedadora (reducido en HCP) a partir de una mezcla […]
Anticuerpos ANTI-IL-33 y usos de los mismos, del 29 de Abril de 2020, de REGENERON PHARMACEUTICALS, INC.: Un anticuerpo monoclonal humano o fragmento de unión al antígeno del mismo para usar en un método de tratamiento del asma crónica en un paciente que lo necesita, […]