Cristal de un derivado de tienopirimidina.
Un cristal de ácido 2-(3,4-diclorobencil)-5-metil-4-oxo-3,4-dihidrotien[2,
3-d]pirimidin-6-carboxílico que tiene
(a) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2θ de 6,7 ± 0,2º, 8,3 ± 0,2º, 8,9 ± 0,2º, 14,0 ± 0,2º, 14,8 ± 0,2º y 26,4 ± 0,2º en el espectro de difracción de polvo por rayos X;
o (b) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2θ de 7,3 ± 0,2º, 11,2 ± 0,2º, 13,3 ± 0,2º, 17,0 ± 0,2º, 25,5 ± 0,2º y 27,5 ± 0,2º en el espectro de difracción de polvo por rayos X.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2011/062513.
Solicitante: ASKA PHARMACEUTICAL CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 5-1, SHIBAURA 2-CHOME MINATO-KU, TOKYO 108-8532 JAPON.
Inventor/es: MIYAZAKI, KOICHI, NAKAGAWA,TAKAYOSHI, HAYASHI,HIROYUKI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/519 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con heterociclos.
- A61P11/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del aparato respiratorio.
- A61P13/02 A61P […] › A61P 13/00 Medicamentos para el tratamiento del aparato urinario (diuréticos A61P 7/10). › de la orina o del tracto urinario p.ej.acidificadores de la orina.
- A61P13/04 A61P 13/00 […] › para la urolitiasis.
- A61P13/08 A61P 13/00 […] › de la próstata.
- A61P13/10 A61P 13/00 […] › de la vejiga.
- A61P15/10 A61P […] › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › para la impotencia.
- A61P25/00 A61P […] › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- A61P25/28 A61P […] › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- A61P3/10 A61P […] › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la hiperglucemia, p.ej. antidiabéticos.
- A61P7/02 A61P […] › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Agentes antitrombóticos; Anticoagulantes; Inhibidores de la agregación plaquetaria.
- A61P9/10 A61P […] › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › para enfermedades isquémicas o ateroscleróticas, p.ej. medicamentos antianginosos, vasodilatadores coronarios,medicamentos para el tratamiento del infarto de miocardio, de la retinopatía, de la insuficiencia cerebrovascular, de la arterioesclerosis renal.
- A61P9/12 A61P 9/00 […] › Antihipertensivos.
- C07D495/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 495/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tiene átomos de azufre como únicos heteroátomos del ciclo. › Sistemas orto-condensados.
PDF original: ES-2532110_T3.pdf
Fragmento de la descripción:
Cristal de un derivado de tienopirimidina Campo de la técnica La presente invención se refiere a un cristal de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3d]pirimidin-6-carboxílico (en lo sucesivo se denominará "compuesto A") útil como un fármaco terapéutico para la disuria y similares, un medicamento que contiene el cristal y un procedimiento de producción del cristal.
Antecedentes de la técnica El Compuesto A es un compuesto descrito en el documento WO 2006/135.080 (véase el documento de patente 1) , que tiene una gran acción inhibidora de la PDE9 así como una leve acción inhibidora de PDE5, y es útil para el tratamiento o procedimiento de la disuria y similares.
Sin embargo, el documento de patente 1 no muestra claramente las propiedades concretas del compuesto A obtenido y no describe ni sugiere la presencia de polimorfo del cristal.
Lista de documentos Documentos de Patente Documento de patente 1: WO 2006/135.080
Compendio de la invención Problemas que se resolverán mediante la invención El problema de la presente invención es proporcionar un cristal del compuesto A.
Medios de resolver los problemas En vista del problema antes mencionado, los autores de la presente invención han estudiado varios aspectos de la cristalización del compuesto A, y han obtenido con éxito una nueva forma amoría (amorfo) , cristales del solvato y cristales no solvatados del compuesto A.
Particularmente, han encontrado que un cristal no solvatado que muestra particulares datos de propiedad (el cristal de la Forma I y el cristal de la Forma II se mencionarán más adelante) no se puede obtener por métodos de cristalización generales tales como recristalización y similares utilizando varios disolventes orgánicos, pero de forma inesperada se puede producir por un procedimiento conveniente que incluye calentando una suspensión acuosa durante un tiempo determinado.
Este procedimiento se puede realizar como pruebas diagnósticas en la etapa final de la producción industrial, sin necesidad de incluir por separado el paso oneroso de una etapa de cristalización. Además, el cristal obtenido tiene una superior filtrabilidad. Por eso, el procedimiento es adecuado para la producción a gran escala desde los aspectos de operabilidad y coste. Además, han encontrado que estos cristales tienen propiedades superiores como medicamento, lo que dio como resultado la realización de la presente invención.
Por consiguiente, la presente invención se refiere a [1] un cristal de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico que tiene (a) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2Î de 6, 7 ± 0, 2º , 8, 3 ± 0, 2º , 8, 9 ± 0, 2º , 14, 0 ± 0, 2º , 14, 8 ± 0, 2º y 26, 4 ± 0, 2º en el espectro de difracción de polvo por rayos X ;
o (b) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2Î de 7, 3 ± 0, 2º , 11, 2 ± 0, 2º , 13, 3 ± 0, 2º , 17, 0 ± 0, 2º , 25, 5 ± 0, 2º y 27, 5 ± 0, 2º en el espectro de difracción de polvo por rayos X;
[2] el cristal del [1] (a) antes mencionado, que muestra un pico endotérmico que tiene una temperatura máxima de pico de 362 ± 5 º C en calorimetría diferencial de barrido (DSC) ;
[3] el cristal del [1] (b) antes mencionado, que muestra un pico endotérmico que tiene una temperatura máxima de pico de 342 ± 5 º C en calorimetría diferencial de barrido (DSC) ;
[4] el cristal de cualquiera de los [1] a [3] antes mencionados, que es un cristal no solvatado y no hidratado;
[5] un cristal mixto que comprende el cristal del [1] (a) antes mencionado y el cristal del [1] (b) antes mencionado;
[6] un cristal mixto según el [5] antes mencionado que comprende un cristal según el [2] antes mencionado y un
cristal según el [3] antes mencionado.
[7] una composición farmacéutica que comprende un cristal de cualquiera de los [1] a [6] antes mencionados y un excipiente farmacéuticamente aceptable;
[8] un cristal de cualquiera de las [1] a [6] antes mencionados para su uso como ingrediente activo en un procedimiento de terapia realizado en el cuerpo de un ser humano o de un animal;
[9] un cristal del [8] antes mencionado, para uso como inhibidor de la PDE9;
[10] un cristal del [8] antes mencionado, para uso como un agente terapéutico en el síndrome de vejiga hiperactiva, polaquiuria, incontinencia urinaria, disuria en la hiperplasia prostática benigna, vejiga neurogénica, cistitis intersticial, urolitiasis, hiperplasia prostática benigna, disfunción eréctil, deterioro cognitivo, neuropatía, enfermedad de Alzheimer, hipertensión pulmonar, enfermedades pulmonares obstructivas crónicas, enfermedades del corazón isquémico, hipertensión, angina de pecho, infarto de miocardio, arteriosclerosis, trombosis, embolia, o diabetes de tipo I o diabetes de tipo II;
[11] un procedimiento para producir el cristal de cualquiera de las reivindicaciones 1 a 6, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3d]pirimidin-6-carboxílico;
[12] un procedimiento del [11] antes mencionado, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico a no menos de 40 º C y menos de 50 º C durante 1 a 96 h, no menos de 50 º C y menos de 60 º C durante 0, 5 a 32 h, no menos de 60 º C y menos de 70 º C durante 0, 5 a 24 h, no menos de 70 º C y menos de 80 º C durante 0, 1 a 12 h, no menos de 80 º C y menos de 90 º C durante 0, 05 a 6 h, o no menos de 90 º C y no más de 100 º C durante 0, 01 a 3 h para producir un cristal como se define en el [1] (a) antes mencionado;
[13] un procedimiento del [11] antes mencionado, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico a no menos de 60 º C y menos de 70 º C durante 144 h o más, no menos de 70 º C y menos de 80 º C durante 25 h o más, no menos de 80 º C y menos de 90 º C durante 23 h o más, o no menos de 90 º C y no más de 100 º C durante 16 h o más para producir un cristal como se define en el [1] (b) antes mencionado;
[14] un procedimiento de cualquiera de los [11] a [13] antes mencionados, que comprende calentar una suspensión acuosa obtenida mediante la neutralización o acidificación de una solución acuosa alcalina de ácido 2- (3, 4diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico;
y similares.
Efecto de la invención Según la presente invención, se puede obtener un nuevo cristal no solvatado del compuesto A. Este cristal puede ser producido por un procedimiento conveniente adecuado para la producción industrial a gran escala. Además, el cristal obtenido se puede filtrar fácilmente en comparación con la forma amoría, y es adecuado para la producción industrial a gran escala. Además, el cristal de la presente invención es también adecuado como un ingrediente activo de un medicamento en estabilidad, solubilidad, capacidad de absorción y similares.
Breve descripción de los dibujos La Fig. 1 muestra un patrón de difracción de polvo por rayos X del cristal de la Forma I del compuesto A (Ejemplo 1) .
La Fig. 2 muestra un espectro de absorción de infrarrojos (método de la pasta) del cristal de la Forma I del compuesto A (Ejemplo 1) .
La Fig. 3 muestra un patrón de difracción de polvo por rayos X del cristal de la Forma II del compuesto A (Ejemplo 2) .
La Fig. 4 muestra un espectro de absorción de infrarrojos (método de la pasta) del cristal de la Forma II del compuesto A (Ejemplo 2) .
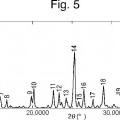
La Fig. 5 muestra un patrón de difracción de polvo por rayos X de un cristal de un solvato de isopropanol del compuesto A (Ejemplo de Referencia 1) .
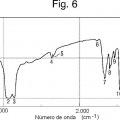
La Fig. 6 muestra un espectro de absorción de infrarrojos (método de la pasta) de un cristal de un solvato de isopropanol del compuesto A (Ejemplo de Referencia 1) .
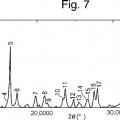
La Fig. 7 muestra un patrón de difracción de polvo por rayos X de un cristal de un solvato de dimetilacetamida del compuesto A (Ejemplo de Referencia 2) .
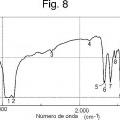
La Fig. 8 muestra un espectro de absorción de infrarrojos (método de la pasta) de un cristal de un solvato de dimetilacetamida del compuesto A (Ejemplo de Referencia 2) .
La Fig. 9 muestra un patrón de difracción de polvo por rayos X de un cristal de un solvato de dimetilformamida del compuesto A (Ejemplo de Referencia... [Seguir leyendo]
Reivindicaciones:
1. Un cristal de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico que tiene
(a) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2Î de 6, 7 ± 0, 2º , 8, 3 ± 0, 2º , 8, 9 ± 0, 2º , 14, 0 ± 0, 2º , 14, 8 ± 0, 2º y 26, 4 ± 0, 2º en el espectro de difracción de polvo por rayos X;
X. 2. El cristal según la reivindicación 1 (a) , que muestra un pico endotérmico que tiene una temperatura máxima de pico de 362 ± 5 º C por calorimetría diferencial de barrido (DSC) . 3. El cristal según la reivindicación 1 (b) , que muestra un pico endotérmico que tiene una temperatura máxima de pico de 342 ± 5 º C por calorimetría diferencial de barrido (DSC) . 4. El cristal según cualquiera de las reivindicaciones 1 a 3, que es un cristal no solvatado y no hidratado. 5. Una mezcla de cristales que comprende el cristal según la reivindicación 1 (a) , y el cristal según la reivindicación 1 (b) . 6. Una mezcla de cristales según la reivindicación 5 que comprende un cristal según la reivindicación 2 y un cristal según la reivindicación 3. 7. Una composición farmacéutica que comprende el cristal o mezcla de cristales según cualquiera de las reivindicaciones 1 a 6 y un excipiente farmacéuticamente aceptable. 8. Un cristal o mezcla de cristales según cualquiera de las reivindicaciones 1 a 6 para uso como ingrediente activo en un procedimiento de terapia realizado en el cuerpo de un ser humano o de un animal. 9. Un cristal o mezcla de cristales según la reivindicación 8, para uso como inhibidor de la PDE9. 10. Un cristal o mezcla de cristales según la reivindicación 8, para uso como un agente terapéutico para el síndrome de vejiga hiperactiva, polaquiuria, incontinencia urinaria, disuria en la hiperplasia prostática benigna, vejiga neurogénica, cistitis intersticial, urolitiasis, hiperplasia prostática benigna, disfunción eréctil, deterioro cognitivo, neuropatía, enfermedad de Alzheimer, hipertensión pulmonar, enfermedades pulmonares obstructivas crónicas, enfermedades del corazón isquémico, hipertensión, angina de pecho, infarto de miocardio, arteriosclerosis, trombosis, embolia, o diabetes tipo I o diabetes de tipo II. 11. Un procedimiento para producir el cristal o cristales según cualquiera de las reivindicaciones 1 a 6, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4dihidrotien[2, 3-d]pirimidin-6-carboxílico. 12. Un procedimiento según la reivindicación 11, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico a no menos de 40 º C y menos de 50 º C durante 1 a 96 h, no menos de 50 º C y menos de 60 º C durante 0, 5 a 32 h, no menos de 60 º C y menos de 70 º C durante 0, 5 a 24 h, no menos de 70 º C y menos de 80 º C durante 0, 1 a 12 h, no menos de 80 º C y menos de 90 º C durante 0, 05 a 6 h, o no menos de 90 º C y no más de 100 º C durante 0, 01 a 3 h para producir un cristal como se definió en la reivindicación 1 (a) . 13. Un procedimiento según la reivindicación 11, que comprende una etapa de calentamiento de una suspensión acuosa de ácido 2- (3, 4-diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico a no menos de 60 º C y menos de 70 º C durante 144 h o más, no menos de 70 º C y menos de 80 º C durante 25 h o más, no menos de 80 º C y menos de 90 º C durante 23 h o más, no menos de 90 º C y no más de 100 º C durante 16 h o más para producir un cristal como se definió en la reivindicación 1 (b) . 14. Un procedimiento según cualquiera de las reivindicaciones 11 a 13, que comprende calentar una suspensión acuosa obtenida por neutralización o acidificación de una solución acuosa alcalina de ácido 2- (3, 4diclorobencil) -5-metil-4-oxo-3, 4-dihidrotien[2, 3-d]pirimidin-6-carboxílico. o (b) un patrón de difracción de polvo por rayos X que muestra picos de difracción a ángulos de difracción 2Î de 7, 3 ± 0, 2º , 11, 2 ± 0, 2º , 13, 3 ± 0, 2º , 17, 0 ± 0, 2º , 25, 5 ± 0, 2º y 27, 5 ± 0, 2º en el espectro de difracción de polvo por rayos
Patentes similares o relacionadas:
Composiciones que comprenden una proteína de fusión de VIP-ELP para su uso en el tratamiento de fibrosis quística, del 29 de Julio de 2020, de Phasebio Pharmaceuticals, Inc: Una composición farmacéutica que comprende una proteína de fusión que comprende un péptido intestinal vasoactivo (VIP) y uno o más péptidos de tipo elastina (ELP), que […]
Compuestos que tienen actividad antagonista del receptor muscarínico y agonista del receptor beta2 adrenérgico, del 29 de Julio de 2020, de CHIESI FARMACEUTICI S.P.A.: Un compuesto de fórmula general I **(Ver fórmula)** en la que Q es un grupo de fórmula Q1 **(Ver fórmula)** Z es H u OH; […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Nuevos moduladores de receptores de fosfato de esfingosina, del 15 de Julio de 2020, de THE SCRIPPS RESEARCH INSTITUTE: Una composicion farmaceutica que comprende un compuesto de formula 265: **(Ver fórmula)** o una sal, estereoisomero, hidrato o solvato farmaceuticamente aceptable […]
Inhibidor de fibrosis, del 1 de Julio de 2020, de NIPPON SHINYAKU CO., LTD.: Composición farmacéutica que comprende un derivado heterocíclico seleccionado de ácido 2-{4-[N-(5,6-difenilpirazin-2-il)-N-isopropilamino]butiloxi}acético […]
Dispositivo para el tratamiento de, tratamiento de complicaciones ocasionadas por, y/o prevención de trastornos respiratorios causados por infecciones bacterianas, víricas, protozoarias, fúngicas y/o microbianas, preferiblemente para el tratamiento de complicaciones ocasionadas por fibrosis quística, del 1 de Julio de 2020, de Linde GmbH: Óxido nítrico gaseoso para usar como un medicamento inhalable en el tratamiento y/o prevención de trastornos respiratorios secundarios de la región respiratoria […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]