Síntesis y utilización de análogos de fosforotioato antiinversos de la caperuza de ARN mensajero.
Compuesto que presenta una de las estructuras siguientes:**Fórmula**
y**Fórmula** en las que:
cada Y se selecciona de entre el grupo que consiste en O y S; los diversos Y pueden ser iguales o diferentes; y por lo menos un Y es S;
R1 se selecciona de entre el grupo que consiste en H, OH, OCH3, y OCH2CH3;
R2 se selecciona de entre el grupo que consiste en H, OH, OCH3, y OCH2CH3;
n es 3 o 4;
si R1 es OH, entonces R2 no es OH;
B se selecciona de entre el grupo que consiste en guanina, adenina, uridina, citosina; y
X se selecciona de entre el grupo que consiste en metilo, etilo, propilo, butilo, bencilo, bencilo sustituido, naftilmetilo, naftilmetilo sustituido, y otros grupos alifáticos o aromáticos de C1 a C10 sustituidos y no sustituidos; los diversos X pueden ser iguales o diferentes.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/067494.
Solicitante: BOARD OF SUPERVISORS OF LOUISIANA STATE UNIVERSITY AND AGRICULTURAL AND MECHANICAL COLLEGE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: P.O. Box 16070 Baton Rouge, LA 70893 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KOWALSKA,JOANNA, JEMIELITY,JACEK, DARZYNKIEWICZ,EDWARD, RHOADS,ROBERT E, GRUDZIEN-NOGALSKA,EWA M.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H19/207 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 19/00 Compuestos que contienen un heterociclo que comparten un heteroátomo del ciclo con un radical sacárido; Nucleósidos; Mononucleótidos; Sus anhidro-derivados. › siendo los ácidos fosfóricos o polifosfóricos esterificados por otro compuesto hidroxílico, p. ej. los dinucleótidos de la flavina-adeína o de la nicotinamida-adenina.
PDF original: ES-2500515_T3.pdf
Fragmento de la descripción:
Síntesis y utilización de análogos de fosforotioato antiinversos de la caperuza de ARN mensajero
Los derechos de la fecha de presentación de la solicitud US provisional número de serie 6/944.842, presentada el 19 de junio de 27, se reivindican bajo 35 U.S.C. § 119(e) en los Estados Unidos de América, y se reivindican bajo los tratados y convenciones aplicables en todos los países.
El desarrollo de la presente invención fue financiado por el Gobierno de los Estados Unidos de América bajo el número de concesión R1GM2818 concedido por el National Institute of General Medical Sciences. El Gobierno de los Estados Unidos de América tiene ciertos derechos en esta invención.
El desarrollo de la presente invención fue financiado parcialmente por el Gobierno de Polonia con el número de concesión 2 P4A 6 28 concedido por el Ministerio Polaco de Ciencia y Educación Superior.
Campo técnico
Se han sintetizado nuevos análogos de fosforotioato antiinverso de la caperuza (cap) del ARN mensajero, y se ha demostrado que son útiles en la traducción de ARNm.
Antecedentes de la técnica
En eucariotas, los extremos 5 de la mayoría de los ARN mensajeros (ARNm) están bloqueados, o con caperuza. Además, existen algunas otras formas de ARN que también presentan caperuza, por ejemplo ARN nucleares pequeños (ARNnp). La caperuza contiene un enlace de trifosfato 5-5 entre dos restos nucleosídicos, y un grupo 7- metilo en un anillo de guanina distal. El formación de caperuza (capping) de ARNm y ARNnp promueve sus funciones normales en las células.
La capacidad para sintetizar in vitro moléculas de ARN con caperuza es útil debido a que permite preparar moléculas de ARN que se comportan apropiadamente en una variedad de aplicaciones biológicas. Tales aplicaciones incluyen tanto aplicaciones de investigación así como la producción comercial de polipéptidos, por ejemplo la producción en un sistema de traducción libre de células de polipéptidos que contienen un aminoácido no natural en un sitio específico, o la producción en células cultivadas de polipéptidos que requieren modificación postraduccional para su actividad o estabilidad. En estos últimos sistemas, la síntesis transcurre durante un tiempo considerablemente largo, y por lo tanto produce más proteína.
El método más frecuentemente usado para obtener in vitro ARN con caperuza es transcribir un molde de ADN con una ARN polimerasa bacteriana o de bacteriófago en presencia de los cuatro trifosfatos de ribonucleósidos y un dinucleótido de caperuza tal como m7G(5)ppp(5)G (en adelante m7GpppG). La polimerasa inicia la transcripción con un ataque nucleofílico por el 3-OH del resto Guo de m7GpppG en el a-fosfato del siguiente trifosfato de nucleósido en la plantilla, dando como resultado el producto inicial m7GpppGpN. El producto iniciado por GTP alternativo, pppGpN se suprime ajustando la relación de m7GpppG a GTP entre 5 y 1 en la mezcla de reacción de transcripción.
Los ARN sintéticos se pueden sintetizar mediante la transcripción libre de células de moldes de ADN. Véanse Contreras et al., Simple, efficient in vitro synthesis of capped RNA useful for direct expression of cloned eukaryotic genes, Nucí. Acids Res., vol. 1, p. 6353-6362 (1982); J. Yisraeli et al., Synthesis of long, capped transcripts in vitro by SP6 and T7 RNA polymerases, p. 42-5 en J. Dahlberg et al. (Eds.), Meth. Enzymol., vol. 18., p. 42-5 (1989); y D. Melton et al., Efficient in vitro synthesis of biologically active RNA and RNA hybridization probes from plasmids containing a bacteriophage SP6 promoter, Nucí. Acids Res., vol. 12, p. 735-756 (1984).
Los ARN con caperuza así producidos son activos en reacciones de ayuste llevadas a cabo in vitro. Véanse M. Konarska et al., Recognition of cap structure in splicing in vitro of mRNA precursors. Cell, vol. 38, p. 731-736 (1984); e I. Edery et al., Cap-dependent RNA splicing in a HeLa nuclear extract, Proc. Nati. Acad. Sci. USA, vol. 82, p. 759-7594 (1985).
Los ARNm con caperuza se traducen en sistemas de traducción libres de célula de forma más eficiente que lo que lo hacen los ARNm sin caperuza. Véanse S. Muthukrishnan et al., 5'-Terminal 7-methylguanosine in eukaryotic mRNA ¡s required for translation, Nature, vol. 255, p. 33-37 (1975); L. Chu et al., Paradoxical observations on the 5 terminus of ovalbumin messenger ribonucleic acid, J. Biol. Chem., vol. 253, p. 5228-5231 (1978); E. Darzynkiewicz et al., (3-Globin mRNAs capped with m7G,
nri227G or m3227G differ in intrinsic translation efficiency, Nucí. Acids Res., vol. 16, p. 8953-8962 (1988); y E. Darzynkiewicz et al., Inhibition of eukaryotic translation by nucleoside 5-monophosphate analogues of mRNA 5- cap: Changes in N7 substituent affect analogue activity, Biochem., vol. 28, p. 4771-4778 (1989).
Los ARNm no metilados en 5 son traduccionalmente menos activos que los ARNm metilados en 5. Véase G. Both et al., Methylation-dependent translation of viral messenger RNAs in vitro, Proc. Nati. Acad Sci. USA, vol. 72, p. 1189-1193 (1975).
Los ARNm con caperuza introducidos mediante electroporación en células de mamífero cultivadas son traducidos más eficientemente que lo que lo son los ARNm sin caperuza. Véase E. Grudzien et al., Differential inhibition of mRNA degradation pathways by novel cap analogs, J. Biol. Chem. vol. 281, p. 1857-1867 (26).
A. Pasquinelli et al., Reverse 5' caps in RNAs made in vitro by phage RNA polymerases, RNA, vol. 1, p. 957-967 (1995), dieron a conocer que las polimerasas de bacteriófagos usan el 3-OH del resto de 7-metilguanosina de m7GpppG para iniciar la transcripción, demostrando que aproximadamente de un tercio a una mitad de los productos de ARN obtenidos con este análogo de caperuza contienen realmente la caperuza en orientación invertida, es decir, Gpppm7GpN. Tales moléculas de ARN con caperuza inversa se comportan anormalmente. Los mismos autores dieron a conocer que cuando se inyectaron transcritos de ARNsn pre-UI con caperuza inversa en núcleos de Xenopus laevis, se exportaron más lentamente que los transcritos naturales. De forma similar, los ARNsn U1 con caperuza inversa citoplásmicos en el citoplasma no se importaban apropiadamente al núcleo.
La presencia de una caperuza en ARNm estimula fuertemente la traducción de un transcrito de ARNm a proteína. E. Grudzien et al., Novel cap analogs for in vitro synthesis of mRNAs with high translational efficiency, RNA vol. 1, p. 1479-1487 (24), demostraron que los ARNm que contienen caperuzas incorporadas exclusivamente en la orientación inversa se tradujeron en un sistema libre de células con sólo 4% de la eficiencia de los ARNm que contienen caperuzas incorporadas exclusivamente en la orientación normal.
J. Stepinski et al., Synthesis and properties of mRNAs containing the novel anti-reverse cap analogues 7- methyl(3--methyl)GpppG and 7-methyl(3-deoxy)GpppG, RNA, vol. 7, p. 1486-1495 (21) dieron a conocer la síntesis y uso de dos nuevos análogos de caperuza, m73dGpppG y m27'3"°GpppG, que son incapaces de incorporarse en la orientación inversa. Los ARNm a los que se les añaden la caperuza con estos análogos de caperuza antiinversos (ARCAs) se tradujeron más eficientemente en un sistema in vitro que los ARNm a los que se les añadieron la caperuza con el análogo convencional, m7GpppG. Véase también la patente U.S. n° 7.74.596, y la Publicación de Solicitud de Patente U.S. 23/194759.
Z. Peng et al., Synthesis and application of a chain-terminating dinucleotide mRNA cap analog, Org. Lett, vol. 4, p. 161-164 (22) dieron a conocer la síntesis de °GpppG y su uso en la transcripción in vitro de ARN con caperuza homogéneamente.
J. Jemielity et al, Novel `anti-reverse cap analogues with superior translational properties, RNA, vol. 9 p. 118- 1122 (23) dieron a conocer que la sustitución en la posición 2 con -OCH3 o -H, para producir m27,2"óGpppG o m72dGpppG, respectivamente, produjeron ARCA con propiedades equivalentes a o ligeramente más favorables que aquellas de los ARCA sustituidos en la posición 3 según se mide mediante los criterios de unión a la proteína de unión a caperuza traduccional elF4E, incorporación correcta en ARNm durante la transcripción in vitro y eficiencia traduccional de los ARNm resultantes en un sistema libre de células.
La cantidad de proteína producida a partir de ARNm sintéticos introducidos en células de mamífero cultivadas está limitada por la degradación del ARNm por procesos de recambio naturales. Una ruta in vivo importante de la degradación de ARNm se inicia mediante la eliminación de la caperuza desde el ARNm intacto mediante una pirofosfatasa específica, Dep1/Dcp2, que escinde entre los a y fosfatos. E. Grudzien et al., Differential inhibition... [Seguir leyendo]
Reivindicaciones:
1. Compuesto que presenta una de las estructuras siguientes:
en las que:
cada Y se selecciona de entre el grupo que consiste en O y S; los diversos Y pueden ser iguales o dif y por lo menos un Y es S;
R1 se selecciona de entre el grupo que consiste en H, OH, OCH3, y OCH2CH3;
R2 se selecciona de entre el grupo que consiste en H, OH, OCH3, y OCH2CH3; n es 3 o 4;
si R1 es OH, entonces R2 no es OH;
B se selecciona de entre el grupo que consiste en guanina, adenlna, uridina, cltoslna; y
X se selecciona de entre el grupo que consiste en metilo, etilo, propilo, butilo, bencilo, bencilo sustituido, naftilmetilo, naftilmetilo sustituido, y otros grupos alifáticos o aromáticos de C1 a C1 sustituidos y no sustituidos; los diversos X pueden ser iguales o diferentes.
2. Compuesto según la reivindicación 1, que presenta la estructura
3. Compuesto según la reivindicación 1, que presenta la estructura
en la que B se selecciona de entre el grupo que consiste en
4. Compuesto según la reivindicación 1, que presenta la estructura
5. Compuesto según la reivindicación 1, seleccionado de entre el grupo que consiste en m272'GppspG; m273' °GppspG; m272'GpppspG; m273'GpppspG; m272'GppsppG; m273'GppsppG; m272'GpspspG; m273'bGpspspG; m272'°GppspsG; rn273'GppspsG, bn7m2'°GppspG; bn7rrr'bGppspG, bn7m2'bGpppspG: bn7m3'GpppspG; bn7m2' °GppsppG; bn7m3'°GppsppG; bn7m2'°GpspspG; bn7m3'°GpspspG; bn7m2'°GppspsG; y bn7m3'°GppspsG.
6. Compuesto según cualquiera o más de las reivindicaciones anteriores, en el que dicho compuesto consiste esencialmente en un único estereoisómero.
7. Compuesto según cualquiera o más de las reivindicaciones 1 a 5, en el que dicho compuesto es una mezcla de al menos dos diastereómeros, un primer diastereómero y un segundo diastereómero; en el que dichos primer y segundo diastereómeros son por lo demás idénticos, a excepción de que dichos primer y segundo diastereómeros presentan unas diferentes configuraciones estereoquímicas en un átomo de fósforo quiral; en el que dicho átomo de fósforo quiral es un átomo de fósforo que está unido a un átomo de azufre.
8. Molécula de ARN cuyo extremo 5 incorpora un compuesto según cualquiera o más de las reivindicaciones 1 a 5.
9. Método para sintetizar una molécula de ARN según la reivindicación 8 in vitro\ comprendiendo dicho método hacer reaccionar ATP, CTP, UTP, GTP, un compuesto como se ha mencionado, y un molde polinucleotídico, en presencia de una ARN polimerasa, en condiciones que conduzcan a la transcripción por la ARN polimerasa del molde polinucleotídico en una copia de ARN; incorporando así algunas de las copias de ARN el compuesto como se ha mencionado para realizar una molécula de ARN como se ha mencionado.
1. Método para sintetizar una proteína o péptido in vitro, comprendiendo dicho método traducir una molécula de ARN según la reivindicación 8 en un sistema de síntesis proteica libre de células, en el que la molécula de ARN comprende un marco abierto de lectura, en condiciones que conduzcan a traducir el marco abierto de lectura de la molécula de ARN en la proteína o péptido codificados por el marco abierto de lectura.
11. Método para sintetizar una proteína o péptido in vivo, comprendiendo dicho método introducir una molécula de ARN según la reivindicación 8 en células, en el que la molécula de ARN comprende un marco abierto de lectura, en condiciones que conduzcan a traducir el marco abierto de lectura de la molécula de ARN en la proteína o péptido codificados por el marco abierto de lectura.
12. Compuesto según cualquiera o más de las reivindicaciones 1 a 5, en el que n es 3 y dicho compuesto contiene un grupo |3-fosforotioato, o en el que n es 4 y dicho compuesto contiene un grupo y-fosforotioato; y en el que dicho compuesto no es hidrolizado por Dcp2 en condiciones fisiológicas.
13. Compuesto según cualquiera o más de las reivindicaciones 1 a 5, en el que n es 3 y dicho compuesto contiene un grupo y-fosforotioato; o en el que n es 4 y dicho compuesto contiene un grupo 8-fosforotioato; y en el que dicho compuesto no es hidrolizado por DcpS en condiciones fisiológicas, y dicho compuesto inhibe la traducción dependiente de la caperuza.
14. Método para sintetizar una proteína o péptido in vivo, comprendiendo dicho método introducir en células una molécula de ARN cuyo extremo 5 incorpora un compuesto según la reivindicación 12, en el que la molécula de ARN comprende un marco abierto de lectura, en condiciones que conduzcan a traducir el marco abierto de lectura de la molécula de ARN en la proteína o péptido codificados por el marco abierto de lectura; en el que la velocidad de traducción in vivo es al menos dos veces la velocidad de traducción in vivo que se obtendría a partir de un método por lo demás idéntico en el que cada Y es un átomo de oxígeno, y en el que ningún Y es un átomo de azufre.
Patentes similares o relacionadas:
Derivados fosforamidato de nucleósidos como agentes anticancerígenos, del 10 de Junio de 2020, de NuCana plc: Un compuesto de la fórmula (I), o una sal aceptable farmacéuticamente del mismo: **(Ver fórmula)** R1 es arilo; R2 se selecciona […]
2''-spiro-nucleótidos para el tratamiento de hepatitis C, del 9 de Enero de 2019, de Gilead Pharmasset LLC: Un compuesto o su estereoisómero o su sal o su deuteruro representados por la fórmula I-3-4**Fórmula** en donde 1) R1 se selecciona de entre: […]
Síntesis estereoselectiva de principios activos que contienen fósforo, del 16 de Agosto de 2017, de Gilead Pharmasset LLC: Un proceso para preparar un principio activo que contiene fósforo enantiomérica o diastereoméricamente enriquecido, una sal o una sal farmacéuticamente aceptable […]
Proceso para la cristalización de 2-(((S)-(perfluorofenoxi)(fenoxi)fosforil)amino)propanoato de (S)-isopropilo, del 24 de Mayo de 2017, de Gilead Pharmasset LLC: Proceso para preparar 2-(((S)-(perfluorofenoxi)(fenoxi)fosforil)amino)propanoato de (S)-isopropilo cristalino representado por la fórmula**Fórmula** […]
Derivados estables de NAD/NADH, del 5 de Marzo de 2014, de F. HOFFMANN-LA ROCHE AG: Elemento de ensayo para la determinación de un analito, que comprende (i) un enzima dependiente de coenzima y (ii) como coenzima un compuesto de […]
Derivados estables de NAD/NADH, del 5 de Marzo de 2014, de F. HOFFMANN-LA ROCHE AG: Elemento de ensayo para la determinación de glucosa, que comprende (i) una glucosa-deshidrogenasa (EC 1.1.1.47) y (ii) como coenzima un compuesto de la siguiente fórmula general […]
Derivados estables de NAD/NADH, del 26 de Febrero de 2014, de F. HOFFMANN-LA ROCHE AG: Elemento de ensayo para la determinación de un analito, que comprende (i) una enzima dependiente de coenzima o un sustrato para una enzima de este tipo y (ii) […]
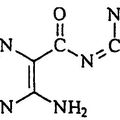 COMPUESTOS FARMACOLOGICAMENTE ACTIVOS CON DOS PRINCIPIOS ACTIVOS UNIDOS COVALENTEMENTE (BLOQUEANTE DE LOS CANALES DE SODIO/AGONISTA DEL RECEPTOR P2Y2) PARA EL TRATAMIENTO DE SUPERFICIES MUCOSAS, del 16 de Octubre de 2008, de UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
BOUCHER, RICHARD C., JR.: Un compuesto con la fórmula P1-L-P2, en la que: P1 es un bloqueante de los canales de sodio de piracinoilguanidina; L es un grupo enlazante seleccionado entre un heteroátomo; […]
COMPUESTOS FARMACOLOGICAMENTE ACTIVOS CON DOS PRINCIPIOS ACTIVOS UNIDOS COVALENTEMENTE (BLOQUEANTE DE LOS CANALES DE SODIO/AGONISTA DEL RECEPTOR P2Y2) PARA EL TRATAMIENTO DE SUPERFICIES MUCOSAS, del 16 de Octubre de 2008, de UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL
BOUCHER, RICHARD C., JR.: Un compuesto con la fórmula P1-L-P2, en la que: P1 es un bloqueante de los canales de sodio de piracinoilguanidina; L es un grupo enlazante seleccionado entre un heteroátomo; […]