SAPOSINA C Y RECEPTORES COMO DIANAS PARA EL TRATAMIENTO DE TRASTORNOS BENIGNOS Y MALIGNOS.
Un conjugado de ligando/toxina que comprende un ligando capaz de unirse al receptor de una célula cancerosa que se une a saposina C,
conjugado a un grupo toxina, donde el conjugado indicado se une al receptor de la célula, y donde dicho ligando es saposina C o una prosaptida de la misma
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/040648.
Solicitante: BOARD OF SUPERVISORS OF LOUISIANA STATE UNIVERSITY AND AGRICULTURAL AND MECHANICAL COLLEGE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 111 SYSTEMS BUILDING, 3810 WEST LAKESHORE DRIVE,BATON ROUGE, LA 70808.
Inventor/es: KOOCHEKPOUR,SHAHRIAR, SARTOR,OLIVIER,A.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K14/415 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de vegetales.
- C07K14/475 C07K 14/00 […] › Factores de crecimiento; Reguladores de crecimiento.
Clasificación PCT:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
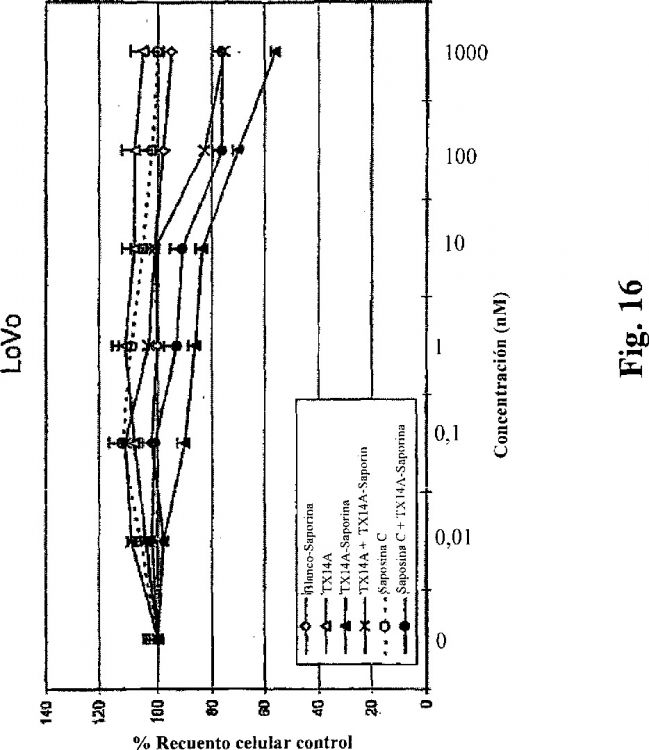
Fragmento de la descripción:
Saposina C y receptores como dianas para el tratamiento de trastornos benignos y malignos.
Antecedentes de la técnica
La importancia de las dianas moleculares está aumentando constantemente en el desarrollo de fármacos para el tratamiento de enfermedades. Una diana molecular proporciona un enfoque para el desarrollo de fármacos nuevos al dirigir a los investigadores a moléculas diseñadas específicamente que interfieren con esas dianas de la manera deseada. En la actualidad, existen muchos ejemplos de terapias dirigidas que han tenido éxito en los trastornos del crecimiento celular. Véanse M.S. Tallman, "Advancing the treatment of hematological malignancies through the development of targeted interventions", Semin. Hematol., vol. 39, Supl. 3, págs. 1-5 (2002); y L. Gianni, "The future of targeted therapy: combining novel agents", Oncology, vol. 63, Supl. 1, págs. 47-56 (2002).
Los trastornos del crecimiento de la próstata, incluyendo cáncer de próstata e hiperplasia benigna de próstata (HBP), afectan a más de 500.000 hombres al año. El cáncer de próstata es un problema importante de salud pública en todo el mundo, y sólo el cáncer de pulmón causa más fallecimientos en varones.
La hiperplasia benigna de próstata (HBP) se caracteriza clínicamente por el crecimiento de la glándula prostática causando la obstrucción del flujo de la orina, y patológicamente por la proliferación de las células epiteliales y estromales prostáticas (por ej., fibroblastos y músculo liso). Una causa principal del crecimiento de la próstata relacionada con la HBP es el aumento en el volumen estromal de la glándula prostática. La HBP y sus signos y síntomas relacionados son extremadamente comunes entre los varones al envejecer. La preponderancia de la HBP aumenta constantemente con la edad hasta alcanzar un 80-90% entre los varones de 80 a 90 años de edad. Según las estimaciones de la Agency for Health Care Policy and Research (AHCPR), aproximadamente 5,6 millones de varones entre los 50 y los 79 años de edad cumplen con las directrices de la AHCPR para el tratamiento de la HBP. Véase J.D. McConnell et al., "Benign prostatic hyperplasia: Diagnosis and treatment", Clinical Practice Guideline, Número 8, AHCPR, Publicación nº 94-0582, Agency for Health Care Policy and Research, Servicio de Salud Pública, Departamento Estadounidense de Salud y Servicios Humanos, Rockville, Maryland, EE.UU. (1994). El crecimiento normal, benigno y neoplásico de la próstata depende bastante de las interacciones entre las células estromales y las epiteliales. Véase L.W. Chung, "The role of stromal-epithelial interaction in normal and malignant growth", Cancer Survey, vol. 23, págs. 33-42 (1995). El impacto del tratamiento médico sobre la inhibición del avance de la HBP se está haciendo cada vez más patente. La identificación de las moléculas que influyen el crecimiento o proliferación de las células epiteliales y estromales prostáticas en la HBP puede ocasionar el desarrollo de enfoques terapéuticos diferentes.
Se conocen otros trastornos de la proliferación de las células estromales, especialmente la proliferación de las células de los músculos lisos. Por ejemplo, la proliferación de las células de los músculos lisos es un evento dominante en la ateroesclerosis y la restenosis vascular. Véanse S.M. Schwartz, "Smooth muscle proliferation in hypertension. State-of-the-art lecture", Hypertension, vol. 6, págs. I56-61 (1984); y E.R. O'Brien et al., "Proliferation in primary and restenotic coronary atherectomy tissue. Implications for antiproliferative therapy", Cir. Res., vol. 73, págs. 223-231 (1993). Más aún, el patrón de la expresión del mARN asociada con la proliferación celular en músculo liso de HBP es parecido al patrón observado en las células proliferantes en músculo liso en la ateroesclerosis. Véase V.K. Lin et al., "Myosin heavy chain gene expression in normal and hyperplastic human prostate tissue", Prostate, vol. 44, págs. 193-203 (2000). Estas referencias sugieren que los agentes diana para la proliferación de las células estromales pueden emplearse en el tratamiento de HBP, ateroesclerosis y restenosis vascular.
Aunque desde hace muchas décadas se sabe que la mayoría de los cánceres de próstata dependen del andrógeno, las estrategias de tratamiento usando andrógeno y sus rutas de señalamiento como diana molecular inevitablemente han resultado en fallos del tratamiento. Aunque en las fases iniciales del tratamiento el cáncer de próstata depende principalmente del andrógeno, con el paso del tiempo el cáncer deja de depender de él. Además, las células estromales prostáticas sensibles al andrógeno son importantes en el crecimiento y avance del cáncer de próstata. Diversas hormonas, hormonas peptídicas y factores de crecimiento polipeptídico (por ej., FCE (factor de crecimiento epitelial), FTC-a y ß (factores transformadores del crecimiento alfa y beta), FCI-I y II (factor de crecimiento de tipo insulínico uno y dos) y bFGF (factor de crecimiento fibroblástico básico)) han estado implicados en el crecimiento y diferenciación de las células de cáncer de próstata.
La glándula prostática requiere andrógenos y factores de crecimiento para la proliferación y mantenimiento de su función. El desarrollo de la próstata depende de los andrógenos, y las células epiteliales secretoras de la próstata normal presentan apoptosis en la ausencia de andrógenos. Véase V. Gnanapragasam et al., "Androgen receptor signaling in the prostate", Br. J. Urol., vol. 86, págs. 1001-10013 (2000). En una glándula prostática normal, la ablación de los andrógenos ocasiona la involución del epitelio prostático.
Las células del cáncer de próstata inicialmente dependen del andrógeno para su crecimiento. Esta etapa del cáncer de próstata dependiente del andrógeno puede tratarse con métodos de privación de andrógeno, como la castración o la administración de fármacos anti-andrógeno. Sin embargo, en pacientes que han sido sometidos a una terapia prolongada de fármacos anti-andrógeno, las células de cáncer de próstata adquieren la habilidad de proliferarse en ausencia de andrógeno (V. Gnanapragasam et al., 2000). Más aún, normalmente se observa el avance al cáncer de próstata independiente del andrógeno (la etapa avanzada de la enfermedad), para el cual no existe un tratamiento satisfactorio. Aunque independientes del andrógeno, estas células de cáncer de próstata tardío continúan expresando genes cuya estimulación es hecha por el andrógeno, lo que sugiere una activación independiente del andrógeno de la ruta de señalamiento del receptor del andrógeno (RA). El receptor del andrógeno (RA) es un mediador fundamental para el efecto del andrógeno. Se desconocen los mecanismos fisiológicos que participan en el cambio a las células de cáncer independientes del andrógeno, y en la activación independiente del andrógeno de la ruta de señalamiento del RA.
El antígeno específico de la próstata (PSA) es un marcador tumoral específico de la próstata, y el marcador usado más frecuentemente para revisar, diagnosticar y determinar la prognosis de pacientes con cáncer de próstata en todo el mundo. Los andrógenos son reguladores reconocidos de la expresión del PSA. Sin embargo, aún después de la ablación del andrógeno, los niveles del PSA pueden aumentar y se emplean para indicar una enfermedad recurrente. Se ha informado sobre la activación no androgénica de los receptores del andrógeno que provocan el estímulo de la expresión del PSA, por ej., FGF-6 e IL-6 (interleucina-6). Estos reguladores reconocidos de la expresión del PSA contribuyen a un fenotipo más maligno en el cáncer de próstata. Véase D.-L. Lin et al., "Interleukin-6 induces androgen responsiveness in prostate cancer cells through up-regulation of androgen receptor expression", Clin. Cancer Res. vol. 7, págs. 1773-1781 (2001).
Para que un cáncer de próstata avance a la etapa independiente del andrógeno se requiere una interacción entre las células cancerosas, las proteínas de la matriz extracelular y las células estromales cercanas. Los receptores del andrógeno están presentes en las células estromales prostáticas, y se sabe que dichas células responden a los andrógenos. Véase J. Mohler et al., "Androgen and glucocorticoid receptors in the stroma and epithelium of prostatic hyperplasia and carcinoma", Clin. Cancer Res., vol. 2, págs. 889-895 (1996). Las células estromales prostáticas también expresan diversos factores de crecimiento (por ej., FCE FTC-ß1, bFGF y FCEV) y poseen receptores para los factores de crecimiento. Véase...
Reivindicaciones:
1. Un conjugado de ligando/toxina que comprende un ligando capaz de unirse al receptor de una célula cancerosa que se une a saposina C, conjugado a un grupo toxina, donde el conjugado indicado se une al receptor de la célula, y donde dicho ligando es saposina C o una prosaptida de la misma.
2. Un conjugado como el indicado en la reivindicación 1, donde la célula cancerosa se selecciona de entre el grupo formado por células de cáncer de próstata, células de cáncer de mama, células de cáncer de pulmón y células de cáncer de colon.
3. Un conjugado como el indicado en la reivindicación 2, donde dicha célula cancerosa es una célula de cáncer de próstata.
4. Un conjugado de ligando/toxina que comprende un ligando capaz de unirse al receptor de una célula estromal que se une a saposina C, conjugado a un grupo toxina, donde el conjugado indicado se une al receptor de la célula y donde dicho ligando es saposina C o una prosaptida de la misma.
5. Un conjugado como el indicado en la reivindicación 4, donde el receptor de la célula estromal es un receptor encontrado en una célula estromal de próstata.
6. Un conjugado como el indicado en las reivindicaciones 1-5, donde el ligando es saposina C.
7. Un conjugado como el indicado en las reivindicaciones 1-5, donde dicho ligando es una prosaptida.
8. Un conjugado como el indicado en la reivindicación 7, donde dicha prosaptida es TX14A.
9. Un conjugado como el indicado en cualquiera de las reivindicaciones anteriores, en donde el agente citotóxico se selecciona de entre el grupo formado por la toxina de la difteria, toxina ricina, toxina abrina, exotoxina de pseudomonas, toxina shiga, a-amanitina, proteína antiviral de fitolaca (PAP), proteínas inhibidoras del ribosoma (RIP), melfalan, metotrexato, mostaza nitrogenada, doxorubicina, daunomicima, un radioisótopo ionizante y otros agentes citotóxicos.
10. Un conjugado como el indicado en la reivindicación 9, donde el agente citotóxico es una proteína inhibidora del ribosoma.
11. Un conjugado como el indicado en la reivindicación 10, donde el agente citotóxico es saporina.
12. Una composición farmacéutica que comprende un conjugado como el indicado en cualquiera de las reivindicaciones anteriores y un excipiente fisiológicamente aceptable.
Patentes similares o relacionadas:
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Composiciones y procedimientos de uso para el tratamiento de trastornos metabólicos, del 18 de Marzo de 2020, de NGM Biopharmaceuticals, Inc: Un complejo que comprende un primer heterodímero y un segundo heterodímero, comprendiendo cada uno del primer heterodímero y segundo heterodímero: (i) un primer polipéptido […]
Factor 11 de diferenciación del crecimiento (GDF) para el tratamiento de afecciones cardiovasculares relacionadas con la edad, del 26 de Febrero de 2020, de THE BRIGHAM AND WOMEN'S HOSPITAL, INC.: Una composición que aumenta el nivel de polipéptido GDF11 en la circulación o en el tejido cardíaco de un sujeto por encima del nivel de GDF11 en el sujeto antes […]
Péptidos de Ledgf y formulaciones de los mismos para el tratamiento de trastornos degenerativos, del 19 de Febrero de 2020, de The Regents of the University of Colorado, a body corporate: Un péptido purificado, que es un fragmento del factor de crecimiento derivado del epitelio del cristalino (LEDGF) de longitud completa, teniendo el péptido una pureza […]
Métodos para aumentar la producción de células madre hematopoyéticas y plaquetas, del 22 de Enero de 2020, de Janssen Pharmaceuticals, Inc: Una composición farmacéutica para su uso en un método de (i) proporcionar células madre hematopoyéticas a un sujeto; (ii) reducir el tiempo de injerto […]
Moléculas de unión a ligando y usos de las mismas, del 25 de Diciembre de 2019, de Vegenics Pty Limited: Una molécula de unión a ligando que comprende un polipéptido de unión a ligando fusionado a un fragmento de dominio constante de inmunoglobulina, comprendiendo […]
Proceso para la preparación de mezclas de alta pureza de factores proteínicos procedentes de calostro bovino, del 13 de Noviembre de 2019, de Tenagro S.r.l: Proceso para la preparación de una mezcla de factores proteínicos procedentes de calostro bovino que comprende las siguientes etapas: […]
Proteínas agonistas del receptor MET, del 25 de Septiembre de 2019, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: Proteína que contiene dos dominios peptídicos, llamados respectivamente K1a y K1b, comprendiendo cada uno de dichos dominios peptídicos K1a y K1b un […]