Nuevos compuestos inhibidores de la proteina tirosina fosfatasa 1B.
Nuevos compuestos inhibidores de la Proteína Tirosina Fosfatasa 1B.
Esta invención está relacionada con nuevos compuestos de Fórmulas I, II y III, con métodos para prepararlos, con el uso de los mismos como inhibidores de proteína tirosina fosfatasa 1B (PTP1B) y con el uso de los intermedios que conducen a dichos compuestos para preparar un inhibidor de PTP1B comprendido por dichas fórmulas. Estos compuestos tienen aplicación en el tratamiento o prevención de enfermedades en las cuales se conoce que la PTP1B está implicada en la patogénesis, por lo que pueden utilizarse para el tratamiento de la resistencia a la insulina, intolerancia a la glucosa, obesidad, diabetes mellitus, hipertensión y enfermedades isquémicas de vasos sanguíneos grandes y pequeños, condiciones que acompañan la diabetes tipo 2 y otros trastornos donde la resistencia a la insulina está indicada.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201330691.
Solicitante: UNIVERSIDAD DE ALCALA..
Nacionalidad solicitante: España.
Inventor/es: ALAJARIN FERRANDEZ,RAMON, DIEZ MARQUES,MARIA LUISA, RODRIGUEZ PUYOL,DIEGO, RODRIGUEZ PUYOL,MANUEL, VAQUERO LOPEZ,JUAN JOSE, GRIERA MERINO,Mercedes, SÁNCHEZ ALONSO,Patricia.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/498 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Pirazinas o piperazinas condensadas en orto o en peri con sistemas carbocíclicos, p. ej. quinoxalina, fenazina.
- C07D241/40 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 241/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,4 o diazina-1,4 hidrogenada. › Benzopirazinas.
- C07D471/04 C07D […] › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas condensados en orto.
Fragmento de la descripción:
NUEVOS COMPUESTOS INHIBIDORES DE LA PROTEINA TIROSINA FOSFATASA 1B SECTOR DE LA TÉCNICA
La presente invención está relacionada con el campo de la síntesis química de compuestos bioactivos frente a Proteína tirosina fosfatasa 1B (PTP1B) que se comportan como inhibidores de dicha proteína y a los intermedios utilizados en el método de su preparación.
ESTADO DE LA TÉCNICA
La diabetes mellitus es un problema de salud importante y creciente en el mundo (Yach, D., etal. Nat. Med. 2006, 12, 62-6). La diabetes mellitus tipo 2 (diabetes tipo 2), también conocida como diabetes mellitus no dependiente de insulina, es un trastorno heterogéneo, con factores tanto genéticos como ambientales que contribuyen a su desarrollo. La patogénesis de la diabetes tipo 2 implica mecanismos múltiples que conducen a hiperglicemia, producción de glucosa hepática considerablemente aumentada, secreción disminuida de insulina por las células p y una captación de glucosa reducida por el músculo esquelético y el tejido adiposo (resistencia a insulina periférica). Los pacientes diabéticos tipo 2 tienen un riesgo sustancialmente elevado de enfermedad macrovascular incluyendo enfermedad coronaria e infarto cerebral, y enfermedad microvascular incluyendo retinopatía, nefropatía y neuropatía.
La diabetes tipo 2 es un campo terapéutico con un enorme mercado potencial. El incremento del número de pacientes se ha estimado desde 170-175 millones en 2000 hasta por encima de 230 millones en 2030 (Wild, S., et al. Diab. Care 2004, 27, 1047-53; Yach, D., etal. Nat. Med. 2006, 12, 62-6). Se espera que la mayor parte de este incremento ocurra en los países desarrollados e India será el país que tenga el mayor número de pacientes diabéticos en 2030.
Las estrategias de tratamiento de la diabetes tipo 2 incluyen dieta, ejercicio y farmacoterapia.
Las terapias clínicamente establecidas para la diabetes tipo 2 incluyen insulina y sus
análogos, y varios fármacos hipoglicémicos orales como sulfonilureas, metformin, inhibidores
de a-glucosidada (acarbosa, miglitol), secretagogos de insulina distintos de sulfonilureas
(repaglinida, nateglinida), y derivados tiazolidindiona (rosiglitazina, pioglitazona) que actúan
por agonismo de PPARy (Mathaei, R., et al. Endocrine Rev. 2000, 21, 585-618; Skyler, J. S.
J. Med. Chem. 2004, 47, 4113-7). Estos fármacos actúan por mecanismos distintos para
normalizar los niveles de glucosa en sangre, pero tienen una capacidad limitada, tanto solos
como combinados, para prevenir el inicio de las complicaciones de la diabetes. Además, cada uno de los fármacos mencionados presenta generalmente una eficacia insuficiente además de un número de efectos adversos. Por ejemplo, se sabe que las sulfonilureas, las cuales han sido la base del tratamiento oral durante 5 décadas, están asociadas con una tasa alta de fracaso secundario y hipoglucemia. Las glitazonas, mejoran la utilización de la glucosa sin estimular la liberación de insulina, pero su uso está asociado con efectos indeseables como riesgo de infarto de miocardio, hipertrofia cardiaca, toxicidad hepática y aumento de peso.
Teniendo en cuenta que el 90% de los casos de diabetes son casos de diabetes tipo 2 y que, además, los tratamientos actualmente disponibles son poco eficaces, existe una gran necesidad clínica y un amplio mercado potencial de nuevos fármacos antidiabéticos orales que mantengan el nivel glicémico bien controlado y que prevengan las complicaciones de las diabetes.
Las proteínas tirosina fosfatasas (PTPs) son una familia amplia de enzimas de señalización (Alonso, A., et al. Cell 2004, 117, 699-711) que juegan roles importantes en los procesos de transducción de señal intracelulares mediante la regulación celular del nivel de fosforilación de tirosina para controlar el crecimiento y la diferenciación celular, metabolismo, migración celular, transcripción genética, actividad de los canales de iones, respuesta inmune, apoptosis celular y desarrollo óseo (Hunter, C. Cell 2000, 100, 113-27). El funcionamiento desregulado de las PTPs es responsable de muchas enfermedades humanas como cáncer (Blume-Jensen, P. Natura 2001, 411, 355-65), diabetes (Montalibet, J. Drug Discov. Today. Therap. Strateg. 2005, 2, 129-35), obesidad (Cook, W. S. Developmental Cell 2002, 2, 385-7) y osteoporosis (Schiller, K. R. J. Cell Biochem. 2005, 96, 262-77).
Entre la variada familia de PTPs, la PTP1B activa c-Src en cáncer humano de mama (Bjorge, J. D. J. Biol. Chem. 2002, 275, 41439-46) y también influye en la regulación a la baja de la señalización de la insulina por desfosforilación del receptor de insulina incluyendo el sustrato del receptor de insulina 1 (IRS-1) y el sustrato del receptor de insulina 2 (IRS-2) (Walchli, S. J. Biol. Chem. 2000, 275, 9792-96). Por lo tanto, PTP1B puede ser una diana útil para la diabetes y el cáncer, y los inhibidores de PTP1B pueden ser fármacos prometedores para tratar estas enfermedades. Además, teniendo en cuenta que los ratones genéticamente deficientes en PTP1B son resistentes a la obesidad, PTP1B juega un rol crítico en el desarrollo de la obesidad (Klaman, L. D. Mol. Cell. Biol. 2000, 20, 5479-89). A pesar del potencial terapéutico de los inhibidores de PTP1B contra la diabetes, la obesidad y el cáncer, es difícil
desarrollar inhibidores selectivos de PTP1B frente a otras PTPs como SHP, VHR, LAR, CD45 y cdc25D, debido a las homologías estructurales entre las PTPs (Cheng, A. Eur. J. Biochem. 2002, 269, 1050-9; Penninger, J. M. J. Nat. Inmunol. 2001, 2, 389-96; Qu, C. K. Biochem. Biophys. Acta 2002, 1592, 297-301; Hoffman, B. T. Curr. Pharm. Des. 2004, 10, 1161-81). En concreto, debido a que la PTP de células T (TCPTP) tiene un 80% de homología con PTP1B en las regiones catalíticas, la inhibición no selectiva origina efectos secundarios severos (Tiganis, T. J. Biol. Chem. 1999, 274, 27768-75; You-Ten, K. E. J. Exp. Med. 1977, 186, 68393), aunque recientemente existen opiniones diferentes acerca de que PTP1B y TCPTP regulan coordinadamente un proceso de señalización de insulina (Galic, S. Mol. Cell Biol. 2005, 25, 819-29).
El potencial terapéutico de los inhibidores de PTPs, y de PTP1B en especial, para el tratamiento de enfermedades humanas se ha revisado extensivamente (Lee, K. Curr. Top. Med. Chem. 2003, 3, 797-807; Zhang, Z. Y. Acc. Chem. Res. 2003, 36, 285-92; Hoft van Huijsduijnen, R. H. J. Med. Chem. 2004, 47, 4142-46; Dewan, P. M. Curr. Chem. Res. 2005, 12, 1-22; Bialy, L. Angew. Chem. Int. Ed. 2005, 44, 3814-39; Zhang, Z. Y. Curr. Opin. Chem. Biol. 2001, 5, 416-23; Burke, T. R. Biopolymers (Peptide Science) 1999, 47, 225-41). En concreto, se ha revisado la biología estructural, el mecanismo y los inhibidores de PTP1B (Taylor, Curr. Top. Med. Chem. 2003, 3, 759-82) así como la aproximación de moléculas pequeñas para estudiar la función de PTP1B (Zhang, Methods, 2005, 31, 9-21) lo que introdujo las estrategias iniciales para encontrar inhibidores de PTP1B potentes y selectivos, la síntesis de análogos permeables a la célula para estudios celulares y la aplicación de esos inhibidores para diseccionar el papel de PTP1B en la vía de señalización de insulina. Las características estructurales y biológicas de inhibidores de bajo peso molecular específicos de PTP1B se han discutido en profundidad (Lee, S.; Wang, Q. Med. Res. Rev. 2007, 27, 553-73; Thareja, S.; Aggarwal, S.; Bardwaj, T. R.; Kumar, M. Med. Res. Rev. 2012, 32, 459-517), haciendo énfasis en la especificidad de inhibidores de bajo peso molecular de PTP1B frente a otras PTPs. Algunas clases de estos inhibidores de bajo peso molecular comprenden: tiazolidindionas, peptidomiméticos fosfotirosilo que contienen fósforo, isotiazolidinonas, peptidomiméticos fosfotirosilo con grupos ácidos que no contienen fósforo, bifenilbenzofuranos y bifenilbenzotiofenos, compuestos de vanadio, ácidos orto-oxalilamimobenzoicos, 1,2- naftoquinonas, 3-formilcromonas, análogos de piridazina, acetofenonas, catecoles, análogos de ácido isoxazolcarboxílico; ácidos cinámicos y análogos; peptidomiméticos; derivados metino-tetrasustituidos; pigmentos diterpeno tipo abietano; productos naturales y sus análogos, como los extraidos de raices de Broussonetia papyrifera, corteza de Erythirna
addisoniae, corteza de Erythirna abyssinica, Cinnamomun cassaia, corteza de raíz de Morus, Siegesbeckia glaberscens, Acanthopanax koreanum, rizomas de Astilbe koreana, raíces de Juglans regia, raíces de Saussurealappa Clarke, Ardisia japónica, Psydium Guiana, Steptomyces sp. MJ742-NF5, la esponja marina Hyrtios erectus, berberína o papaverina.
Aunque recientemente se ha llevado a cabo toda una diversidad de investigaciones sobre inhibidores de PTP1B, incluyendo estudios mecanísticos...
Reivindicaciones:
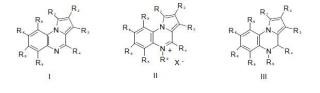
1. Compuestos de fórmula
**(Ver fórmula)**donde Ri, R2 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; cloro, bromo o yodo; R4 puede ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; R5, R6, R7 y R8 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; flúor, cloro, bromo o yodo; nitro; tiol; tioéter (RS-) donde el sustituyente R puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; éter (RO- ) donde el sustituyente R puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; amino primario, secundario (RNH-) o terciario (RRN-) donde los sustituyentes R y R en el nitrógeno pueden ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; acilamino primario (RCONH-), secundario (RCONR-) o terciario (RCONRR- ) donde el radical R del grupo acilo puede ser igual a cualquiera del grupo indicado para R4 y los sustituyentes R y R en el nitrógeno pueden ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; hidroxi; aciloxi (RCOO-) donde el radical R del grupo acilo puede ser igual a cualquiera del grupo indicado para R4; (RCO-) acilo donde el radical R grupo acilo puede ser igual a cualquiera del grupo indicado para R4; carboxamido primario, secundario (RNHCO-) o terciario (RRNCO-) donde los sustituyentes R y R en el nitrógeno puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; alcoxicarbonilo (ROCO-) donde el sustituyente R en el oxígeno puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; carboxi, así como sus sales farmacéuticamente aceptables.
2. Compuestos de fórmula
**(Ver fórmula)**donde Ri, R2, R3, R4, Rs, R6, R7 y Rs se han definido en la reivindicación anterior; donde Rg puede ser cualquiera del grupo formado por alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
y donde X es cloruro, bromuro, yoduro, sulfonato o cualquier anión farmacéuticamente aceptable.
3. Compuestos de fórmula
**(Ver fórmula)**donde R1, R2, R3, R4, Rs, Re, R7, Re se han definido en la reivindicación 1 y donde R9 puede ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático,
así como sus sales farmacéuticamente aceptables.
4. Un inhibidor de PTP1B que consiste en un compuesto según la reivindicación 1.
5. Un inhibidor de PTP1B que consiste en un compuesto según la reivindicación 2.
6. Un inhibidor de PTP1B que consiste en un compuesto según la reivindicación 3.
7. Uso de un compuesto según la reivindicación 1, caracterizado por utilizarse como un inhibidor de PTP1B.
8. Uso de un compuesto según la reivindicación 2, caracterizado por utilizarse como un inhibidor de PTP1B.
9. Uso de un compuesto según la reivindicación 3, caracterizado por utilizarse como un inhibidor de PTP1B.
10. Uso según cualquiera de las reivindicaciones 1 a 9, donde el compuesto se selecciona de entre:
a) 10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 6a)
b) 10/7-4,7-dimetilpirrolo[1,2-a]quinoxalina (Compuesto 6b)
c) 10/7-4,7,8-trimetilpirrolo[1,2-a]quinoxalina (Compuesto 6c)
d) 10/7-4-metil-7-metoxipirrolo[1,2-a]quinoxalina (Compuesto 6d)
e) 7-trifluorometil-10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 6e)
f) 8-cloro-10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 6f)
g) 7,8-dicloro-10/7-4-metilpirrolo[1,2-a]qu¡noxalina (Compuestos 6g)
h) 1-bromo-10H-4,7,8-trimetilpirrolo[1,2-a]quinoxalina (Compuesto 7ci)
i) 3-bromo-10H-4,7,8-trimetilpirrolo[1,2-a]quinoxalina (Compuesto Ici)
j) 1,2-dibromo-10/7-4,7,8-trimetilpirrolo[1,2-a]quinoxalina (Compuesto 7ci)
k) 1-bromo-8-cloro-10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 7fi)
l) 2-bromo-8-cloro-10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 7Í2)
m) Yoduro de 10/7-4,5-dimetilpirrolo[1,2-a]quinoxal-5-inio (Compuesto 8a)
n) Yoduro de 10/7-4,5,7-trimetilpirrolo[1,2-a]quinoxal-5-inio (Compuesto 8b)
o) Yoduro de 10/7-4,5,7,8-tetrametilpirrolo[1,2-a]quinoxal-5-inio (Compuesto 8c)
p) Yoduro de 10/7-4,5-dimetil-7-metoxipirrolo[1,2-a]quinoxal-5-inio (Compuesto 8d)
q) Yoduro de 10/7-4,5-dimetil-7-trifluorometilpirrolo[1,2-a]quinoxal-5-inio (Compuesto 8e)
r) Yoduro de 8-cloro-10/7-4,5-dimetilpirrolo[1,2-a]quinoxal-5-inio (Compuesto 8f)
s) 4/7,5/7,10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 9a)
t) 4/7,5/7,10/7-4,7-dimetilpirrolo[1,2-a]quinoxalina (Compuesto 9b)
u) 4/7,5/7,10/7-4,7,8-trimetilpirrolo[1,2-a]quinoxalina (Compuesto 9c)
v) 7-trifluorometil-4/7,5/7,10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 9e)
w) 8-cloro-4/7,5/7,10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 9f)
x) 7,8-dicloro-4/7,5/7,10/7-4-metilpirrolo[1,2-a]quinoxalina (Compuesto 9g)
11. Un proceso de síntesis para preparar un compuesto inhibidor de PTP1B según las reivindicaciones 4, 5 y 6 que comprende:
a) transformar las o/fo-nitroanilinas diferentemente sustituidas 1, o cualquier sal de anilinio a partir de las cuales se puedan preparar los compuestos 1,
**(Ver fórmula)**R6
donde R5, R6, R7 y R8 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; flúor, cloro, bromo o yodo; nitro; tiol; tioéter (RS-) donde el sustituyente R puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; éter (RO-) donde el sustituyente R puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; amino primario, secundario (RNH-) o terciario (RRN-) donde los sustituyentes R y R en el nitrógeno pueden ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; acilamino primario (RCONH-), secundario (RCONR-) o terciario (RCONRR-) donde el radical R del grupo acilo puede ser igual a cualquiera del grupo indicado para R4 y los sustituyentes R y R en el nitrógeno pueden ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; hidroxi; aciloxi (RCOO-) donde el radical R del grupo acilo puede ser igual a cualquiera del grupo indicado para R4; (RCO-) acilo donde el radical R grupo acilo puede ser igual a cualquiera del grupo indicado para R4; carboxamido primario, secundario (RNHCO-) o terciario (RRNCO-) donde los sustituyentes R y R en el nitrógeno pueden ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; alcoxicarbonilo (ROCO-) donde el sustituyente R en el oxígeno puede ser igual a cualquiera del grupo indicado para R4 excepto hidrógeno; o carboxi, en los 1-(o-nitrofenil)pirroles 2,
R2x ,R3
**(Ver fórmula)**donde Ri, R2 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; y donde R5, Re, R7 y Re se han definido anteriormente,
por reacción con un 2,5-dimetoxitetrahidrofurano de fórmula 3,
**(Ver fórmula)**donde R1, R2 y R3 se han definido anteriormente,
b) transformar los compuestos 2 en las o-(pirrol-1-il)anilinas 4,
**(Ver fórmula)**Re
donde R1, R2, R3, Rs, Re, R7 y Re se han definido anteriormente,
mediante hidrogenación catalítica utilizando catalizadores de níquel, paladio, platino o rutenio;
o mediante hidracina en presencia de catalizadores de níquel, paladio o hierro, o en presencia de grafito;
o mediante formiatos de amonio en presencia de catalizadores de paladio o rutenio; o mediante borohidruros de litio, sodio o potasio en presencia de catalizadores de paladio- carbón, SnCI2, TiCU, FeCI2, CoCI2, N¡CI2 o CuCI; o mediante litio, sodio, zinc, estaño o hierro; o mediante TiCb, CrCI2 o SnCI2.
c) transformar las anilinas 4 en las anilidas 5,
**(Ver fórmula)**R
`4
R,
`6
d)
e)
donde R4 puede ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
y donde R1, R2, R3, Rs, Re, R7 y Re se han definido anteriormente,
mediante reacción con un anhídrido de ácido en un ácido carboxílico de igual cadena
hidrocarbonada;
o mediante reacción con un cloruro de ácido en presencia de una base; o mediante reacción con un áster metílico o etílico:
o mediante reacción con un ácido carboxílico en presencia de un agente activante como carbodiimidas o carbonildiimidazol en presencia de una base.
transformar las anilidas 5 en las pirroloquinoxalinas 6,
donde R1, R2, R3, R4, Rs, Re, R7 y Rs se han definido anteriormente,
por tratamiento con un agente deshidratante a elegir entre P2O5, POCI3, POBr3, PCI3, PBr3,
PCIs o SOCI2.
transformar las pirroloquinoxalinas 6a,
**(Ver fórmula)** **(Ver fórmula)**donde al menos Ri es igual a hidrógeno;
y donde R2, R3, R4, R5, R6, R7 y R8 se han definido anteriormente, en las pirroloquinoxalinas 7a,
**(Ver fórmula)**Re
donde X puede ser cloro, bromo o yodo;
y donde R1, R2, R4, R5, R6, R7 y R8 se han definido anteriormente, mediante reacción con una N-halosuccinimida.
f) transformar las pirroloquinoxalinas 6b,
**(Ver fórmula)**donde al menos R2 es igual a hidrógeno; y R1, R3, R4, R5, R6, R7 y R8 se han definido anteriormente, en las pirroloquinoxalinas 7b,
**(Ver fórmula)**donde X puede ser cloro, bromo o yodo;
y donde Ri, R2, R4, R5, R6, R7 y R8 se han definido anteriormente, mediante reacción con una N-halosuccinimida.
g) transformar las pirroloquinoxalinas 6c,
**(Ver fórmula)**donde al menos R3 es igual a hidrógeno;
y donde R1, R2, R4, R5, R6, R7 y R8 se han definido anteriormente, en las pirroloquinoxalinas 7c,
**(Ver fórmula)**X
donde X puede ser cloro, bromo o yodo;
y donde R1, R2, R4, R5, R6, R7 y R8 se han definido anteriormente, mediante reacción con una N-halosuccinimida.
h) transformar las pirroloquinoxalinas 6,
**(Ver fórmula)**donde R1, R2 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
y donde R4, R5, R6, R7 y R8 se han definido anteriormente, en las sales de pirroloquinoxalinio 8,
**(Ver fórmula)**X -
donde Ri, R2, R4, R5, R6, R7 y R8 se han definido anteriormente;
y donde R9 puede ser cualquiera del grupo formado por alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
por reacción con un derivado halogenado o un sulfonato de alquilo o arilo, y donde dicha conversión se puede efectuar tanto mediante calentamiento por convección o microondas.
i) transformar las pirroloquinoxalinas 7a,
p
**(Ver fórmula)**Re
donde R2 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
donde R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo, yodo, en las sales de pirroloquinoxalinio 8,
**(Ver fórmula)**R,
X -
donde Ri puede ser cualquiera del grupo formado por cloro, bromo o yodo; y donde R2, R3 R4, R5, R6, R7, R8 y R9 se han definido anteriormente, por reacción con un derivado halogenado o un sulfonato de alquilo o arilo, y donde dicha conversión se puede efectuar tanto mediante calentamiento por convección 5 o microondas.
j) transformar las pirroloquinoxalinas 7b,
**(Ver fórmula)**donde R1 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
donde R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo, yodo, en las sales de pirroloquinoxalinio 8,
**(Ver fórmula)**X -
donde R1, R3 R4, R5, R6, R7, R8 y R9 se han definido anteriormente; y donde R2 puede ser cualquiera del grupo formado por cloro, bromo o yodo; por reacción con un derivado halogenado o un sulfonato de alquilo o arilo, y donde dicha conversión se puede efectuar tanto mediante calentamiento por convección o microondas.
k) transformar las pirroloquinoxalinas 7c,
**(Ver fórmula)**7c
donde Ri, R2 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
donde R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo, yodo, en las sales de pirroloquinoxalinio 8,
**(Ver fórmula)**X -
donde R1, R2, R4, R5, R6, R7, R8 y R9 se han definido anteriormente;
donde R3 puede ser cualquiera del grupo formado por cloro, bromo o yodo;
por reacción con un derivado halogenado o un sulfonato de alquilo o arilo,
y donde dicha conversión se puede efectuar tanto mediante calentamiento por convección
o microondas.
l) transformar las pirroloquinoxalinas 6,
**(Ver fórmula)**donde R1, R2 y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
y donde R4, R5, R6, R7 y R8 se han definido anteriormente, en las dihidropirroloquinoxalinas 9,
**(Ver fórmula)**donde Ri, R2, R3, R4, R5, R6, R7 y R8 se han definido anteriormente; y donde R9 es hidrógeno,
mediante reducción con un hidruro metálico complejo.
m) transformar las pirroloquinoxalinas 7a,
D
**(Ver fórmula)**Re
donde R2, R3, R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo o yodo, en las dihidropirroloquinoxalinas 9,
**(Ver fórmula)**donde R1 es cualquiera a elegir del grupo formado por cloro, bromo o yodo; donde R2, R3, R4, R5, R6, R7 y R8 se han definido anteriormente; y donde R9 es igual a hidrógeno; mediante reducción con un hidruro metálico complejo.
n) transformar las pirroloquinoxalinas 7b,
**(Ver fórmula)**donde Ri y R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
donde R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo o yodo, en las dihidropirroloquinoxalinas 9,
**(Ver fórmula)**donde R2 es cualquiera a elegir del grupo formado por cloro, bromo o yodo; donde R1, R3, R4, R5, R6, R7 y R8 se han definido anteriormente; y donde R9 es igual a hidrógeno, mediante reducción con un hidruro metálico complejo.
o) transformar las pirroloquinoxalinas 7c,
D
**(Ver fórmula)**X
7c
donde R1 y R2 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático;
donde R4, R5, R6, R7 y R8 se han definido anteriormente; y donde X es cualquiera a elegir del grupo formado por cloro, bromo o yodo,
en las dihidropirroloquinoxalinas 9,
**(Ver fórmula)**donde R3 es cualquiera a elegir del grupo formado por cloro, bromo o yodo; donde R1, R2, R4, R5, R6, R7 y R8 se han definido anteriormente; y donde R9 es igual a hidrógeno, mediante reducción con un hidruro metálico complejo.
p) transformar las pirroloquinoxalinas 8,
**(Ver fórmula)**X -
donde R1, R2, R3 pueden ser cualquiera del grupo formado por hidrógeno, alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático; cloro, bromo o yodo; donde R4, R5, R6, R7 y R8 se han definido anteriormente;
y donde R9 puede ser cualquiera del grupo formado por alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, cicloalquinilo, carbociclo o heterociclo, aromático o heteroaromático,
en las dihidropirroloquinoxalinas 9,
**(Ver fórmula)**donde R1, R2, R3, R4, R5, R6, R7, R8 y R9 R8 se han definido anteriormente,
mediante reducción con un hidruro metálico complejo. 12. Uso de un intermedio con fórmula 2
R2
// w
**(Ver fórmula)**| R1 N | |
| R8'''v"'''"W|"' | NO, |
| R7/T^ | X |
| R6 | |
para preparar un compuesto según la reivindicación 4. 13. Uso de un intermedio con fórmula 4
R2
// w
**(Ver fórmula)**| Rr | XN | |
| Ra\ | íi^ | _.NH |
| R' | XX | X |
| R6 | ||
para preparar un compuesto según la reivindicación 4.
14. Uso de un intermedio con fórmula 5
R
R, r,
Jd
1 N
**(Ver fórmula)**H
N^ /R
R
O
7 | ' '5
R
para preparar un compuesto según la reivindicación 4. 15 15. Uso de un intermedio con fórmula 2
**(Ver fórmula)**para preparar un compuesto según la reivindicación 5.
16. Uso de un intermedio con fórmula 4
R2 v ,R3
**(Ver fórmula)**para preparar un compuesto según la reivindicación 5.
17. Uso de un intermedio con fórmula 5
**(Ver fórmula)**para preparar un compuesto según la reivindicación 5.
18. Uso de un intermedio con fórmula 2
**(Ver fórmula)**para preparar un compuesto según la reivindicación 6.
19. Uso de un intermedio con fórmula 4
R2 v ,R3
7/ \\
**(Ver fórmula)**nh2
R5
R6
para preparar un compuesto según la reivindicación 6.
20. Uso de un intermedio con fórmula 5
**(Ver fórmula)**para preparar un compuesto según la reivindicación 6.
21. Uso según las reivindicaciones 4, 5, 6, 7, 8, 9 y 10, para la elaboración de un medicamento para el tratamiento o prevención de enfermedades en las que la PTP1B está implicada en su patogénesis.
22. Uso según la reivindicación anterior, donde las enfermedades en las que la PTP1B está implicada se pueden seleccionar de la lista que comprende: resistencia a la insulina, intolerancia a la glucosa, obesidad, diabetes mellitus, hipertensión y enfermedades isquémicas de vasos sanguíneos grandes y pequeños, condiciones que acompañan la 5 diabetes tipo 2 incluyendo dislipidemia, por ejemplo, hiperlipidemia y hipertrigliceridemia, aterosclerosis, restenosis vascular, síndrome de colon irritable, pancreatitis, cáncer de células adiposas y carcinomas, osteoporosis, enfermedades neurodegenerativas e infecciosas, y enfermedades implicadas con la inflamación y el sistema inmunitarios, insuficiencia renal (diabética y no diabética), nefropatía diabética, glomerulonefritis, 10 esclerosis glomerular, proteinuria de enfermedad renal primaria, retinopatía diabética, todos los tipos de fallo cardiaco incluyendo fallo cardiaco congestivo agudo y crónico, disfunción del ventrículo izquierdo y cardiomiopatía hipertrófica, miopatía cardiaca diabética, arritmias ventriculares y supraventriculares, fibrilación atrial y palpitación atrial, angina de pecho (tanto inestable como estable), infarto de miocardio y sus secuelas, lesión 15 por isquemia/reperfusión, restauración vascular dañina incluyendo restenosis vascular, tratamiento de otros trastornos vasculares como migrañas, enfermedad vascular periférica y enfermedad de Raynaud, esclerosis múltiple, infarto cerebral, lesión de médula espinal, enfermedades neurodegenerativas tales como la enfermedad de Alzheimer, enfermedad de Parkinson y enfermedades de poliglutamina tales como Huntington y ataxia 20 espinocerebelar, enfermedades infecciosas incluyendo leishmaniasis, enfermedades implicadas en la inflamación y el sistema inmune y enfermedades implicadas en la degeneración muscular.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Formas sólidas de un compuesto modulador de quinasas, del 22 de Julio de 2020, de PLEXXIKON, INC: Una forma cristalina del Compuesto I: **(Ver fórmula)** que es la Forma C del Compuesto I caracterizado por un difractograma de rayos […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Procedimiento de preparación de la forma A de grapiprant, del 22 de Julio de 2020, de Aratana Therapeutics Inc: Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]