Anticuerpos humanizados modificados anti-interleucina-18.
Un anticuerpo anti-interleucina-18 humanizado que comprende una región variable de cadena pesada como se expone en SEC ID Nº:
11 y una región variable de cadena ligera como se expone en SEC ID Nº: 15.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/055029.
Solicitante: GLAXO GROUP LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 980 GREAT WEST ROAD BRENTFORD, MIDDLESEX TW8 9GS REINO UNIDO.
Inventor/es: ELLIS,JONATHAN HENRY, GERMASCHEWSKI,VOLKER, HAMBLIN,PAUL ANDREW, KIRBY,IAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P37/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunosupresores, p. ej. medicamentos para el tratamiento del rechazo en injertos.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
PDF original: ES-2514495_T3.pdf




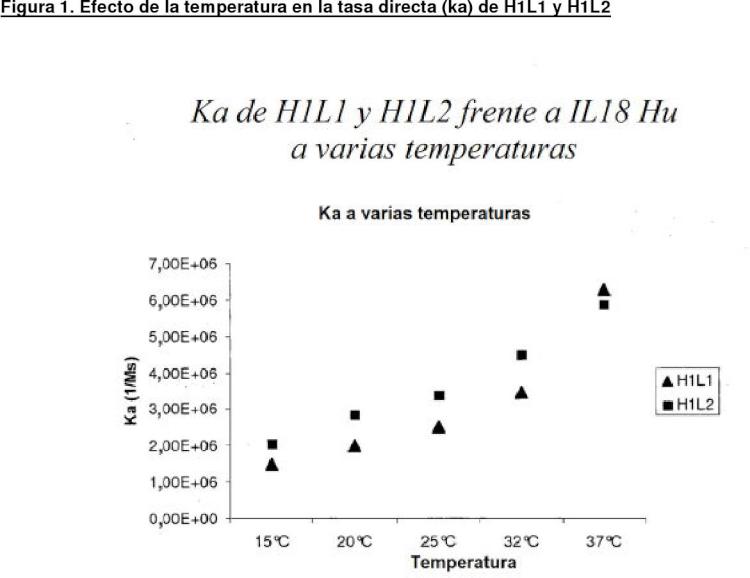
Fragmento de la descripción:
Anticuerpos humanizados modificados anti-interleucina-18
1. Campo de la invención
La presente invención se refiere generalmente al campo de las inmunoglobulinas tales como anticuerpos y en concreto a anticuerpos humanizados, útiles en el tratamiento y diagnóstico de afecciones mediadas por interleucina-18 humana.
2. Antecedentes de la invención
La interleucina-18 humana (hlL-18) es una citocina que se sintetiza como una proteína precursora de 193 aminoácidos biológicamente inactiva (Ushio y col., J. Immunol. 156:4274,1996). La escisión de la proteína precursora, por ejemplo mediante caspasa-1 o caspasa-4, libera la proteína madura de 156 aminoácidos (Gu y col., Science 275:26, 1997; Ghayur y col., Nature 386:619, 1997), que muestra actividades biológicas que incluyen la co-estimulación de la proliferación de linfocitos T, la potenciación de la citotoxicidad de linfocitos citolíticos naturales, la inducción de la producción de IFN-ypor linfocitos T y linfocitos citolíticos naturales, y la potenciación de la diferenciación de linfocitos T colaboradores tipo 1 (Th1) (Okamura y col., Nature 378:88, 1995; Ushio y col., J. Immunol. 156:4274,1996; Micallef y col.; Eur. J. Immunol. 26:1647,1996; Kohno ycol., J. Immunol. 158:1541,1997; Zhang y col., Infect. Immunol 65:3594, 1997; Robinson y col., Immunity 7:571, 1997). Además, IL-18 es una inductora eficaz de los mediadores proinflamatorios monocíticos humanos, incluyendo IL-8, factor de necrosis tumoral-a (TNF-a), y prostaglandina E 2 (PGE 2) (Ushio, S. y col., J. Immunol. 156:4274-4279, 1996; Puren, A. J. y col., J. Clin. Invest. 1:711-721, 1997; Podolin ycol., J. Immunol. remitido, 1999).
La proteína relacionada con el receptor de IL-1 (IL-1 Rrp) clonada anteriormente (Parnet y col., J. Blol. Chem. 271:3967, 1996) se identificó como una subunidad del receptor de IL-18 (Kd=18 nM) (Torigoe y col., J. Biol. Chem. 272:25737, 1997). Una segunda subunidad del receptor de IL-18 muestra homología con la proteína accesoria del receptor de IL-1, y se ha denominado AcPL (del inglés accesory protein-like, proteína accesoria relacionada). La expresión de tanto IL1 Rrp como de AcPL es necesaria para la activación de NF-kB y JNK inducida por IL-18 (Born y col., J. Biol. Chem. 273:29445,1998). Además de NF-kB y JNK, IL-18 señaliza mediante lacinasa asociada al receptor de IL-1 (IRAK), p56lck (LCK), y la proteína cinasa activada por mitógeno (MAPK) (Micallef y col., Eur. J. Immunol. 26:1647, 1996; Matsumoto y col., Biophys Biochem. Res. Comm. 234:454, 1997; Tsuji- Takayama ycol., Biochem. Biophys. Res. Comm. 237:126, 1997).
Los linfocitos TH1 que producen citocinas proinflamatorias como IFN-y, IL-2 y TNF-(5 (Mosmann y col., J. Immunol. 136:2348, 1986). se han implicado en la mediación de muchas enfermedades autoinmunes, incluyendo esclerosis múltiple (EM), artritis reumatoide (AR), diabetes tipo 1 o insulinodependiente (DMID), enfermedad inflamatoria del intestino (Eli), y psoriasis (Mosmann y Sad, Immunol. Today 17:138, 1996). Por tanto, puede esperarse que el antagonismo de una citocina que promueva a TH1 tal como IL-18 inhiba el desarrollo de la enfermedad. Pueden usarse AcM específicos para IL-18 como antagonistas.
Se ha demostrado el papel de IL-18 en el desarrollo de enfermedades autoinmunes. Por consiguiente, se ha demostrado que la expresión de IL-18 está aumentada significativamente en el páncreas y bazo de ratones diabéticos no obesos (NOD) inmediatamente antes de la aparición de la enfermedad (Rothe y col., J. Clin. Invest. 99:469, 1997). De manera similar, se ha demostrado que los niveles de IL-18 están elevados de manera destaca en el fluido sinovial de pacientes con artritis reumatoide (Kawashima y col., Arthritis and Rheumatism 39:598, 1996). Además, se ha demostrado que la administración de IL-18 aumenta la gravedad clínica de encefalomielitis alérgica experimental murina (EAE), una enfermedad autoinmune mediada por Th 1 que es un modelo para esclerosis múltiple. Además, se ha demostrado que neutralizar antisuero anti-IL-18 de rata previene el desarrollo de EAE en ratas Lewis hembra (Wildbaum y col., J. Immunol. 161:6368,1998). Por consiguiente, IL-18 es una diana deseable para el desarrollo de un agente terapéutico nuevo para autoinmunidad.
Taniguchi y col., J. Immunol. Methods 26:17, describen siete anticuerpos monoclonales (AcM) murinos anti-IL-18 humana y seis de rata, que se unen a cuatro sitios antigénicos distintos. Uno de los AcM murinos (N2 125-2H), y los siete AcM de rata inhiben la producción de IFN-ypor células KG-1 inducida por IL-18, mostrando los AcM de rata actividades neutralizantes 1 veces más bajas que aquellas de N2 125-2H. Como se demuestra mediante análisis de transferencia de Western, tres de los AcM murinos, pero ninguno de los AcM de rata, son fuertemente reactivos con IL-18 humana unida a membrana. Además, se describe un ensayo inmunoabsorbente unido a enzimas (ELISA) para detectar IL-18 humana, utilizando N2125-2H y un AcM de rata. El límite de detección de este ELISA es de 1 pg/ml.
La solicitud de patente europea EP 712 931 desvela dos AcM de ratón anti-IL-18 humana, H1 (IgG 1) y H2 (IgM). Como se demuestra mediante análisis de transferencia de Western, ambos AcM reaccionan con IL-18 humana unida a membrana, pero no con IL-12 humana unida a membrana. H1 se utiliza en un protocolo de cromatografía de inmunoafinidad para purificar IL-18 humana, y en un ELISA para medir IL-18 humana. H2 se utiliza en un radioinmunoensayo para medir IL-18 humana.
El documento WO 56771 desvela un AcM de rata 2C1 que tiene las CDR como se expone en las SEC ID N2:1-6. El
documento WO 56771 también desvela 2C1 humanizado que comprende estas CDR.
Neutralizar anticuerpos de IL-18 puede ser potencialmente útil para aliviar enfermedades autoinmunes y síntomas relacionados en el ser humano. Por lo tanto, hay una necesidad en la técnica para un antagonista de IL-18 de alta afinidad, tal como un anticuerpo monoclonal neutralizante para interleucina 18 humana, que reduciría la diferenciación y proliferación de linfocitos Th1 y por consiguiente las enfermedades autoinmunes y síntomas relacionados.
3. Sumario de la invención
De acuerdo con la presente invención se proporciona un anticuerpo humanizado anti-interleucina-18 como se define en las reivindicaciones.
Dicho anticuerpo comprende una cadena pesada y una cadena ligera que tienen las siguientes regiones determinantes de complementariedad (CDR):
CDRH1: SEC ID N2: 1 CDRH2: SEC ID N2: 2 CDRH3: SEC ID N2: 3 CDRL1: SEC ID Ne: 4 CDRL2: SEC ID N2: 5 CDRL3: SEC ID N2: 6
El resto en la posición 71 de la cadena ligera está sustituido por el resto correspondiente encontrado en el anticuerpo donante del que se derivan las CDR, es decir, un resto de tirosina.
Será evidente para los expertos en la técnica que el término "derivado" pretende definir no solo la fuente en el sentido de ser el origen físico del material, sino también para definir el material que es estructuralmente idéntico al material, pero que no se origina a partir de la fuente de referencia. Por lo tanto, el resto correspondiente "encontrado en el marco conservado del anticuerpo del que se derivan las CDR" no necesitan necesariamente purificarse a partir del marcon conservado del anticuerpo donante. De manera similar, las CDR "derivadas de un anticuerpo donante" no necesitan necesariamente purificarse a partir del anticuerpo donante.
Las CDR y las regiones de marco conservado (FR) y numeración de aminoácidos siguen, a menos que se indique lo contrario, la definición de Kabat como se expone en Kabat y col, "Sequences of immunological interest", NIH.
La cadena ligera y/o la cadena pesada son preferentemente no inmunogénicas en un paciente humano.
La divulgación proporciona un anticuerpo humanizado en el cual las CDR anteriormente mencionadas se injertan en un marco conservado aceptor de cadena ligera humana en el que dicho marco conservado aceptor de cadena ligera comprende las regiones de marco conservado derivadas de la secuencia expuesta en SEC ID N2: 38.
La divulgación también proporciona un anticuerpo humanizado anti-interleucina-18, el cual muestra una constante de equilibrio (KD) de 3 pM o menos respecto a la unión de IL-18 humana cuando se mide mediante resonancia de plasmón superficial (por ejemplo, Biacore, usando preferentemente un instrumento Biacore 3 y condiciones como las expuestas en 8.4.1 más adelante) a 37 °C.
Preferentemente, la constante de equilibrio (KD) del anticuerpo respecto a la unión de IL-18 humana cuando se mide mediante resonancia de plasmón superficial (preferentemente usando un instrumento Biacore T1 y condiciones como las expuestas en 8.4.2 más adelante) a 37 °C es menor de 9... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo anti-interleucina-18 humanizado que comprende una región variable de cadena pesada como se expone en SEC ID N2: 11 y una región variable de cadena ligera como se expone en SEC ID N2: 15.
2. Un anticuerpo anti-interleucina-18 humanizado como se reivindica en la reivindicación 1, que comprende una cadena pesada como se expone en SEC ID N2: 9 y una cadena pesada como se expone en SEC ID N2: 13.
3. Una composición farmacéutica que comprende un anticuerpo anti-interleucina-18 de acuerdo con la reivindicación 1
reivindicación 2 y un vehículo farmacéuticamente aceptable.
4. Un anticuerpo como se reivindica en la reivindicación 1 o reivindicación 2 para su uso como un medicamento.
5. Un anticuerpo como se reivindica en la reivindicación 4 en el que el medicamento es para su uso en el tratamiento de una enfermedad autoinmune.
6. Un anticuerpo como se reivindica en la reivindicación 5, en el que la enfermedad autoinmune está seleccionada del grupo que consiste en: esclerosis múltiple, enfermedades artríticas tales como artritis reumatoide, diabetes tipo 1, enfermedad inflamatoria del intestino (Eli) y psoriasis.
7. El uso de un anticuerpo como se reivindica en la reivindicación 1 o reivindicación 2 en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune.
8. Un polinucleótido que codifica una región variable de cadena pesada de anticuerpo y una región variable de cadena ligera de anticuerpo como se define en la reivindicación 1.
9. Un polinucleótido que codifica una cadena pesada de anticuerpo y una cadena ligera de anticuerpo como se define en la reivindicación 2.
1. Un vector que codifica la cadena pesada y la cadena ligera de un anticuerpo como se reivindica en la reivindicación
1 o reivindicación 2.
11. Una célula hospedadora transformada de manera estable que comprende un vector como se reivindica en la reivindicación 1.
12. Una célula hospedadora transformada de manera estable que comprende un primer vector que codifica la cadena ligera y un segundo vector que codifica la cadena pesada de un anticuerpo como se reivindica en la reivindicación 1 o reivindicación 2.
13. Un procedimiento de producción de un anticuerpo de acuerdo con la reivindicación 1 o reivindicación 2, cuyo procedimiento comprende cultivar una célula hospedadora transformada o transfectada con un vector o vectores que codifican dicho anticuerpo en condiciones permisivas para la expresión de dicho anticuerpo.
14. Un procedimiento como se reivindica en la reivindicación 13 en el que el polinucleótido que codifica la cadena ligera y el polinucleótido que codifica la cadena pesada del anticuerpo son insertados en el mismo vector e introducidos en la célula hospedadora.
15. Un procedimiento como se reivindica en la reivindicación 13 en el que el polinucleótido que codifica la cadena ligera y el polinucleótido que codifica la cadena pesada del anticuerpo son insertados en vectores separados e introducidos en la misma célula hospedadora de manera concurrente o secuencial.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Procedimientos de tratamiento del cáncer usando antagonistas de unión al eje de PD-1 e inhibidores de TIGIT, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo antagonista anti-PD-L1 o fragmento de unión a antígeno del mismo y un anticuerpo antagonista anti-TIGIT o fragmento de unión a antígeno del mismo para su uso […]