Solubilización de polisacáridos capsulares.
Un procedimiento para la purificación de polisacáridos capsulares bacterianos,
que comprende las etapas de (a) precipitación del polisacárido utilizando uno o más detergentes catiónicos, seguido por (b) solubilización del polisacárido precipitado utilizando un alcohol.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2002/003191.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: COSTANTINO, PAOLO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/02 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos bacterianos.
- A61K39/09 A61K 39/00 […] › Streptococcus.
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K39/102 A61K 39/00 […] › Pasteurella; Haemophilus.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C08B37/00 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › Preparación de polisacáridos no previstos en los grupos C08B 1/00 - C08B 35/00; Sus derivados (celulosa D21).
Fragmento de la descripción:
Solubilización de polisacáridos capsulares.
Campo técnico
Esta invención está dentro del campo de las vacunas, en particular frente a la infección y enfermedad por meningococos.
Antecedentes del tema
Neisseria meningitidis es un patógeno humano Gram negativo. Coloniza la faringe, provocando meningitis y, ocasionalmente, septicemia en ausencia de meningitis. Está estrechamente relacionado con N. gonorrhoeae, aunque una característica que diferencia meningococos claramente es la presencia de una cápsula de polisacáridos que está presente en todos los meningococos patógenos.
Se han identificado doce grupos serológicos de N. meningitidis (A, B, C, H, I, K, L, 29E, W135, X y Z) de acuerdo con el polisacárido capsular del organismo. El grupo A es el patógeno implicado más frecuentemente en enfermedades epidémicas en el África sub-Sahariana. Los grupos serológicos B y C son responsables de la gran mayoría de casos en EE. UU. Y en la mayoría de países desarrollados. Los grupos serológicos W135 e Y son responsables de los casos restantes en EE.UU. y países desarrollados.
Los polisacáridos capsulares de N. meningitidis se preparan generalmente mediante un procedimiento que comprende las etapas de precipitación del polisacárido (p.ej. utilizando un detergente catiónico), fraccionamiento en etanol, extracción fría de fenol (para eliminar proteínas) y ultracentrifugación (para eliminar LPS) [p.ej. referencia 1].
Una vacuna tetravalente de los polisacáridos de los grupos serológicos A, C, Y, y W135 se conoce hace años [2, 3] y se ha autorizado para uso humano. Aunque efectiva en adolescentes y adultos, induce una respuesta inmune pobre y corta duración de la protección y no se puede utilizar en niños [p.ej. 4]. Ésto es por que los polisacáridos son antígenos independientes de la célula T que inducen una respuesta inmune débil que no se puede estimular. Los polisacáridos en esta vacuna no están conjugados y están presentes a una relación 1:1:1:1. MENCEVAX ACWY contiene 50 mg de cada polisacárido purificado una vez reconstituido de su forma liofilizada.
Se han aprobado también los oligosacáridos del grupo serológico C conjugados para su utilización en humanos [p.ej. Menjugate; referencia 6]. Sin embargo, se mantiene la necesidad de realizar mejoras en las vacunas conjugadas contra los grupos serológicos A, W135 e Y, y en su manufactura.
Descripción de la invención
La invención proporciona un procedimiento para la purificación de un polisacárido capsular bacteriano, que comprende las etapas de (a) precipitación de dicho polisacárido utilizando uno o más detergentes catiónicos, seguida de (b) disolución del polisacárido precipitado utilizando un alcohol, tal como etanol. El polisacárido se puede utilizar para preparar vacunas, tales como vacunas conjugadas, en particular contra los grupo serológicos A, W135 e Y de N. meningitidis.
Precipitación y disolución por etanol
Se conocen en el campo muchas técnicas para la precipitación de polisacáridos solubles. Los métodos de la presente invención utilizan uno o más detergentes catiónicos. Los detergentes tienen preferiblemente la siguiente fórmula general:
en la que:
R1, R2 y R3 son el mismo o diferente y cada uno significa alquilo o arilo; o R1 y R2 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico saturado de 5- ó 6- miembros, y R3 significa alquilo o arilo; o R1, R2 y R3 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico de 5- ó 6- miembros insaturado en el átomo de nitrógeno,
R4 significa alquilo o arilo, y
X- significa un anión.
Los detergentes preferidos particularmente para la utilización en el método son sales de tetrabutilamonio y cetiltrimetilamono (p. ej. las sales de bromuro). Se prefiere particularmente el bromuro de cetiltrimetilamonio (CTAB
) [8]. CTAB se conoce también como bromuro de hexadeciltrimetilamonio, bromuro de cetrimonio, Cetavlon y Centimida. Otros detergentes incluyen bromuro de hexadimetrina y sales de miristiltrimetrilamonio.
Los polisacáridos capsulares se liberan al medio durante el cultivo. Por consiguiente, el material de partida para la precipitación será generalmente el sobrenadante de un cultivo bacteriano centrifugado o será un cultivo concentrado.
La etapa de precipitación puede ser selectiva para polisacáridos, pero se coprecipitarán generalmente otros componentes (p. ej. proteínas, ácidos nucleicos, etc.).
El polisacárido precipitado se puede recoger por centrifugación antes de su disolución.
Tras su precipitación, el polisacárido (formando un complejo con el detergente catiónico generalmente) se disuelve. Se prefiere la utilización de un disolvente que sea relativamente selectivo para los polisacáridos con el fin de minimizar los contaminantes (p. ej. proteínas, ácidos nucleicos, etc.). Se ha encontrado que el etanol es ventajoso a este respecto, y es altamente selectivo para el complejo CTAB-polisacárido. Se pueden utilizar otros alcoholes inferiores (p. ej. metanol, propan-1-ol, propan-2-ol, butan-1-ol, butan-2-ol, 2-metil-propan-1-ol, 2-metil-propan-2-ol, dioles, etc.).
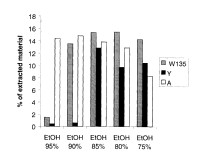
Preferiblemente se añade etanol al polisacárido precipitado para obtener una concentración final de etanol (en base al contenido total de etanol y agua) de entre el 50% y 95% (p. ej. alrededor del 55%, 60%, 70%, 75%, 80%, 85%, o alrededor del 90%), y preferiblemente entre 75% y 95%. La concentración final óptima de etanol puede depender del grupo serológico de la bacteria de la que se obtiene el polisacárido.
El etanol se puede añadir al polisacárido precipitado en forma pura o se puede añadir en una forma diluida con un disolvente miscible (p. ej. agua). Las mezclas de disolventes preferidas son mezclas de etanol: agua, en una relación preferida de entre alrededor de 70:30 y alrededor de 95:5 (p. ej. 75:25, 80:20, 85:15, 90:10).
Comparado con el procedimiento convencional para preparar polisacáridos capsulares, el procedimiento de precipitación en dos etapas seguido por extracción con etanol es más rápido y más simple.
Contrastando con el procedimiento descrito en la referencia 9, el procedimiento utiliza detergentes catiónicos en lugar de detergentes aniónicos. A diferencia del procedimiento de la referencia 10, el polisacárido se redisuelve utilizando etanol, en lugar de por intercambio de cationes utilizando sales de calcio o magnesio. A diferencia del procedimiento de la ref. 11, la precipitación no requiere un soporte inerte poroso. Además, a diferencia de los procedimientos anteriores del campo, se utiliza alcohol para redisolver el polisacárido en lugar de precipitarlo.
El polisacárido capsular bacteriano será generalmente de Neisseria. Preferiblemente de N. meningitidis, que incluye los grupo serológicos A, B, C, W135 e Y. Los grupo serológicos preferidos son A, W135 e Y.
El procedimiento es válido también para preparar polisacáridos capsulares de Haemophilus influenzae (particularmente tipo B, o 'Hib') o Streptococcus pneumoniae (neumococo).
Procesamiento adicional del polisacárido disuelto
El polisacárido se puede tratar adicionalmente para eliminar contaminantes tras su disolución. Esto es particularmente importante en situaciones en las que incluso una contaminación menor no es aceptable (p. ej. para la producción de vacunas humanas). Esto requerirá generalmente uno o más etapas de filtración.
Se puede utilizar filtración de profundidad. Ésta es particularmente útil para la clarificación.
Se puede utilizar filtración a través de carbón activado. Ésta es útil para eliminar pigmentos y trazas de compuestos orgánicos. Se puede repetir hasta, por ejemplo, OD275nm< 0,2.
Se puede utilizar filtración por tamaño o utrafiltración.
Una vez filtrado para eliminar contaminantes, el polisacárido se puede precipitar para su tratamiento...
Reivindicaciones:
1. Un procedimiento para la purificación de polisacáridos capsulares bacterianos, que comprende las etapas de (a) precipitación del polisacárido utilizando uno o más detergentes catiónicos, seguido por (b) solubilización del polisacárido precipitado utilizando un alcohol.
2. El procedimiento de la reivindicación 1, en el que el detergente (s) catiónico tienen la siguiente fórmula general:
en la que:
R1, R2 y R3 son el mismo o diferente y cada uno significa alquilo o arilo; R1 o R2 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico saturado de 5- ó 6- miembros, y R3 significa alquilo o arilo; o R1, R2 y R3 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico de 5- ó 6- miembros, insaturado en el átomo de nitrógeno,
R4 significa alquilo o arilo, y
X- significa un anión.
3. El procedimiento de cualquier reivindicación precedente, en el que el detergente (s) catiónico comprende una sal de cetiltrimetilamonio, una sal de tetrabutilamonio, una sal de miristiltrimetrilamonio y/o bromuro de hexadimetrina.
4. El procedimiento de la reivindicación 3, en el que el detergente catiónico es bromuro de cetiltrimetilamonio.
5. El procedimiento de cualquier reivindicación precedente, en el que el alcohol utilizado en la etapa (b) comprende etanol.
6. El procedimiento de la reivindicación 5, en el que el etanol tiene una concentración de entre 50% y 95%.
7. El procedimiento de cualquier reivindicación precedente, en el que el polisacárido capsular es de N. meningitidis.
8. El procedimiento de la reivindicación 7, en el que N. meningitidis es del grupo serológico A, W135 o Y.
9. El procedimiento de cualquiera de las reivindicaciones 1 a 6, en el que el polisacárido capsular bacteriano es de Haemophilus influenzae o Streptococcus pneumoniae.
10. El procedimiento de cualquier reivindicación precedente, que comprende además la etapa (c) de tratamiento del polisacárido obtenido en la etapa (b) para eliminar contaminantes.
11. El procedimiento de la reivindicación 10, en el que la etapa (c) comprende filtración.
12. El procedimiento de la reivindicación 11, en el que la etapa (c) comprende filtración de profundidad, filtración a través de carbono activado, filtración por tamaño y/o ultrafiltración.
13. El procedimiento de cualquier reivindicación precedente, en el que el polisacárido obtenido en las etapas (b) o (c) es posteriormente precipitado.
14. El procedimiento de cualquier reivindicación precedente, que comprende además la etapa de hidrólisis para formar oligosacáridos.
15. El procedimiento de la reivindicación 14, que comprende además la etapa de selección por tamaño con el fin de eliminar los oligosacáridos de corta longitud.
16. El procedimiento de cualquier reivindicación precedente, que comprende además la etapa de conjugación a una proteína portadora.
17. El procedimiento de la reivindicación 16, en la que la proteína portadora es un toxoide diftérico, un toxoide tetánico, un toxoide diftérico CRM197 o una proteína D de Haemophilus influenzae.
18. El procedimiento de cualquier reivindicación precedente, que comprende además la etapa de mezclado con otras moléculas biológicas.
19. El procedimiento de la reivindicación 18, en el que las moléculas biológicas adicionales se seleccionan entre el grupo constituido por: antígenos sacarídicos del grupo serológico C de N. meningitidis, y antígenos proteicos del grupo serológico B de N. meningitidis.
20. El procedimiento de la reivindicación 18, en el que los antígenos sacarídicos de las cepas A, C, W135 y/o Y de N. meningitidis están mezclados.
21. El procedimiento de cualquier reivindicación precedente, que comprende además la etapa (s) de formulación de vacuna.
22. El procedimiento de la reivindicación 21, en la que la etapa (s) de formulación de vacuna comprende la mezcla de sacárido (s) antigénico (s) con un adyuvante.
23. El procedimiento de la reivindicación 22, en el que el adyuvante comprende fosfato de aluminio y/o hidróxido de aluminio.
24. Un procedimiento de solubilización de polisacáridos capsulares bacterianos precipitados utilizando uno o más detergentes catiónicos, en los que se utiliza etanol como disolvente.
25. El procedimiento de la reivindicación 24, en el que el etanol está en forma de una mezcla de etanol:agua 95:5.
26. El procedimiento de las reivindicaciones 24 ó 25, en el que el polisacárido capsular bacteriano procede de N. meningitidis.
27. El procedimiento de la reivindicación 26, en el que N. meningitidis es del grupo serológico A, W135 o Y.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]