Proteínas que activan un sistema de profenoloxidasa y genes que codifican las mismas.
Una proteína de unión 1 de bacterias gramnegativas derivada de Tenebrio molitor (Tenebrio GNBP1),
que tieneuna secuencia de aminoácidos tal como se expone en la SEC ID Nº 2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2008/000664.
Solicitante: YUHAN CORPORATION.
Nacionalidad solicitante: República de Corea.
Dirección: 49-6 TAEBANG-DONG, TONGJAK-GU SEOUL 156-754 REPUBLICA DE COREA.
Inventor/es: LEE,BOK-LUEL, PARK,JI-WON, HA,NAM-CHUL, KIM,CHAN-HEE, KIM,SU-JIN, ROH,KYUNG-BAEG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/435 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de animales; de humanos.
PDF original: ES-2432790_T3.pdf
Fragmento de la descripción:
Proteínas que activan un sistema de profenoloxidasa y genes que codifican las mismas
Campo de la técnica La presente invención se refiere a nuevas proteínas que activan el sistema de profenoloxidasa (pro-PO) de Tenebrio molitor, a genes que codifican el mismo, a procedimientos de detectar infección bacteriana en una muestra usando las proteínas y a kits para detectar infección bacteriana en una muestra usando las proteínas. La presente invención también se refiere a un procedimiento para preparar un peptidoglicano de tipo Lys linealizado y soluble (PGLS) útil para una sustancia estándar para el kit.
Técnica anterior
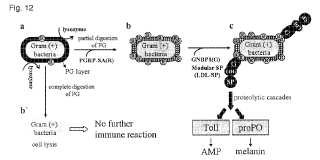
Estudios genéticos recientes han revelado que la proteína de reconocimiento del peptidoglicano (PG) de Drosophila melanogaster Drosophila PGRRSA and Drosophila PGRP-SD activan la vía Toll (Michel, T., Reichhart, J. M., Hoffmann, J. A. & Royet, J. (2001) Nature 414, 756-759; y Bischoff, V, Vignal, C., Boneca, I G., Michel, T., Hoffmann,
J. A. & Royet, J. (2004) Nat Immunol 5, 1175-1180) , mientras que Drosophila PGRP-LC y Drosophila PGRP-LE son receptores para la vía Imd (Gottar, M., Gobert, V, Michel, T., Belvin, M., Duyk, G., Hoffmann, J. A., Ferrandon, D. & 20 Royet, J. (2002) Nature 416, 640-644; Choe, K. M., Werner, T., Stoven, S., Hultmark, D. & Anderson, K. V (2002) Science 296, 359-362; and Takehana, A., Katsuyama, T., Yano, T., Oshima, Y., Takada, H., Aigaki, T. & Kurata, S. (2002) Proc Natl Acad Sci USA 99, 13705-13710) . El fenotipo inmune de una pérdida de función mutante de la proteína de unión 1 de bacterias gramnegativas de Drosophila (Drosophila GNBP1) era indistinguible de la de Drosophila PGRP-SA, lo que demuestra que estas dos proteínas son necesarias para activar la vía Toll en respuesta 25 a la infección por bacterias grampositivas (Gobert, V, Gottar, M., Matskevich, A. A., Rutschmann, S., Royet, J., Belvin, M., Hoffmann, J. A. & Ferrandon, D. (2003) Science 302, 2126-2130; Pili-Flour y , S., Leulier, F., Takahashi, K., Saigo, K., Samain, E., Ueda, R & Lemaitre, B (2004) J Biol Chem 279, 12848-12853; and Wang, L., Weber, A. N., Atilano, M. L., Filipe, S. R, Gay, N. J. & Ligoxygakis, P. (2006) EMBO J 25, 5005-5014) . No obstante, los mecanismos moleculares de la parte cadena arriba de la vía Toll en el reconocimiento de las bacterias gramnegativas todavía están pendientes de aclarar.
La cascada de activación de la profenoloxidasa (pro-PO) , que conduce a la melanización de los microbios invasores, es otro mecanismo de defensa de inmunidad innata principal en invertebrados que desencadena el peptidoglicano (PG) y el º-1, 3-glucano (Cerenius, L. & Soderhall, K. (2004) Immunol Rev 198, 116-126; y Kanost, M. R, Jiang, H. & 35 Yu, X. Q. (2004) Immunol Rev 198, 97-105) . La cascada de pro-PO, como el sistema del complemento de vertebrados, es una cascada proteolítica en plasma sanguíneo. Por tanto, el sistema pro-PO es una herramienta ideal para los estudios bioquímicos de reconocimiento de PG y º-1, 3-glucano y la posterior señalización en condiciones acelulares. Anteriormente, los inventores han identificado el PGRP de Tenebrio molitor que exhibía la homología de secuencia más alta con PGRP-SA de Drosophila. Este PGRP, que los inventores designan PGRP-SA 40 de Tenebrio, activó el sistema de pro-PO dependiente de Lys-PG en el escarabajo Tenebrio. Cabe destacar que un nuevo fragmento de Lys-PG sintético funciona como inhibidor competitivo del PG-lys lineal polimérico soluble en la activación del sistema pro-PO. El fragmento de Lys-PG sintético (en lo sucesivo en el presente documento “dímero muropéptido sintético”) , que tiene una estructura química de la siguiente fórmula (I) , está compuesto por un tetrasacárido (GlcNAc-MurNAc-GlcNAc-MurNAc) , unido covalentemente a dos copias de un eje tetrapeptídico [L-Ala
D-isoGln-L-Lys-D-Ala) (Park, J. W., Je, B R, Piao, S., Inamura, S., Fujimoto, Y., Fukase, K., Kusumoto, S., Soderhall, K., Ha, N. C. & Lee, B L. (2006) J Biol Chem 281, 7747-7755) .
Fórmula química 1
En recientes estudios estructurales cristalográficos de proteínas PGRP sin fragmento PG o formando un complejo con fragmentos de PG se proporcionó información importante sobre la base estructural del reconocimiento del PG (Lim, J. H., Kim, M. S., Kim, H. E., Yano, T., Oshima, Y., Aggarwal, K., Goldman, W. E., Silverman, N., Kurata, S. & Oh, B H. (2006) J Biol Chem 281, 8286-8295; Chang, C. I, Chelliah, Y., Borek, D., Mengin-Lecreulx, D. & Deisenhofer, J. (2006) Science 311, 1761-1764; Chang, C.I., Ihara, K., Chelliah, Y., Mengin-Lecreulx, D., Wakatsuki,
S. & Deisenhofer, J. (2005) Proc Natl Acad Sci U S A 102, 10279-10284; Guan, R, Roychowdhur y , A., Ember, B, Kumar, S., Boons, G. J. & Mariuzza, R A. (2004) Proc Natl Acad Sci U S A 101, 17168-17173; Kim, M. S., Byun, M. &
Oh, B H. (2003) Nat hmnunol 4, 787-793; .and Chang, C. I, Pali-Flour y , S, Herve, M., Parquet, C., Chelliah, Y., Lemaitre, B, Mengin-Lecreulx, D. & Deisenhofer, J. (2004) PLoS Biol 2, E277) . El muropéptido, compuesto por Nacetilglucosamina y ácido N-acetilmuraámico azúcares unidos por una cadena peptídica corta como eje, se reveló como la unidad mínima de unión para PGRP-SA.
No obstante, sigue sin estar claro cómo la señal de reconocimiento de Lys-PG por los OGRP ceba la cascada de la serínproteasa (SP) que conduce a la activación del sistema pro-PO o las vías Toll.
Divulgación de la invención
Problema de la técnica Los presentes inventores realizaron varios estudios sobre cómo la señal de reconocimiento de Lys-PG se transfiere corriente abajo a través de un enfoque bioquímico usando la vía Toll de Drosophila in vivo, un sistema de motivación de pro-PO in vitro y proteínas PGRP-SA recombinantes. Como resultado, los inventores aislaron proteínas implicadas en un sistema pro-PO y también descubrieron que dichas proteínas son útiles para detectar infección bacteriana en una muestra, tal como sangre. Asimismo, los presentes inventores desarrollaron un procedimiento para preparar un peptidoglicano de tipo Lys linealizado y soluble (PGLS) que es útil para una sustancia estándar en la detección de infección bacteriana en una muestra.
Por tanto, la presente invención proporciona proteínas que activan el sistema profenoloxidasa (pro-PO) y genes que codifican la misma.
La presente invención también proporciona un procedimiento de detección de infección bacteriana en una muestra usando las proteínas.
La presente invención también proporciona un kit para detectar infección bacteriana en una muestra usando las proteínas.
En la presente invención también se divulga un procedimiento de preparar un peptidoglicano de tipo Lys linealizado 35 soluble (PGLS) .
Solución de la técnica De acuerdo con un primer aspecto de la presente invención se proporciona una proteína de unión 1 de bacterias gramnegativas derivada de Tenebrio molitor (Tenebrio GNBP1) , que tiene una secuencia de aminoácidos tal como se expone en la SEC ID Nº 2. De acuerdo con un segundo aspecto de la presente invención se proporciona un polinucleótido que codifica la GNBP1 de Tenebrio , que tiene una secuencia de aminoácidos tal como se expone en la SEC ID Nº 2.
De acuerdo con un tercer aspecto de la presente invención se proporciona un procedimiento de detección de infección bacteriana en una muestra, comprendiendo el procedimiento:
(a) cargar una proteína de reconocimiento de peptidoglicano derivada de Tenebrio molitor (PGRP-SA de Tenebrio) que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 1 en una muestra y, 50 después, realizar una incubación de la misma;
(b) cargar una GNBP1 de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 2 en la mezcla de incubación de la etapa (a) y, después, realizar una incubación; y
(c) detectar reactividad entre la proteína y la muestra en la mezcla de incubación de la etapa (b) .
De acuerdo con un aspecto adicional de la presente invención se proporciona un kit para detectar infección bacteriana en una muestra, que comprende:
un PGRP-SA de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 1 y una GNBP1 de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 2.
En la presente invención también se divulga una proteína de unión 1 de bacterias gramnegativas derivada de Tenebrio molitor (Tenebrio GNBP1) , que tiene una secuencia de aminoácidos tal como se expone en la SEC ID Nº 2, y un polinucleótido que la codifica, por ejemplo un polinucleótido que tiene una secuencia de nucleótidos como se expone... [Seguir leyendo]
Reivindicaciones:
1. Una proteína de unión 1 de bacterias gramnegativas derivada de Tenebrio molitor (Tenebrio GNBP1) , que tiene una secuencia de aminoácidos tal como se expone en la SEC ID Nº 2. 5
2. Un polinucleótido que codifica la GNBP1 de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 2.
3. El polinucleótido de la reivindicación 2, que tiene una secuencia de nucleótidos como se expone en la SEC ID Nº:
3.
4. Un procedimiento de detectar infección bacteriana en una muestra, comprendiendo el procedimiento:
(a) cargar una proteína de reconocimiento de peptidoglicano derivada de Tenebrio molitor (PGRP-SA de Tenebrio) que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 1 en una muestra y, después, realizar una incubación de la misma.
(b) cargar una GNBP1 de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 2 en la mezcla de incubación de la etapa (a) y, después, realizar una incubación; y
(c) detectar reactividad entre la proteína y la muestra en la mezcla de incubación de la etapa (b) . 20
5. El procedimiento de la reivindicación 4, en el que la muestra es sangre para transfusión, sangre de mamífero, hortalizas, carnes, frutas, alimentos cocinados o no cocinados, agua corriente, agua subterránea, agua de lluvia o productos estériles.
7. Un kit para detectar infección bacteriana en una muestra, que comprende:
un PGRP-SA de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 1, y una GNBP1 de Tenebrio que tiene una secuencia de aminoácidos como se expone en la SEC ID Nº 2.
8. El kit de la reivindicación 7, en el que la muestra es sangre para transfusión, sangre de mamífero, hortalizas,
carnes, frutas, alimentos cocinados o no cocinados, agua corriente, agua subterránea, agua de lluvia o productos 35 estériles.
9. El kit de la reivindicación 7 u 8, que además comprende proteasa -lítica (blp) y/o lisozima.
Patentes similares o relacionadas:
 Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Proteínas de dominio de fibronectina tipo III con solubilidad mejorada, del 24 de Junio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un polipéptido que comprende restos de armazones a base de fibronectina que comprenden un 10º dominio de fibronectina tipo III (10Fn3) modificado, […]
Moléculas de ácido nucleico de Nucampholin para controlar plagas de insectos coleópteros, del 17 de Junio de 2020, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Una molécula de ácido nucleico aislada que comprende un polinucleótido que codifica una molécula de ácido ribonucleico de horquilla (hpARN) con una estructura […]
Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, del 17 de Junio de 2020, de TissueGUARD GmbH: Material basado en polímero con secuencias peptídicas unidas mediante enlace covalente, degradables por vía enzimática, que presentan al menos un punto disociable […]
PÉPTIDO DE MITICINA Y SU USO EN REGENERACIÓN CELULAR, del 4 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente en la regeneración celular y/o […]
Péptido de miticina y su uso en regeneración celular, del 28 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: Péptido de miticina y su uso en regeneración celular. La presente invención se refiere a unos péptidos derivados de la micitina C y sus usos terapéuticos, más concretamente […]
Separación de proteínas objetivo insolubles, del 27 de Mayo de 2020, de AMSILK GMBH: Un método para aislar una proteína de seda objetivo insoluble de una suspensión de células huésped intactas o rotas que comprende las etapas de: a) proporcionar […]
Proteínas recombinantes y sus usos terapéuticos, del 27 de Mayo de 2020, de Bioven 3 Limited: Una proteína recombinante, que comprende: una secuencia polipeptídica inmunogénica que incluye la subunidad B de la toxina del cólera (CT-B) o la subunidad […]
Procedimiento de purificación de G-CSF, del 27 de Mayo de 2020, de MYLAN PHARMACEUTICALS, INC: Procedimiento de purificación de factor recombinante estimulador de colonias de granulocitos (G-CSF), que comprende al menos una cromatografía de intercambio […]