Procedimientos para multiplexar la ampliación de la recombinasa polimerasa.
Procedimiento de ARP de ampliación de ADN de una molécula de ácido nucleico diana que comprende unaprimera y una segunda cadena de ADN,
que comprende las etapas siguientes:
(a) poner en contacto un agente de recombinasa con un primer y un segundo cebadores de ácido nucleico y untercer cebador bloqueado en extensión comprendiendo dicho cebador bloqueado en extensión uno o más restosinternos no complementarios o modificados para formar unos primer, segundo y tercer cebadores denucleoproteínas;
(b) poner en contacto los primer y segundo cebadores de nucleoproteínas con dicho ácido nucleico dianabicatenario formando de este modo una primera estructura bicatenaria entre dicho primer cebador denucleoproteínas y dicha primera cadena de ADN en una primera parte de dicha primera cadena y una segundaestructura bicatenaria entre dicho segundo cebador de nucleoproteínas y dicha segunda cadena de ADN en unasegunda porción de dicha segunda cadena de manera que los extremos 3' de dicho primer cebador denucleoproteínas y de dicho segundo cebador de nucleoproteínas están orientados uno hacia el otro en la mismamolécula de ácido nucleico diana con una tercera porción de ácido nucleico diana entre dichos extremos 3';
(c) extender el extremo 3' de dichos primer cebador de nucleoproteínas y segundo cebador de nucleoproteínascon una o más polimerasas y los dNTP para generar un primer ácido nucleico diana ampliado con una regióninterna que comprende la tercera porción de ácido nucleico;
(d) poner en contacto dicho ácido nucleico diana ampliado con dicho tercer cebador de nucleoproteínas paraformar una tercera estructura bicatenaria en la tercera porción de dicho ácido nucleico diana ampliado enpresencia de una nucleasa; en el que dicha nucleasa escinde específicamente dicho resto interno nocomplementario o modificado sólo después de la formación de dicha tercera estructura bicatenaria para formarun tercer cebador bloqueado en extensión en 3' y un tercer cebador en 5';
(e) extender el extremo 3' de dicho tercer cebador en 5' con una o más polimerasas y dNTP para generar unsegundo ácido nucleico bicatenario ampliado que comprende dicho primer cebador de ácido nucleico y dichotercer cebador en 5';
(f) continuar la reacción mediante la repetición de (b) a (e) hasta que se alcance un grado deseado del segundoácido nucleico bicatenario ampliado.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/004113.
Solicitante: Alere San Diego, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9975 Summers Ridge Road San Diego, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ARMES,NIALL,A, PIEPENBURG,OLAF, WILLIAMS,COLIN H.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2420831_T3.pdf
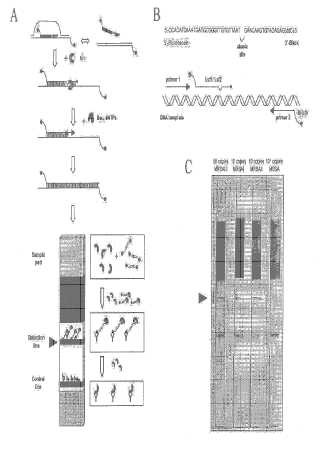
Fragmento de la descripción:
Procedimientos para multiplexar la ampliación de la recombinasa polimerasa Solicitudes relacionadas La presente solicitud reivindica los derechos de prioridad de la solicitud US 60/702.533 presentada el 25 de julio de 2005 y de la solicitud US 60/728.424 presentada el 18 de octubre de 2005.
Antecedentes La ampliación de la recombinasa polimerasa (ARP) es un proceso de ampliación de ADN que utiliza enzimas para emparejar cebadores de oligonucleótidos sintéticos con sus parejas complementarias en el ADN bicatenario. (Armes y Stemple, solicitud de patente US 60/358, 563 presentada el 21 de febrero de 2002) . La ARP depende de los componentes de la replicación del ADN celular y de las herramientas de reparación. La noción de emplear algunas de estas herramientas para la ampliación de ADN in vitro ha existido durante algún tiempo (Zarling et al. patente US nº 5.223.414) , sin embargo, el concepto no se ha transformado en una tecnología de trabajo hasta hace poco ya que, a pesar de una largo historial de investigación en el área de la función recombinasa que implica principalmente a la proteína recA de E. coli, las condiciones in vitro que permiten la ampliación sensible de ADN han determinado solo recientemente (Piepenburg et al.. solicitud de patente US 10/931.916 presentada el 1 de septiembre de 2004, también Piepenburg et al., PlosBiology 2006) .
La ARP ofrece numerosas ventajas sobre los procedimientos tradicionales de ampliación de ADN. Estas ventajas incluyen la falta de una necesidad de cualquier fusión inicial térmica o química, la capacidad de operar a bajas temperaturas constantes sin necesidad de control de la temperatura absoluta, así como la observación de que las reacciones completas (que carecen de destino) se pueden almacenar en condiciones secas. Estas características demuestran que el ARP es una herramienta única y poderosa para el desarrollo de pruebas de detección de ácidos nucleicos portátiles, precisas y sin instrumentos.
Breve descripción de la invención La presente invención se refiere a procedimientos de ampliación de ácidos nucleicos que incluyen nuevos protocolos de ampliación de recombinasa polimerasa (ARP) para la rápida y eficiente de ampliación de ácidos nucleicos en un proceso que puede multiplexarse fácilmente.
Una forma de realización de la invención se refiere a procedimientos de ARP que se pueden realizar simultáneamente en una sola reacción (en un solo tubo) y en el que los resultados se pueden detectar de forma simultánea. La reacción de ARP única se describe en primer lugar a continuación y los procedimientos de multiplexado de dicha reacción se describen en segundo lugar.
Un aspecto de la invención se refiere a los procedimientos de ARP que generan amplímeros fácilmente detectables (un ácido nucleico ampliado que es el producto de una reacción de ARP) . El procedimiento de ARP ampllió una molécula de ácido nucleico diana bicatenaria que comprende una primera y una segunda cadena de ADN. La etapa (a) implica poner en contacto un agente de recombinasa con un primer y un segundo cebador de ácido nucleico y un de la tercera ampliación que comprende uno o más restos internos no complementarios o modificados para formar unos primero, segundo y tercer cebador de nucleoproteína. La etapa (b) implica poner en contacto los primer y segundo cebadores de nucleoproteína con dicho ácido nucleico diana bicatenario formando de ese modo una primera estructura bicatenaria entre dicho primer cebador de nucleoproteína y dicha primera cadena de ADN a una primera porción de dicha primera cadena (formando un bucle D ) y una segunda estructura bicatenaria entre dicho segundo cebador de nucleoproteína y dicha segunda cadena de ADN en una segunda porción de dicha segunda cadena (formando un bucle D) de tal manera que los extremos 3' de dicho primer cebador de nucleoproteína y dicho segundo cebador de nucleoproteína están orientados uno hacia el otro en la misma molécula de ácido nucleico diana con una tercera porción del ácido nucleico diana entre dichos extremos 3'; la etapa (c) implica la ampliación del extremo 3' de dicho primer cebador de nucleoproteína y segundo cebador de nucleoproteína con una o más polimerasas y dNTP para generar un primer ácido nucleico diana ampliado con una región interna que comprende la tercera porción del ácido nucleico. La etapa (d) implica poner en contacto dicho ácido nucleico diana ampliado con dicho tercer cebador de nucleoproteína para formar una tercera estructura bicatenaria en la tercera porción de dicho ácido nucleico diana ampliado (formando un bucle D) en presencia de una nucleasa; en el que dicha nucleasa específicamente escinde dicho resto interno no complementario o modificado sólo después de la formación de dicha tercera estructura bicatenaria para formar un tercer cebador bloqueado en extensión 3' y un tercer cebador en 5'. La etapa (e) implica ampliar el extremo 3' de dicho tercer cebador 5' con una o más polimerasas y dNTP para generar un segundo ácido nucleico ampliado bicatenario que comprende dicho primer cebador de ácido nucleico y dicho tercer cebador en 5'. La reacción de ARP se continúa hasta que se alcanza un grado deseado del segundo ácido nucleico ampliado bicatenario. Cabe señalar que este proceso, junto con cualquiera de las formas de realización relacionadas, puede utilizarse para multiplexar la reacción ARP (descrita a continuación) .
El agente recombinasa puede ser, por ejemplo, uvsX, RecA y análogos funcionales de los mismos. Además, la reacción ARP puede llevarse a cabo en presencia de uvxY, gp32, las proteínas de unión monocatenarias y de otros reactivos de ARP habituales. Los procedimientos para la realización de ARP se describen, por ejemplo, en la solicitud US 60/358.563 presentada el 21 de febrero 2002, en la solicitud US 10/371.641, presentada el 21 de febrero del 2003, solicitud de patente US 10/931.916 presentada el 1 de septiembre 2004 y PCT/IB2005/001560 (documento WO 2005/118853) presentado el 11 de abril 2005.
La nucleasa utilizada en esta reacción de ARP debe escindir específicamente el resto no complementario o el resto interno modificado preferentemente cuando el tercer cebador bloqueado en extensión se hibrida con un ADN para formar una estructura bicatenaria. Es preferible que la nucleasa no escinden el resto no complementaria o el resto interno modificada cuando el cebador bloqueado en extensión está en forma monocatenaria - independientemente de si el cebador se une a la recombinasa o SSB. En una forma de realización preferida, la nucleasa es una ADN glucosilasa o AP endonucleasa. Si el resto interno modificado es un uracilo o inosina, la nucleasa preferida es uracilo glucosilasa o hipoxantina-ADN glucosilasa, respectivamente. La nucleasa puede reconocer la base no complementaria por la naturaleza de un error de emparejamiento que forma una región de restos no complementarios (es decir, una burbuja) en una estructura bicatenaria por lo demás. En este caso, la nucleasa reconoce un error de emparejamiento de bases entre los restos no complementarios y escinde el cebador en la base no complementaria.
La nucleasa utilizada en cualquiera de los procedimientos de la invención puede ser una ADN glucosilasa o un AP endonucleasa. La nucleasa puede funcionar por reconocimiento de un error de emparejamiento de bases entre la base de dicho primer cebador bloqueado en extensión y dicho ácido nucleico diana y que escinde al cebador bloqueado en extensión en el emparejamiento incorrecto de bases sin escindir el ácido nucleico diana. La nucleasa, alternativamente, puede reconocer un resto dañado, una zona abásica o un simulador de sitio abásico, o cualquier otra modificación que se pueda incorporar en oligonucleótidos sintéticos. La nucleasa puede ser, por ejemplo, fpg, Nth, MutY, MutS, MutM, MUG de E. coli., MUG humana, Ogg1 humana, glucosilasas de tipo Nei (Neil) de vertebrados, Nfo, exonucleasa III, uracil glucosilasa, hipoxantina-ADN y análogos funcionales y homólogos de los mismos. Los análogos funcionales y homólogos pueden ser de cualquier origen mamífero, bacteriano o vírico. Como ejemplos adicionales, si la base modificada es inosina, la nucleasa puede ser hipoxantina-ADN glucosilasa; si la base modificada es uracilo, la nucleasa puede ser uracilo glucosilasa. En una forma de realización preferida, estas nucleasas pueden ser de E. coli. En una forma de realización preferida, la nucleasa es Nfo de E. coli o exonucleasa III de E. coli y el resto interno modificado es un resto de tetrahidrofurano o un grupo enlazador. Un "enlazador" (también llamado enlazador de carbono o "separador") es una cadena que contiene carbono que se utiliza para unir la posición 3' de un azúcar a la posición 5' (por lo general) de otro. Los separadores corrientes... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de ARP de ampliación de ADN de una molécula de ácido nucleico diana que comprende una primera y una segunda cadena de ADN, que comprende las etapas siguientes: 5
(a) poner en contacto un agente de recombinasa con un primer y un segundo cebadores de ácido nucleico y un tercer cebador bloqueado en extensión comprendiendo dicho cebador bloqueado en extensión uno o más restos internos no complementarios o modificados para formar unos primer, segundo y tercer cebadores de nucleoproteínas;
(b) poner en contacto los primer y segundo cebadores de nucleoproteínas con dicho ácido nucleico diana bicatenario formando de este modo una primera estructura bicatenaria entre dicho primer cebador de nucleoproteínas y dicha primera cadena de ADN en una primera parte de dicha primera cadena y una segunda estructura bicatenaria entre dicho segundo cebador de nucleoproteínas y dicha segunda cadena de ADN en una segunda porción de dicha segunda cadena de manera que los extremos 3' de dicho primer cebador de nucleoproteínas y de dicho segundo cebador de nucleoproteínas están orientados uno hacia el otro en la misma molécula de ácido nucleico diana con una tercera porción de ácido nucleico diana entre dichos extremos 3';
(c) extender el extremo 3' de dichos primer cebador de nucleoproteínas y segundo cebador de nucleoproteínas con una o más polimerasas y los dNTP para generar un primer ácido nucleico diana ampliado con una región interna que comprende la tercera porción de ácido nucleico;
(d) poner en contacto dicho ácido nucleico diana ampliado con dicho tercer cebador de nucleoproteínas para formar una tercera estructura bicatenaria en la tercera porción de dicho ácido nucleico diana ampliado en presencia de una nucleasa; en el que dicha nucleasa escinde específicamente dicho resto interno no complementario o modificado sólo después de la formación de dicha tercera estructura bicatenaria para formar un tercer cebador bloqueado en extensión en 3' y un tercer cebador en 5';
(e) extender el extremo 3' de dicho tercer cebador en 5' con una o más polimerasas y dNTP para generar un segundo ácido nucleico bicatenario ampliado que comprende dicho primer cebador de ácido nucleico y dicho tercer cebador en 5';
(f) continuar la reacción mediante la repetición de (b) a (e) hasta que se alcance un grado deseado del segundo ácido nucleico bicatenario ampliado. 35
2. Procedimiento según la reivindicación 1, en el que la primera estructura bicatenaria forma parte de un primer bucle D y en el que dicha segunda estructura bicatenaria forma parte de un segundo bucle D.
3. Procedimiento según la reivindicación 1, en el que dicha nucleasa es una ADN glucosilasa o AP endonucleasa. 40
4. Procedimiento según la reivindicación 1, en el que dicho resto interno modificado es un resto de uracilo o de inosina.
5. Procedimiento según la reivindicación 4, en el que la nucleasa reconoce el resto de uracilo o de inosina y escinde 45 dicho tercer cebador bloqueado en extensión en el resto de uracilo o de inosina.
6. Procedimiento según la reivindicación 1, en el que la nucleasa reconoce un error de emparejamiento de bases entre la base no complementaria de dicho tercer cebador bloqueado en extensión y dicho ácido nucleico diana y escinde dicho tercer cebador bloqueado en extensión en dicha base no complementaria.
7. Procedimiento según la reivindicación 1, en el que dicha nucleasa se selecciona del grupo que consiste en fpg, Nth, MutY, MutS, MutM, MUG de E. coli, MUG humana, Ogg1 humana, glucosilasas tipo Nei (Neil) de vertebrados, uracil glucosilasa, hipoxantina-ADN glucosilasa y sus análogos funcionales.
8. Procedimiento según la reivindicación 1, en el que dicha nucleasa es Nfo de E. coli o exonucleasa III de E. coli y en el que el resto modificado es un resto de tetrahidrofurano o enlazador de carbono.
9. Procedimiento según la reivindicación 1, en el que la base interna modificada se selecciona de entre el grupo que consiste en 8-oxoguanina, timina glicol y simulador de sitio abásico. 60
10. Procedimiento según la reivindicación 9, en el que el simulador de sitio abásico es un resto de tetrahidrofurano o espaciador D.
11. Procedimiento según la reivindicación 1, en el que dicho tercer cebador bloqueado en extensión comprende un 65 resto en 3' bloqueado que es resistente a la ampliación por la ADN polimerasa.
12. Procedimiento según la reivindicación 11, en el que el resto en 3' bloqueado comprende un resto bloqueador que evita la extensión del cebador por la polimerasa.
13. Procedimiento según la reivindicación 12, en el que el resto bloqueador está unido al sitio 3' o 2' del azúcar del resto en 3'.
14. Procedimiento según la reivindicación 12, en el que el resto bloqueador es un marcador detectable.
15. Procedimiento según la reivindicación 14, en el que dicho marcador detectable se selecciona de entre el grupo que consiste en un fluoróforo, una enzima, un extintor, un inhibidor de enzimas, un marcador radiactivo, un miembro de un par de unión y una combinación de los mismos.
16. Procedimiento según la reivindicación 11, en el que el resto en 3' bloqueado es un didesoxinucleótido.
17. Procedimiento según la reivindicación 1, en el que dicho primer cebador de ácido nucleico comprende un primer marcador detectable y dicho tercer cebador bloqueado en extensión comprende un segundo marcador detectable.
18. Procedimiento según la reivindicación 17, en el que dichos primer y segundo marcadores detectables son diferentes y la producción de dicho segundo ácido nucleico bicatenario ampliado se controla detectando la presencia de los primer y segundo marcadores detectables en una sola molécula de ADN bicatenario.
19. Procedimiento según la reivindicación 18, en el que la producción de dicho segundo ácido nucleico ampliado bicatenario se detecta por un ensayo de tipo sándwich en el que un primer anticuerpo se une a dicho primer marcador detectable y un segundo anticuerpo se une a dicho segundo marcador detectable.
20. Procedimiento según la reivindicación 1, en el que el tercer cebador bloqueado en extensión comprende además uno o más marcadores detectables.
21. Procedimiento según la reivindicación 20, en el que dicho procedimiento comprende además la etapa de controlar el avance de la reacción de ARP detectando dicho marcador detectable en el tercer cebador bloqueado en extensión.
22. Procedimiento según la reivindicación 20, en el que dicho marcador detectable se selecciona de entre el grupo que consiste en un fluoróforo, una enzima, un extintor, un inhibidor de enzimas, un marcador radiactivo, un miembro de un par de unión y una combinación de los mismos.
23. Procedimiento según la reivindicación 22, en el que el fluoróforo está unido al tercer cebador bloqueado en extensión por un resto de fluoróforo-dT amidita.
24. Procedimiento según la reivindicación 22, en el que el extintor está unido al tercer cebador bloqueado en extensión por un resto de extintor-dT amidita.
25. Procedimiento según la reivindicación 22, en el que dicho tercer cebador bloqueado en extensión comprende un fluoróforo y un extintor.
26. Procedimiento según la reivindicación 25, en el que dichos fluoróforo y extintor están separados por entre 0 a 2 bases, 0 a 5 bases, 0 a 8 bases o 0 a 10 bases.
27. Procedimiento según la reivindicación 25, en el que dichos fluoróforo y extintor están separados por una distancia mayor cuando el cebador bloqueado en extensión se deshibrida que cuando el cebador bloqueado en extensión se hibrida con el ácido nucleico diana.
28. Procedimiento según la reivindicación 25, en el que el fluoróforo o el extintor está unido al resto interno no complementario o modificado y en el que el fluoróforo y el extintor están separados después de la escisión de la base interna modificada por la nucleasa.
29. Procedimiento según la reivindicación 25, en el que el fluoróforo se selecciona de entre el grupo de fluoresceína, FAM y TAMRA.
30. Procedimiento según la reivindicación 25, en el que el extintor es un extintor oscuro.
31. Procedimiento según la reivindicación 30, en el que dicho extintor oscuro se selecciona del grupo que consiste en Dark Quencher 1, Dark Quencher 2, Black Hole Quencher 1 y Black Hole Quencher 2.
32. Procedimiento según la reivindicación 1, en el que el primer cebador, el segundo cebador o el tercer cebador bloqueado en extensión es de 12 a 30 restos de longitud, de 12 a 40 restos de longitud o de 12 a 60 restos de
longitud.
33. Procedimiento según la reivindicación 1, en el que dicho procedimiento se lleva a cabo a una temperatura de entre 14°C y 21°C, 21°C y 25°C, 25°C y 30°C, 30°C y 37°C o 40°C y 43°C.
34. Procedimiento según la reivindicación 1, en el que dicho procedimiento amplía por lo menos la tercera parte de dicho ácido nucleico diana por lo menos 107 veces.
35. Procedimiento según la reivindicación 1, en el que dicho procedimiento se lleva a cabo en presencia de 1% a 12% de PEG, de tal manera que PEG estimula la ampliación.
36. Procedimiento según la reivindicación 1 en el que dicho procedimiento se lleva a cabo en presencia de 6% a 8% de PEG, de tal manera que PEG estimula la ampliación.
37. Procedimiento según la reivindicación 1, en el que dicho dNTP comprende dUTP y en el que dicho procedimiento de ARP se lleva a cabo en presencia de uracil glucosilasa durante un primer periodo de menos de 20 minutos y en el que dicho procedimiento se lleva a cabo en presencia de inhibidor de uracil glucosilasa después de dicho primer período.
38. Procedimiento según la reivindicación 37, en el que dicho procedimiento se realiza sin inactivación a base de temperatura de dicha uracil glucosilasa.
39. Procedimiento según la reivindicación 37, en el que dicho inhibidor de uracil glucosilasa es el inhibidor de uracil glucosilasa de fagos de Bacillus subtilis PBS1 o el inhibidor de uracil glucosilasa de fagos de Bacillus subtilis PBS2.
40. Procedimiento de ARP múltiple, que comprende las etapas de realizar más de un procedimiento de ARP en uno
o más ácidos nucleicos diana bicatenarios en una reacción en el que cada procedimiento comprende las etapas siguientes:
(a) poner en contacto un agente recombinasa con un primer y un segundo cebador de ácido nucleico y una tercer cebador bloqueado en extensión comprendiendo dicho cebador bloqueado en extensión uno o más restos internos no complementarios o modificados para formar un primero, un segundo y un tercer cebador de nucleoproteína;
(b) poner en contacto los primer y segundo cebadores de nucleoproteína con dicho ácido nucleico diana bicatenario formando de este modo una primera estructura bicatenaria entre dicho primer cebador de nucleoproteína y dicha primera cadena de ADN en una primera porción de dicha primera cadena y una segunda estructura bicatenaria entre dicho segundo cebador de nucleoproteína y dicha segunda cadena de ADN en una segunda porción de dicha segunda cadena de tal manera que los extremos 3' de dicho primer cebador de nucleoproteína y dicho segundo cebador de nucleoproteína están orientados uno hacia el otro en la misma molécula de ácido nucleico diana con una tercera porción de ácido nucleico diana entre dichos extremos 3';
(c) extender el extremo 3' de dichos primer cebador de nucleoproteína y segundo cebador de nucleoproteína con uno o más polimerasas y dNTP para generar un primer ácido nucleico diana ampliado con una región interna que comprende la tercera porción del ácido nucleico;
(d) poner en contacto dicho ácido nucleico diana ampliado con dicho tercer cebador de nucleoproteína para formar una tercera estructura bicatenaria en la tercera porción de dicho ácido nucleico diana ampliado en presencia de una nucleasa, en el que dicha nucleasa escinde específicamente dicho resto interno no complementario o modificado sólo después de la formación de dicha tercera estructura bicatenaria para formar un tercer cebador bloqueado en extensión en 3' y un tercer cebador en 5';
(e) extender el extremo 3' de dicho tercer cebador en 5' con uno o más polimerasas y dNTP para generar un segundo ácido nucleico bicatenario ampliado que comprende dicho primer cebador de ácido nucleico y dicho tercer cebador en 5';
(f) continuar la reacción mediante la repetición de (b) a (e) hasta que se alcanza un grado deseado del segundo ácido nucleico bicatenario ampliado;
en el que cada procedimiento de ARP se lleva a cabo con una combinación diferente de dichos primer y segundo cebadores de ácido nucleico y en el que cada procedimiento se realiza con el mismo tercer cebador bloqueado en extensión.
41. Procedimiento según la reivindicación 40, en el que dichos más de un procedimientos de ARP comprenden por lo menos 2 procedimientos de ARP separados, por lo menos 4 procedimientos de ARP separados, por lo menos 5 procedimientos de ARP separados, por lo menos 7 procedimientos de ARP separados o por lo menos 10
procedimientos de ARP separados.
42. Procedimiento según la reivindicación 40, en el que dicho resto interno modificado es un resto de uracilo o de
inosina. 5
43. Procedimiento según la reivindicación 40, que comprende además la etapa de detectar la formación de dicho segundo ácido nucleico ampliado bicatenario para determinar la ampliación acumulada de cualquiera de dichos más de un procedimiento de RPA.
44. Procedimiento según la reivindicación 40, en el que el primer cebador de ácido nucleico de cada procedimiento de RPA se marca con el mismo primer marcador detectable, en el que dicho tercer cebador bloqueado en extensión se marca con un segundo marcador detectable, y en el que dicha etapa de detección comprende detectar un ácido nucleico bicatenario que comprende tanto dicho primer marcador detectable como dicho segundo marcador detectable.
45. Procedimiento según la reivindicación 44, en el que la producción de dicho segundo ácido nucleico bicatenario ampliado se detecta por un ensayo de tipo sándwich en el que un primer anticuerpo se une a dicho primer marcador detectable y un segundo anticuerpo se une a dicho segundo marcador detectable.
46. Procedimiento según la reivindicación 40, en el que dicha nucleasa es una ADN glucosilasa o una AP endonucleasa.
47. Procedimiento según la reivindicación 40, en el que la nucleasa reconoce un error de emparejamiento de bases entre la base no complementaria de dicho tercer cebador bloqueado en extensión y dicho ácido nucleico diana, y 25 escinde dicho tercer cebador bloqueado en extensión en dicha base no complementaria.
48. Procedimiento según la reivindicación 40, en el que dicha nucleasa se selecciona de entre el grupo que consiste en fpg, Nth, MutY, MutS, MutM, MUG de E. coli, MUG humana, Ogg1 humana, glucosilasas de tipo Nei (Neil) de vertebrados, uracil glucosilasa, hipoxantina-ADN glucosilasa, y sus análogos funcionales.
49. Procedimiento según la reivindicación 40, en el que dicha nucleasa es Nfo de E. coli o exonucleasa III de E. coli y en el que el resto modificado es un resto de tetrahidrofurano o de enlazador de carbono.
50. Procedimiento según la reivindicación 40, en el que la base interna modificada se selecciona de entre el grupo 35 que consiste en 8-oxoguanina, timina glicol o un simulador de sitio abásico.
51. Procedimiento según la reivindicación 50, en el que el simulador de sitio abásico es un resto de tetrahidrofurano o espaciador D.
52. Procedimiento según la reivindicación 40, en el que dicho tercer cebador bloqueado en extensión comprende un resto bloqueado en 3' que es resistente a la extensión por la ADN polimerasa.
53. Procedimiento según la reivindicación 52, en el que el resto bloqueado en 3' comprende un resto bloqueador que evita la extensión del cebador por la polimerasa. 45
54. Procedimiento según la reivindicación 52, en el que el resto bloqueador está unido al sitio 3' o 2' del resto de azúcar en 3'.
55. Procedimiento según la reivindicación 54, en el que el resto bloqueado en 3' es un didesoxinucleótido. 50
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]