Métodos para modificar restos de hidratos de carbono.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FI1996/000002.
Solicitante: AB ENZYMES GMBH.
Nacionalidad solicitante: Alemania.
Dirección: FELDBERGSTRASSE 78 64293 DARMSTADT ALEMANIA.
Inventor/es: MARAS, MARLEEN, CONTRERAS, ROLAND.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12P1/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de compuestos o de composiciones, no prevista en los grupos C12P 3/00 - C12P 39/00, utilizando microorganismos o enzimas; Procedimientos generales de preparación de compuestos o composiciones que utilizan microorganismos o enzimas.
- C12P19/18 C12P […] › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › preparados por acción de una transferasa glicosílica, p. ej. alfa-, beta- o gamma-ciclodextrinas.
- C12P19/28 C12P 19/00 […] › N-glucósidos.
PDF original: ES-2260768_T3.pdf
Fragmento de la descripción:
Métodos para modificar restos de hidratos de carbono.
La invención se refiere a un procedimiento para convertir modelos de glucosilación en proteínas y proteínas producidas por recombinación, especialmente proteínas terapéuticas, que tienen un modelo híbrido o complejo. El procedimiento implica cultivar un hongo filamentoso o una levadura para producir una glucoproteína del tipo rica en manosa que es un sustrato aceptor para GlcNacTrI. El procedimiento también implica hacer reaccionar una glucoproteína del tipo rica en manosa con una α-1,2-manosidasa y GlcNac TrI en una levadura u hongo filamentoso para producir una glucoproteína híbrida.
La glucosilación afecta a muchas propiedades de una glucoproteína, incluyendo el plegamiento apropiado de la proteína, la sensibilidad/resistencia a proteasa, el tráfico intracelular y la compartimentalización, la secreción, las asociaciones inter e intramoleculares, las afinidades intermoleculares, la selección de diana tisular y la semivida biológica. Los modelos de glucosilación también alteran de manera significativa la actividad, solubilidad, aclaramiento, agregación intermolecular y antigenicidad biológicas, especialmente de aquellas proteínas que se administran terapéuticamente in vivo.
En las patentes de los EE.UU. 5.324.663 y 5.272.066 se describen métodos de síntesis para modificar estructuras de oligosacáridos en glucoproteínas.
La producción recombinante de muchas proteínas puede alterar mucho su modelo de glucosilación. Las proteínas expresadas en bacterias están completamente sin glucosilar. Los modelos de glucosilación de la levadura de panadería no son equivalentes a los homólogos mamíferos y son muy antigénicos en mamíferos (Ballou, C. E., 1982. En Strathern, J. N. et al. (eds). The Molecular Biology of the Yeast Saccharomyces. Metabolism and Gene Expression. Cold Spring Harbor Laboratory Press, New York, págs. 335-360).
De manera similar, se observan restos de glucosilo no complejos cuando se utilizan células de insecto, tales como el popular sistema de expresión de baculovirus Sf9, para expresar proteínas de mamífero (Davidson et al., Biochemistry, 29:2828-2838 (1990); Bahl, O .P. et al., en Cell Surface and Extracellular Glycoconjugates - Structure and Function, D. D. Roberts et al., eds., Academic Press, Inc. 1993 págs. 245-270). Se sintetizan oligosacáridos híbridos y ricos en manosa (Man) en proteínas producidas en células de insecto. Las estructuras primarias de estos glucanos no son diferentes de las encontradas en ciertas proteínas de mamífero tales como ribonucleasa B, tiroglobina, activador tisular de plasminógeno (este último tiene en sus sitios de glucosilación una población mixta de estructuras complejas y ricas en manosa).
Los cultivos pequeños de células de mamífero son prácticos para el uso en experimentos de expresión génica de mamíferos en laboratorio. Sin embargo, el coste y las dificultades para expresar grandes cantidades de glucoproteínas recombinantes terapéuticas en cultivos de células de mamífero son prohibitivos. Por lo tanto, se necesita un huésped que pueda producir grandes cantidades de proteínas recombinantes y que posea, o pueda modificarse para que posea, un modelo de glucosilación que sea similar al producido por las células de mamífero.
Los hongos filamentosos, por ejemplo Trichoderma, tienen ciertas ventajas como huéspedes recombinantes. Es fácil hacer crecer grandes cantidades de estos hongos y tienen la capacidad de glucosilar y secretar de manera eficaz grandes producciones de proteínas recombinantes de mamífero hacia el medio, haciendo relativamente fácil el aislamiento. Además, el modelo de glucosilación en tales proteínas es más similar a los humanos que el de la levadura de panadería. Sin embargo, todavía hay diferencias, lo que coloca a los modelos de glucosilación fúngica de tipo natural en una desventaja estructural y funcional cuando la eficacia in vivo de una proteína requiere un tipo específico de glucosilación. Por ejemplo, los residuos terminales de ácido siálico son importantes en el funcionamiento de una proteína en un sistema de mamífero, ya que impiden el aclaramiento de la glucoproteína desde el torrente sanguíneo del mamífero. Se cree que el mecanismo detrás del aumento de la semivida biológica de moléculas sialiladas está en su menor reconocimiento por parte de lectinas (Drickamer, K., J. Biol. Chem. 263:9557-9560 (1988)). Sin embargo, las células fúngicas no pueden añadir tales unidades. Las glucoproteínas sintetizadas en células fúngicas no tienen siálico.
Otra desventaja presentada por la incapacidad de generar restos de glucoproteína complejos está en la presencia de residuos terminales de manosa. Las glucoproteínas que terminan en residuos de manosa son ligandos para proteínas que se unen a manosa en macrófagos y células del sistema reticuloendotelial (Ezekowitz et al., J. Cell Sci. Suppl. 9:121-133 (1988)). Mientras esto puede ser útil en algunos casos limitados, en lo que respecta a fines de selección de diana, esto tiene una consecuencia farmacológica indeseable para la mayoría de proteínas recombinantes - por ejemplo, el rápido aclaramiento del compuesto desde la sangre. El rápido aclaramiento puede afectar de manera deletérea a la farmacocinética del agente administrado y disminuir su potencial terapéutico y aumentar su toxicidad. Por tanto, los modelos de glucosilación no complejos producidos por recombinación dificultan el uso de glucoproteínas obtenidas por recombinación para uso terapéutico humano (Sareneva, T. et al., Interferon Res. 13:267-269 (1993)).
Estas desventajas puede bloquear la utilidad biológica o farmacológica de las proteínas mamíferas generadas utilizando sistemas de transformación final. Por tanto, en la industria de glucoproteínas se ha sentido desde hace tiempo una necesidad de proporcionar modelos de glucosilación de tipo complejo o híbrido en glucoproteínas en huéspedes fúngicos, que pueden modificarse in vivo y/o in vitro, lo que les permite producir modelos de glucosilación similares a los encontrados en proteínas de eucariotas superiores.
Reconociendo la necesidad de una producción económica a gran escala de proteínas recombinantes que tienen un modelo de glucosilación mamífero, los inventores han investigado el tratamiento de residuo glucosilo en células de mamífero y fúngicas. Estos estudios han conducido al descubrimiento de que hongos filamentosos tales como Trichoderma pueden secretar una proteína deseada en forma de precursor inmaduro glucosilado que puede tratarse in vitro hasta un modelo de glucosilación mamífero de tipo híbrido. Este descubrimiento ha dado como resultado el desarrollo de métodos para preparar modelos de glucosilación de proteína complejos e híbridos, similares a los encontrados en huéspedes mamíferos.
Por consiguiente, en una primera realización, se modifica secuencialmente el modelo de glucosilación de una proteína glucosilada deseada (glucoproteína) mediante la reacción con N-acetilglucosaminil-transferasa I (GlcNAc Tr I), galactosiltransferasa y sialiltransferasa, de modo que se produce una proteína que tiene un modelo de glucosilación de tipo complejo o híbrido con ácido(s) siálico(s) terminal(es) similar al de las células de mamífero.
Por consiguiente, en una realización adicional, se modifica secuencialmente el modelo de glucosilación de una proteína glucosilada deseada en una levadura u hongo filamentoso con α-1,2-manosidasa, para mejorar la reacción con GlcNAc Tr I, galactosiltransferasa y sialiltransferasa, de modo que se produce un modelo de glucosilación de tipo híbrido con un residuo(s) ácido(s) siálico(s) terminal(es) similar al de células de mamífero.
Por consiguiente, en una realización adicional, glucoproteínas del tipo ricas en manosa se expresan en, y preferiblemente se secretan a partir de, un huésped fúngico filamentoso que se ha transformado con GlcNAc Tr I, y se modifican mediante reacción secuencial con galactosiltransferasa y sialiltransferasa de modo que se produce un modelo de glucosilación de tipo híbrido con un ácido siálico terminal, una estructura similar a la de las células de mamífero.
Por consiguiente, en una realización adicional, se modifica el patrón de glucosilación de la proteína glucosilada deseada producida en un huésped fúngico, tal como levadura u hongo filamentoso, preferiblemente Trichoderma... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para producir una glucoproteína híbrida, caracterizada porque dicho procedimiento comprende cultivar un hongo filamentoso de manera que produzca una glucoproteína del tipo rica en manosa que es un sustrato aceptor para GlcNAc Tr I, y hacer reaccionar dicha glucoproteína del tipo rica en manosa con GlcNAc Tr I.
2. Procedimiento según la reivindicación 1, en el que dicha glucoproteína del tipo rica en manosa es una proteína que es homóloga a dicho hongo.
3. Procedimiento según la reivindicación 1, en el que dicha glucoproteína del tipo rica en manosa es una proteína que es heteróloga a dicho hongo.
4. Procedimiento según la reivindicación 1, en el que dicho hongo es Trichoderma o Aspergillus.
5. Procedimiento según la reivindicación 1, en el que dicho hongo es Trichoderma reesei, Aspergillus niger o Aspergillus oryzae.
6. Procedimiento según la reivindicación 1, en el que dicha glucoproteína del tipo rica en manosa se hace reaccionar con GlcNAc Tr I intracelularmente en dicho hongo.
7. Procedimiento según la reivindicación 1, en el que dicha glucoproteína del tipo rica en manosa se hace reaccionar con α-1,2-manosidasa.
8. Procedimiento para producir una glucoproteína híbrida en una levadura u hongo filamentoso, caracterizado porque dicho procedimiento comprende
9. Procedimiento según la reivindicación 8, en el que la etapa (8) se produce intracelularmente.
10. Procedimiento según la reivindicación 8, en el que dicha levadura se selecciona del grupo que consiste en un miembro de Pichia spp., Hansenula spp., Kluyveromyces lactis, S. cerevisiae, y Yarrowia lipolytica.
11. Procedimiento según la reivindicación 10, en el que dicha Pichia spp. es Pichia pastoris.
12. Procedimiento según la reivindicación 10, en el que dicha Hansenula spp. es Hansenula polymorpha.
13. Procedimiento según la reivindicación 10, en el que dicha levadura es S. cerevisiae.
14. Procedimiento según la reivindicación 8, en el que dicho hongo es Trichoderma o Aspergillus.
15. Procedimiento según la reivindicación 14, en el que dicho hongo es Trichoderma reesei, Aspergillus niger o Aspergillus oryzae.
16. Procedimiento según la reivindicación 1 o la reivindicación 8, en el que la glucoproteína del tipo rica en manosa se hace reaccionar con una UDP-GlcNAc.
17. Procedimiento según la reivindicación 1 o la reivindicación 8, que comprende además hacer reaccionar dicha glucoproteína híbrida con β-1,4-galactosiltransferasa.
18. Procedimiento según la reivindicación 17, en el que se hace reaccionar dicha glucoproteína híbrida con UDP-galactosa.
19. Procedimiento según la reivindicación 18, que comprende además hacer reaccionar dicha glucoproteína híbrida con α-2,6-sialiltransferasa.
20. Procedimiento según la reivindicación 19, en el que se hace reaccionar dicha glucoproteína híbrida con CMP-ácido siálico.
21. Procedimiento según cualquiera de las reivindicaciones 17-20, en el que dichas etapas de reacción se llevan a cabo in vitro.
22. Procedimiento según la reivindicación 8, en el que se hace reaccionar dicha glucoproteína híbrida con una α-1,2-manosidasa antes de dicha reacción con GlcNAc Tr I.
23. Procedimiento según la reivindicación 1 o la reivindicación 8, en el que dicha glucoproteína del tipo rica en manosa es una Man5GlcNAc2 que tiene la estructura
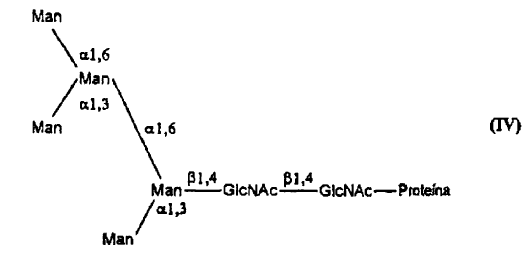
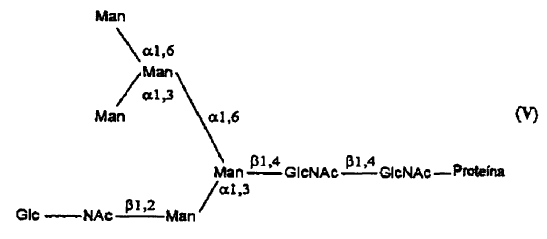
24. Procedimiento según la reivindicación 1 o la reivindicación 8, en el que dicha glucoproteína del tipo rica en manosa es una Glc-NAc-Man5GlcNAc que tiene la estructura
Patentes similares o relacionadas:
Método para preparar una disolución acuosa que contiene medio de cultivo y agente quelante, del 22 de Julio de 2020, de Kyowa Kirin Co., Ltd: Método para preparar una disolución acuosa que presenta una filtrabilidad de membrana mejorada que comprende un medio de cultivo, en el que el medio de […]
Método de producción de productos químicos mediante fermentación continua, del 13 de Mayo de 2020, de TORAY INDUSTRIES, INC.: Un método para producir productos químicos mediante fermentación continua, comprendiendo el método: (a) generar productos químicos por fermentación con un medio de cultivo […]
Métodos de cultivo semicontinuo repetido, del 5 de Febrero de 2020, de Mara Renewables Corporation: Un método de cultivo semicontinuo repetido de un microorganismo Thraustochytrid productor de aceite que comprende las etapas de: (a) proporcionar un recipiente que comprende […]
Proceso para hidrólisis enzimática de material lignocelulósico usando GH61, adición de oxígeno y alto contenido de materia seca, del 15 de Enero de 2020, de DSM IP ASSETS B.V.: Proceso para la preparación de un producto de azúcar a partir de material lignocelulósico, que comprende las siguientes etapas: a) opcionalmente, pretratamiento […]
Procedimiento para hidrólisis enzimática de material lignocelulósico con adición de oxígeno, del 23 de Octubre de 2019, de DSM IP ASSETS B.V.: Procedimiento para la preparación de un producto de azúcar a partir de material lignocelulósico, que comprende las siguientes etapas: a) opcionalmente, pretratamiento […]
Proceso para la descomposición de material de biomasa que contiene lignocelulosa, del 28 de Agosto de 2019, de CLARIANT INTERNATIONAL LTD.: Proceso para la descomposición de material de biomasa que contiene lignocelulosa, que comprende las etapas: (a) proporcionar material […]
Método para preparar una disolución acuosa que contiene medio de cultivo y agente quelante, del 25 de Abril de 2019, de KYOWA HAKKO KIRIN CO., LTD.: Método para preparar una disolución acuosa que presenta una filtrabilidad de membrana mejorada que comprende un medio de cultivo y un agente quelante, en el […]
Métodos y composiciones para producir aldehídos grasos, del 5 de Diciembre de 2018, de REG Life Sciences, LLC: Célula microbiana modificada por ingeniería genética para sobreexpresar (i) un polipéptido que tiene actividad ácido carboxílico reductasa y […]