Métodos para determinar la actividad de Lp-PLA2.
Un método para medir la Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) enzimáticamente activa en una muestra obtenida de un individuo,
el método incluye:
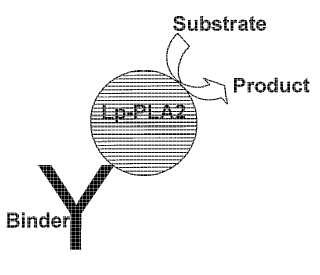
(a) Poner en contacto un aglutinador inmovilizado, esto une específicamente Lp-PLA2 con la muestra;
(b) Lavar el aglutinador inmovilizado para eliminar el material no unido enzimáticamente activo o una sustancia interferente;
(c) Poner en contacto la unión Lp-PLA2 con un sustrato convertido a un producto detectable en presencia de Lp-PLA2; y
(d) Medir el producto detectable indicativo de Lp-PLA2 enzimáticamente activa en la muestra.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/003211.
Solicitante: DIADEXUS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 343 OYSTER POINT BOULEVARD SOUTH SAN FRANCISCO, CA 94080 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WOLFERT,ROBERT,L, KIM,NAM, DUAN,XIAOZHU.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D271/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 271/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen dos átomos de nitrógeno y un átomo de oxígeno como únicos heteroátomos del ciclo. › Oxadiazoles-1,2,5; Oxadiazoles-1,2,5 hidrogenados.
- C07K16/00 C07 […] › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12Q1/44 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › esterasa.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/573 G01N 33/00 […] › para enzimas o isoenzimas.
PDF original: ES-2416344_T3.pdf
Fragmento de la descripción:
ÁMBITO DE LA INVENCIÓN
La presente invención se refiere a métodos para determinar la actividad de la Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) . Concretamente, se refiere a determinar la actividad de Lp-PLA2 por el uso de aglutinadores específicos de Lp-PLA2 y/o sustratos con capacidad para convertirse en un producto detectable en varios formatos. Además, esta invención se refiere a un ensayo de actividad de inmunocaptura híbrida para determinar de forma específica la actividad de Lp-PLA2.
ORÍGENES DE LA INVENCIÓN
Introducción La Fosfolipasa A2 asociada a la lipoproteína (Lp-PLA2) es una proteína 50 kD enzimáticamente activa. Lp-PLA2 es un miembro de la familia de las fosfolipasas A2 y, a diferencia de la mayoría de las fosfolipasas, es Ca2+ independiente. Lp-PLA2 ha sido identificada y descrita anteriormente en la bibliografía de Tew et al. (1996) Arterioscler. Thromb. Vase. Biol. 16:591-599, Tjoelker, et al. (1995) Nature 374 (6522) :549-53) y Caslake et al. (2000) Atherosclerosis 150 (2) : 413-9. Igualmente se han descrito la proteína y los inmunoensayos en la bibliografía sobre patentes WO 95/00649-A1, Patentes de EE.UU. 5.981.252; 5.968.818; y 6.177.257 (para SmithKline Beecham) y WO 00/24910-A1, Patentes de EE.UU. 5.532.152 ; 5.605.801; 5.641.669; 5.656.431; 5.698.403; 5.977.308; y 5.847.088 (para ICOS Corporation) . Lp-PLA2 se expresa por macrófagos, con una expresión incrementada en las lesiones ateroscleróticas (Hakkinin (1999) Arterioscler Thromb Vase Biol 19 (12) : 2909-17) . Lp-PLA2 circula ligada principalmente a LDL, copurifica con LDL, y es responsable del >95% de la actividad de la fosfolipasa asociada con LDL (Caslake 2000) .
En estudios recientes, los niveles de fosfolipasa A2 asociada a la lipoproteína (Lp-PLA2) han demostrado estar significativamente correlacionados en hombres con enfermedad coronaria angiográficamente demostrada (CHD) (Caslake 2000) y asociada a hombres con hipercolesterolemia (Packard (2000) N Engl J Med 343 (16) : 1148-55) .
La enfermedad coronaria del corazón (CHD) es la única enfermedad mortal más frecuente en los Estados Unidos. Para el año 2003, se estima que aproximadamente 1, 1 millones estadounidenses tendrá un nuevo o recurrente ataque coronario (ver la página web de la American Heart Association, americanheart con la extensión .org de la World Wide Web) . Aproximadamente el 60% de estos individuos no presentaron anteriormente factores de riesgo. Es evidente que existe una gran necesidad de diagnosticar a los individuos con riesgo de desarrollar enfermedades del corazón, seleccionando a pacientes adecuados para la terapia y hacer un seguimiento de la respuesta a las terapias aplicadas y reducir el riesgo del individuo.
Se han publicado varios métodos para detectar la proteína Lp-PLA2, los cuales incluyen inmunoensayos (Caslake, 2000) , ensayos de actividad (Kit de ensayo PAF Acetylhydrolase, Cat#760901, Cayman Chemical, Ann Arbor, MI, 12/18/97 (caymanchem con la extensión . com de la World Wide Web) ; El kit Auto PAF-AH de Azwell disponible en Nesco Company, Azwell Inc., 2-24-3 Sho, Ibaraki, Osaka, Japón o Karlan Chemicals, Cottonwood, Arizona, ver también Kosaka (2000) ) , ensayos espectrofotométricos para la actividad en suero de la acetilhidrolasa del factor activador de plaquetas (Clin Chem Acta 296: 151-161, WO 00/32808 (para Azwell) ) . Otros métodos publicados para detectar Lp-PLA2 incluyen WO 03/048172 (para SIRS-LAB) y WO 2005/001416 (para Glaxo) . Ninguno de esos documentos o solicitudes publicados ofrecen un método para medir la actividad y la masa de Lp-PLA2.
Recientemente, la United States Food and Drug Administration (FDA) ha dado la autorización para realizar una prueba ELISA para la determinación cuantitativa de Lp-PLA2 en plasma humano para su utilización como predictor de riesgo para enfermedades cardíacas coronarias (CHD) ( (2003) Sep-Oct; La nueva prueba predice el riesgo cardiaco. FDA Consum. 37 (5) : 6.
Estos formatos de ensayo tienen limitaciones. Por ejemplo, los ensayos que miden solo la actividad enzimática sufren la actividad competitiva para el sustrato por parte de otras enzimas o sustancias presentes en la muestra de prueba. Por ejemplo, muchos miembros de la familia de la fosfolipasa A2 muestran actividad enzimática hacia la fosfatidilcolina oxidada. Además, el ensayo de actividad Cayman sufre la señal de fondo debido a las sustancias en suero que convierten el sustrato independiente de la actividad de Lp-PLA2. Concretamente, el kit Cayman se basa en la detección de tiol libre como parte de la metodología. Mientras que el ensayo Cayman puede funcionar bien en un entorno de laboratorio, la detección de tioles libres hace que el kit Cayman sea poco adecuado para medir Lp-PLA2 (o PAF-AH) en muestras humanas a causa de los numerosos tioles libres en las muestras de plasma, suero o tejido humano. Además, los ensayos existentes pueden detectar una actividad erróneamente elevada debido a la falta de especificidad. Las mediciones falsas de actividad en un entorno clínico pueden conducir a un diagnóstico inadecuado de la enfermedad, o una respuesta de un paciente a un tratamiento concebido para reducir la actividad enzimática.
En cambio, los inmunoensayos convencionales basados en anticuerpos son altamente específicos y capaces de detectar y cuantificar la cantidad de un objetivo de interés entre otras proteínas estrechamente relacionadas. Sin embargo, no son capaces de determinar el nivel de actividad enzimática del objetivo. Mientras que este formato de ensayo asegure que sólo se está midiendo la proteína de interés, esta limitación impide que tales ensayos sean herramientas útiles en el seguimiento de una respuesta a un inhibidor de la enzima. En consecuencia, existe una gran necesidad de un ensayo capaz de seleccionar específicamente la Lp-PLA2 de entre otros miembros de la familia PLA2 que sea más capaz de medir la actividad enzimática de Lp-PLA2.
La enfermedad cardiaca coronaria La enfermedad coronaria vascular (ECV) abarca todas las enfermedades de la vasculatura, incluyendo presión arterial alta, la enfermedad cardíaca coronaria (CHD) , accidente cerebrovascular, defectos cardiovasculares congénitos, e insuficiencia cardíaca congestiva. Los estudios han demostrado que la CHD es responsable de la mayoría de las ECV. La prevalencia de enfermedad coronaria aumenta notablemente en función de la edad, los hombres tienen una mayor prevalencia sobre las mujeres dentro de la mayoría de los grupos de edad.
El estándar actual de cuidados para identificar individuos con riesgo sufrir una enfermedad cardíaca es la medición de un panel de lípidos, incluyendo triglicéridos, colesterol total, el colesterol de lipoproteínas de baja densidad (LDL) , colesterol de lipoproteínas de alta densidad (HDL) (Panel de Tratamiento en Adultos III) . Resumen ejecutivo del Tercer Informe del Panel de Expertos en Detección, Evaluación y Tratamiento de la Hipercolesterolemia en Adultos del National Cholesterol Education Program (NCEP) , (Panel de Tratamiento en Adultos III) . JAMA (2001) 285 (19) : 2486-97. De acuerdo con las recientes directrices (2001) del Panel de Tratamiento de Adultos III (ATP III) , en función de la puntuación de los factores de riesgo, a los individuos con niveles de colesterol LDL de > 100 a <130 mg /dL se les recomienda iniciar los cambios terapéuticos en su estilo de vida. A los adultos con colesterol LDL >130 mg/dL se les recomienda la terapia intensiva en el estilo de vida y un tratamiento farmacológico reductor del colesterol LDL para alcanzar un objetivo de colesterol LDL de <100 mg /dL. Los pacientes con niveles de LDL> 160 mg /dL deben tenerse en cuenta para las terapias con fármacos hipolipemiantes. La American Heart Association ha estimado que más de 100 millones de adultos en los EE.UU. superan el nivel óptimo de colesterol total. Ver la página web de la americanheart.org de la World Wide Web.
Mientras que la investigación continúa vinculando elevados niveles de colesterol LDL con el riesgo de cardiopatía coronaria, es bien entendido que un número importante de individuos con niveles normales de colesterol LDL experimentan un evento cardiaco, lo que sugiere que otros factores no reconocidos actualmente pueden estar implicados (Eaton (1998) J Am Board Fam Pract 11 (3) : 180-6) . En la búsqueda de nuevos factores de riesgo, se ha prestado una atención significativa en los últimos años a los marcadores de inflamación, al tiempo que surge un cuerpo creciente de investigación básica y clínica en relación con el papel de la inflamación en la aterogénesis (Lusis (2000) Atherosclerosis. Nature 407 (6801) : 233-41; Lindahl (2000) N Engl J Med 343 (16) : 1139-1147) . Algunos de los marcadores inflamatorios investigados... [Seguir leyendo]
Reivindicaciones:
1. Un método para medir la Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) enzimáticamente activa en una muestra obtenida de un individuo, el método incluye:
(a) Poner en contacto un aglutinador inmovilizado, esto une específicamente Lp-PLA2 con la muestra;
(b) Lavar el aglutinador inmovilizado para eliminar el material no unido enzimáticamente activo o una sustancia interferente;
(c) Poner en contacto la unión Lp-PLA2 con un sustrato convertido a un producto detectable en presencia de Lp-PLA2; y
(d) Medir el producto detectable indicativo de Lp-PLA2 enzimáticamente activa en la muestra.
2. Un método según la reivindicación 1 en donde la muestra es una muestra de suero, una muestra de plasma o una muestra de plasma tratada con EDTA o una muestra de suero tratada con EDTA.
3. Un método según cualquiera de las reivindicaciones 1 o 2 en donde el aglutinador inmovilizado es un anticuerpo.
4. Un método según cualquiera de las reivindicaciones de 1 a 3, el método incluye además comparar el producto detectable medido del paso (d) a un producto detectable en un control que incluya un estándar de Lp-PLA2 enzimáticamente activa.
5. Un método según cualquiera de las reivindicaciones 1 a 4, en donde el aglutinador inmovilizado está unido a una placa de pocillos múltiples, una perla magnética o una perla de látex.
6. Un método para medir la Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) enzimáticamente activa en una muestra obtenida de un individuo, el método incluye:
(a) Poner en contacto un aglutinador, que une específicamente Lp-PLA2 con la muestra para formar un complejo aglutinante-Lp-PLA2;
(b) Inmovilizar el complejo aglutinante-Lp-PLA2;
(c) Lavar el complejo aglutinante-Lp-PLA2 inmovilizado para eliminar el material no unido enzimáticamente activo o una sustancia interferente;
(d) Poner en contacto la unión inmovilizada de Lp-PLA2 con un sustrato convertido a un producto detectable en presencia de Lp-PLA2; y
(e) Medir el producto detectable indicativo de Lp-PLA2 enzimáticamente activa en la muestra.
7. Un método según la reivindicación 6 en donde la muestra es una muestra de suero, una muestra de plasma o una muestra de plasma tratada con EDTA.
8. Un método según cualquiera de las reivindicaciones 6 o 7 en donde el aglutinador es un anticuerpo.
9. Un método según cualquiera de las reivindicaciones 6 a 8, en donde el complejo aglutinante-Lp-PLA2 se inmoviliza uniéndose a un compuesto inmovilizado.
10. Un método según cualquiera de las reivindicaciones de 6 a 9 en donde el complejo inmovilizado es un anticuerpo, proteína o compuesto capaz de unir el complejo aglutinante-Lp-PLA2.
11. Un método según cualquiera de las reivindicaciones 6 a 10, en donde el compuesto inmovilizado está unido a una placa de pocillos múltiples, una perla magnética o una perla de látex.
12. Un método según cualquiera de las reivindicaciones de 6 a 8 en donde el aglutinante se conjuga con un agente inmovilizador.
13. Un método según la reivindicación 12, en donde el aglutinador conjugado con un agente inmovilizador es un anticuerpo.
14. Un método según la reivindicación 12, en donde el agente inmovilizador es un anticuerpo, proteína o compuesto capaz de unirse a un compuesto inmovilizado.
15. Un método según cualquiera de las reivindicaciones 12 a 14 en donde el agente inmovilizador es biotina.
16. Un método según cualquiera de las reivindicaciones de 12 a 15, en donde el agente inmovilizador, conjugado con el complejo aglutinante-Lp-PLA2, se une a un compuesto inmovilizado.
17. Un método según la reivindicación 16, en donde el compuesto inmovilizado está unido a una placa de pocillos múltiples, una perla magnética o una perla de látex.
18. Un método según la reivindicación 16 o 17, en donde el compuesto inmovilizado es un anticuerpo, proteína o compuesto capaz de unirse a un agente inmovilizado conjugado.
19. Un método según cualquiera de las reivindicaciones 16 a 18 en donde el compuesto inmovilizador es estreptavidina.
20. Un método según la reivindicación 6, que incluye además comparar el producto detectable medido de la etapa (e) con un producto detectable en un control que incluya un estándar de Lp-PLA2 enzimáticamente activa.
21. Un método según cualquiera de las reivindicaciones 4 o 20 en donde el estándar de Lp-PLA2 enzimática activa es una proteína Lp-PLA2 recombinante o una proteína Lp-PLA2 nativa.
22. Un método según la reivindicación 21, en donde la proteína Lp-PLA2 recombinante se expresa con un sistema de expresión baculovirus o un sistema de expresión de mamífero.
23. Un método según la reivindicación 4 o 20, en donde una diferencia en un producto detectable en la muestra comparado con el estándar se debe a una diferencia en la actividad Lp-PLA2 en la muestra comparado con el estándar.
24. Un método para detectar la enfermedad vascular en un individuo que incluya la utilización del método según la reivindicación 23 para determinar la actividad Lp-PLA2 del individuo en una muestra, en donde la actividad incrementada de Lp-PLA2 en la muestra es indicativo de enfermedad vascular.
25. Un método para seleccionar a un individuo para someterlo a terapia para tratar la enfermedad vascular que incluya la utilización del método según la reivindicación 23 para determinar la actividad Lp-PLA2 del individuo en una muestra, en donde la actividad incrementada de Lp-PLA2 en la muestra indicará quién se beneficiará de la terapia para tratar la enfermedad vascular.
26. Un método para monitorear la respuesta de un individuo a la terapia para tratar la enfermedad vascular que comprende utilizar el método de acuerdo con la reivindicación 23 para determinar la actividad Lp-PLA2 del individuo en una muestra en donde la actividad disminuida de Lp-PLA2 en la muestra indica que un individuo está respondiendo favorablemente a la terapia para tratar la enfermedad vascular.
27. Un método según cualquiera de las reivindicaciones 24, 25 o 26 en donde la enfermedad vascular se selecciona del grupo formado por la enfermedad coronaria vascular (ECV) , enfermedad cardíaca coronaria (CHD) , enfermedad vascular periférica, enfermedad arterial periférica, apoplejía, defectos cardiovasculares congénitos y la insuficiencia cardíaca congestiva.
28. Un método según cualquiera de las reivindicaciones 25 o 26 en donde la terapia se selecciona del grupo formado por estatinas e inhibidores de Lp-PLA2.
29. Un método según cualquiera de las reivindicaciones de 1 a 28, en donde el sustrato se selecciona del grupo formado por
En donde X se selecciona del grupo formado por O, S, y -O (CO) -;
R se selecciona del grupo formado por (CH2) 4CH3, (CH2) 6CH3, (CH2) 8CH3, (CH2) 10CH3, (CH2) 12CH3, (CH2) 14CH3 y (CH2) 7CH=CH (CH2) 2CH3; Y1 se selecciona del grupo formado por (CO) 1-2 y (CH2) 2-7; y Y2 se selecciona del grupo formado por CO y CH2;
X se selecciona del grupo formado por O, S, y -O (CO) -;
R se selecciona del grupo formado por (CH2) 4CH3, (CH2) 6CH3, (CH2) 8CH3, (CH2) 10CH3, (CH2) 12CH3, (CH2) 14CH3 y (CH2) 7CH=CH (CH2) 2CH3; Y1 se selecciona del grupo formado por (CO) 1-2 y (CH2) 2-7; y Y2 se selecciona del grupo formado por CO y CH2;
l-myristoyl-2- (4-nitrophenylsuccinyl) phosphatidylcholine (MNP) ;
donde;
X se selecciona del grupo formado por O, S, y -O (CO) -;
R se selecciona del grupo formado por (CH2) 4CH3, (CH2) 6CH3, (CH2) 8CH3, (CH2) 10CH3, (CH2) 12CH3, (CH2) 14CH3 y (CH2) 7CH=CH (CH2) 2CH3;
Y1 se selecciona del grupo formado por (CO) 1-2 y (CH2) 2-7; y
Y2 se selecciona del grupo formado por CO y CH2;
30. Un método según la reivindicación 29, en donde el sustrato es un derivado oxidado de (a) , (b) , (c) , (d) o (e) .
31. Un método según cualquiera de las reivindicaciones anteriores, en donde un producto detectable tiene una etiqueta radioactiva, colorimétrica, paramagnética o fluorescente.
32. Un método según cualquiera de las reivindicaciones anteriores, en donde un producto detectable se mide 20 fluorimétricamente, colorimétricamente, paramagnéticamente o por medio de radiación.
33. Un método según cualquiera de las reivindicaciones 3, 8 o 13 en donde el anticuerpo es un anticuerpo monoclonal, un anticuerpo con expresión en fago o un anticuerpo policlonal.
34. Un método según la reivindicación 33, en donde el anticuerpo es un anticuerpo monoclonal.
35. Un método según cualquiera de las reivindicaciones 10, 14 o 18 en donde el anticuerpo es un anticuerpo monoclonal, un anticuerpo con expresión en fago o un anticuerpo policlonal.
36. Un método según la reivindicación 35, en donde el anticuerpo monoclonal, el anticuerpo con expresión en fago, o el anticuerpo policlonal es un anticuerpo anti-lg de rata, ratón o cabra.
37. Un método según cualquiera de las reivindicaciones precedentes, en donde el material no unido enzimáticamente activo es una fosfolipasa.
38. Un método según cualquiera de las reivindicaciones 1 a 36 en donde la sustancia interferente es un compuesto de tioles libres.
39. Un kit para medir una Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) enzimáticamente activa en una muestra que incluye un anticuerpo que une específicamente Lp-PLA2 y un sustrato definido en la reivindicación 29 o 30.
40. Un kit según la reivindicación 39 que incluye además un estándar de Lp-PLA2 enzimáticamente activo.
41. Un método para medir la Fosfolipasa A2 asociada a la Lipoproteína (Lp-PLA2) enzimáticamente activa en una muestra obtenida de un individuo, el método incluye:
(a) La incubación de la muestra con un compuesto que reduce los tioles activos en la muestra;
(b) Poner en contacto la muestra incubada con un sustrato convertido a un producto de tioles libres en presencia de una Lp-PLA2 enzimáticamente activa; y
(d) Medir el producto detectable de tioles libres indicativo de la Lp-PLA2 enzimáticamente activa en la muestra.
42. Un método según la reivindicación 41 en donde la muestra es una muestra de suero, una muestra de plasma
o una muestra de plasma tratada con EDTA.
43. Un método según la reivindicación 41 o 42 en donde el compuesto que reduce los tioles activos en la muestra es DTNB.
44. Un método según cualquiera de las reivindicaciones 41 a 43 en donde la muestra se incuba a temperatura ambiente.
45. Un método según cualquiera de las reivindicaciones 41 a 43 en donde la muestra se incuba a 37º C.
46. Un método según cualquiera de las reivindicaciones 41 a 45 en donde la muestra se incuba aproximadamente de 2 minutos a 120 minutos.
47. Un método según cualquiera de las reivindicaciones 41 a 45 en donde la muestra se incuba aproximadamente de 5 minutos a 30 minutos.
48. Un método según cualquiera de las reivindicaciones de 43 a 47, en donde el sustrato se selecciona del grupo formado por
2. tio-PAF, y
donde;
R se selecciona del grupo formado por (CH2) 4CH3, (CH2) 6CH3, (CH2) 8CH3, (CH2) 10CH3, (CH2) 12CH3, (CH2) 14CH3 y (CH2) 7CH=CH (CH2) 2CH3;
Y1 se selecciona del grupo formado por (CO) 1-2 y (CH2) 2-7; y
Y2 se selecciona del grupo formado por CO y CH2;
49. Un método según la reivindicación 48, en donde el sustrato es un derivado oxidado de (a) o (b) .
50. Un método según la reivindicación 41, que incluye además comparar el producto de tioles libres medido de
la etapa (c) con un producto tioles libres en un control que incluya un estándar de Lp-PLA2 enzimáticamente 15 activa.
51. Un método según cualquiera de las reivindicaciones de 41 a 50 en donde las etapas (a) , (b) y (c) son conducidos a una placa de pocillos múltiples.
52. Un kit según cualquiera de las reivindicaciones 40 o un método según la reivindicación 50 en donde el estándar de Lp-PLA2 enzimáticamente activa es una proteína Lp-PLA2 o una proteína Lp-PLA2 nativa.
53. Un kit según la reivindicación 52, en donde la proteína Lp-PLA2 recombinante se expresa con un sistema de expresión baculovirus o un sistema de expresión de mamífero.
54. Un método para detectar la enfermedad vascular en un individuo que incluya la utilización del método según cualquiera de las reivindicacione.
4. 51 para determinar la actividad Lp-PLA2 del individuo en una muestra, en donde la actividad incrementada en la muestra tal y como se compara con el control es indicativa de la enfermedad vascular.
55. Un método para seleccionar a un individuo para terapia para tratar enfermedades vasculares que incluya la utilización del método según cualquiera de las reivindicacione.
4. 51 para determinar la actividad Lp-PLA2 del individuo en una muestra, en donde la actividad incrementada de Lp-PLA2 en la muestra comparada con el control es indicativa de un individuo que se beneficiará de la terapia para tratar la enfermedad vascular.
56. Un método para monitorear la respuesta de un individuo a la terapia para tratar enfermedades vasculares que incluya la utilización del método según cualquiera de las reivindicacione.
4. 51 para determinar la actividad Lp-PLA2 del individuo en una muestra en donde la actividad disminuida de Lp-PLA2 en la muestra comparada con el control es indicativa de un individuo que está respondiendo favorablemente a la terapia para tratar la enfermedad vascular.
57. Un método según cualquiera de las reivindicaciones 54, 55 o 56 en donde la enfermedad vascular se selecciona del grupo formado por la enfermedad coronaria vascular (ECV) , enfermedad cardíaca coronaria (CHD) , enfermedad vascular periférica, enfermedad arterial periférica, apoplejía, defectos cardiovasculares congénitos y la insuficiencia cardíaca congestiva.
ººººººººººººººº
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]