Mejora de la producción de proteínas.
Método de producción de una proteína de interés heteróloga en una célula,
que comprende
aumentar la expresión o actividad de una proteína que tiene una secuencia aminoacídica que comprende la proteína de transferencia de ceramida CERT o un derivado o mutante de la misma, y
b. efectuar la expresión de dicha proteína de interés,
en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y en donde dicho mutante se basa en una modificación orientada de secuencias CERT 10 mediante sustitución, inserción o deleción de uno a diez aminoácidos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/052493.
Solicitante: BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173 55216 INGELHEIM AM RHEIN ALEMANIA.
Inventor/es: KAUFMANN,HITTO, FLORIN,LORE, BECKER,ERIC, OLAYIOYE,MONILOLA, HAUSSER,ANGELIKA, FUGMANN,TIM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/67 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Métodos generales para favorecer la expresión.
PDF original: ES-2397274_T3.pdf
Fragmento de la descripción:
Mejora de la producción de proteínas
ANTECEDENTES DE LA INVENCIÓN
CAMPO TÉCNICO
La invención se refiere al campo de la tecnología de cultivo celular. Se refiere a un método para producir proteínas así como a un método para generar vectores de expresión novedosos y células anfitrionas para la fabricación de productos biofarmacéuticos. La invención se refiere adicionalmente a composiciones farmacéuticas y a métodos de tratamiento.
ANTECEDENTES
El mercado de los productos biofarmacéuticos para uso en terapia humana continúa creciendo a una gran velocidad, evaluándose 270 nuevos productos biofarmacéuticos en estudios clínicos por ventas estimadas de 30 billones de dólares en 2003 (Werner, 2004) . Los productos biofarmacéuticos pueden producirse a partir de diversos sistemas de células anfitrionas, incluyendo células bacterianas, células de levadura, células de insecto, células de planta y células de mamífero, incluyendo estirpes celulares derivadas de seres humanos. Actualmente, se produce un número creciente de productos biofarmacéuticos por células eucarióticas debido a su capacidad de procesar y modificar correctamente proteínas humanas. Es por tanto crucial una producción exitosa y de alto rendimiento de productos biofarmacéuticos a partir de estas células, y depende en gran medida de las características de la estirpe celular monoclonal recombinante utilizada en el proceso. Por lo tanto, existe una urgente necesidad de generar nuevos sistemas de células anfitrionas con propiedades mejoradas y de establecer métodos para cultivar estirpes celulares productoras con altas productividades específicas como base para procesos de alto rendimiento.
Los enfoques anteriores se han centrado en el diseño de proceso y el diseño de reactor. Ahora, las principales mejoras están impulsadas por el desarrollo de la formulación de medios y la ingeniería genética de células anfitrionas. Los sistemas de células anfitrionas de mamífero industriales más comunes para la producción de productos biofarmacéuticos son estirpes celulares de ovario de hámster chino (CHO) inmortalizadas (Wurm, 2004) . Las estrategias de ingeniería metabólica iniciales para mejorar las estirpes celulares de producción de mamíferos se han centrado en su capacidad de crecer en suspensión en medios exento de suero. La expresión estable de transferrina y factor de crecimiento similar a insulina 1 (IGF-1) en células CHO-K1 dio como resultado una estirpe celular capaz de proliferar en condiciones exentas de proteína (Pak et al., 1996) . Enfoques adicionales para mejorar las estirpes celulares de producción incluyeron el uso de elementos reguladores de ADN en los vectores de transfección dirigidos a orientar a o crear puntos calientes transcripcionales. Se ha mostrado que elementos reguladores tales como S/MARs (regiones asociadas a estructura/matriz) que afectan a la estructura de la cromatina y los UCOEs (elementos de apertura de cromatina ubicuos) derivados de genes constitutivos afectaban ambos positivamente a las productividades específicas de proteínas recombinantes producidas a partir de estirpes celulares CHO (Barnes y Dickson, 2006) .
Ya que se ha mostrado que la apoptosis es la causa predominante de muerte celular en procesos de producción de cultivo de células de mamíferos (al-Rubeai y Singh, 1998) , se ha investigado concienzudamente el efecto de la expresión de genes antiapoptóticos en células anfitrionas de mamífero sobre la viabilidad de cultivo. La mayoría de las estrategias de ingeniería antiapoptótica están centradas en la sobre-expresión de genes antiapoptóticos de la familia bcl-2 (por ejemplo, bcl-1 o bcl-xL; (Kaufmann y Fussenegger, 2003) . Al aumentar la resistencia celular a los estímulos apoptóticos durante la fermentación, tales como el agotamiento de nutrientes y la acumulación de subproductos de desecho, los procesos de producción con estirpes celulares con la apoptosis modificada por ingeniería genética mostraron una viabilidad de cultivo prolongada y, en algunos casos, un aumento en el rendimiento de producto (Chiang y Sisk, 2005) .
Puesto que la mayoría de los productos biofarmacéuticos son proteínas que se secretan por las células durante el proceso de producción, la maquinaria de transporte secretor de la estirpe celular de producción es otra diana interesante para estrategias novedosas de ingeniería genética de células anfitrionas.
La secreción de proteína es un mecanismo multietapa complejo: Las proteínas destinadas a ser transportadas al espacio extracelular o a la membrana plasmática externa se introducen en primer lugar cotraduccionalmente al retículo endoplásmico. Desde allí, se empaquetan en vesículas lipídicas y se transportan al aparato de Golgi y finalmente desde la red trans-Golgi (TGN) a la membrana plasmática, donde se liberan al medio de cultivo (Seth et al., 2006) .
El rendimiento de cualquier proceso de producción biofarmacéutica depende en gran medida de la cantidad de producto proteico que secreten las células productoras por unidad de tiempo cuando crecen en condiciones de proceso. Son necesarios muchos procesos bioquímicos intracelulares complejos para sintetizar y secretar una proteína terapéutica por una célula eucariótica. Todas estas etapas tales como transcripción, transporte de ARN, traducción, modificación post-traduccional y transporte de proteína están estrechamente reguladas en la estirpe de célula anfitriona de tipo silvestre, y tendrán una repercusión sobre la productividad específica de cualquier estirpe celular productora derivada de este anfitrión.
Muchos enfoques de ingeniería genética han empleado la creciente comprensión de las redes moleculares que impulsan procesos tales como la transcripción y la traducción para aumentar el rendimiento de estas etapas en la producción de proteína. Sin embargo, como para cualquier proceso de producción multietapa, ampliar un cuello de botella durante las etapas tempranas de la cadena del proceso posiblemente crea cuellos de botella más adelante, especialmente después de la traducción. Hasta cierto umbral, se ha reseñado que la productividad específica de la célula de producción se correlaciona linealmente con el nivel de transcripción génica del producto (Barnes et al., 2007) . Sin embargo, una potenciación adicional de la expresión de producto a nivel de ARNm puede conducir a una sobrecarga de la maquinaria de síntesis, plegado o transporte de proteína, dando como resultado una acumulación intracelular del producto proteico. Es más, esto puede observarse frecuentemente en procesos de fabricación actuales (FIGURA 1) .
Los enfoques de ingeniería genética orientados específicos dirigidos a enfrentarse a este problema y a mejorar eficazmente la secreción de productos proteicos a partir de células eucarióticas están restringidos por la falta actual de comprensión de la compleja red regulatoria que impulsa el transporte de proteínas a la membrana plasmática.
Los primeros estudios sobre ingeniería genética del transporte intracelular de proteínas terapéuticas secretadas se han centrado en la sobreexpresión de chaperonas moleculares como proteína de unión BiP/GRP78 y proteína disulfuro isomerasa (PDI) . Las chaperonas son proteínas celulares albergadas en el retículo endoplásmico (ER) que ayudan al plegamiento y ensamblaje de proteínas recién sintetizadas. En contraposición con lo que podría esperarse, se ha mostrado que la sobreexpresión de BiP en células de mamífero reduce en lugar de aumentar la secreción de proteínas con las que se asocia (Dorner y Kaufman, 1994) . Igualmente, la sobreexpresión de PDI en células CHO reducía la expresión de una proteína de fusión TNFR:FC (Davis et al., 2000) , mientras que la velocidad de producción específica de un anticuerpo aumentaba un 40% (Borth et al., 2005) . Una posible explicación para estos sorprendentes descubrimientos, que el aumento de la capacidad de plegamiento de la proteína celular crea un cuello de botella más adelante, es apoyada por un artículo que describe problemas de transporte de ER a cis-Golgi para la producción de IFN-gamma en una estirpe celular CHO (Hooker et al., 1999) .
Otro enfoque reciente para aumentar la capacidad de secreción de células de mamífero es la sobreexpresión heteróloga del factor de transcripción proteína de unión a la secuencia X 1 (XBP-1) . La XBP-1 es uno de los reguladores maestros en la diferenciación de células plasmáticas, un tipo celular especializado optimizado para la producción a alto nivel y la secreción de anticuerpos (Iwakoshi et al., 2003) . La XBP-1 regula este proceso uniéndose a los denominados elementos sensibles al estrés del ER (ERSE) en los promotores... [Seguir leyendo]
Reivindicaciones:
1. Método de producción de una proteína de interés heteróloga en una célula, que comprende aumentar la expresión o actividad de una proteína que tiene una secuencia aminoacídica que comprende la proteína de transferencia de ceramida CERT o un derivado o mutante de la misma, y
b. efectuar la expresión de dicha proteína de interés, en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y en donde dicho mutante se basa en una modificación orientada de secuencias CERT mediante sustitución, inserción o deleción de uno a diez aminoácidos.
2. Método según la reivindicación 1, en el que la proteína CERT es la proteína de transferencia de ceramida CERT (SEC ID Nº 11 o SEC ID Nº 13 o un derivado o mutante de la misma, en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y en donde dicho mutante se basa en una modificación orientada de secuencias CERT mediante sustitución, inserción o deleción de uno a diez aminoácidos.
3. Método según la reivindicación 2, en el que la proteína CERT es proteína de transferencia de ceramida CERT mutada y dicha mutación incapacita y/o suprime un sitio de fosforilación en cualquier posición de serina, treonina o tirosina de CERT.
4. Método según la reivindicación 3, en el que la proteína CERT es proteína de transferencia de ceramida CERT mutada y dicha mutación incapacita y/o suprime el sitio de fosforilación de proteína cinasa D (PKD) de CERT en la posición 132.
5. Método según la reivindicación 4, en el que la CERT mutada es CERT S132A (SEC ID Nº 15) .
6. Método según las reivindicaciones 1 a 5, en el que dicho método da como resultado una productividad celular específica aumentada de dicha proteína de interés en dicha célula en comparación con una célula de control que expresa dicha proteína de interés, pero en la que dicha célula de control no tiene la expresión o actividad aumentada de una proteína que tiene una secuencia aminoacídica que comprende un dominio de transferencia de lípido relacionado con la proteína de transferencia de ceramida CERT o un derivado o mutante del mismo.
7. Método para aumentar la productividad celular específica de una proteína de interés de membrana o secretada en una célula, que comprende introducir en una célula uno o más sistemas de vector que comprenden secuencias de ácidos nucleicos que codifican al menos dos polipéptidos, en los que un primer polinucleótido codifica una proteína que tiene una secuencia aminoacídica que comprende una proteína de transferencia de ceramida CERT o un derivado o mutante del mismo, y
b. un segundo polinucleótido que codifica una proteína de interés
c. y en el que la proteína de interés y la proteína que tiene una secuencia aminoacídica que comprende una proteína de transferencia de ceramida CERT, o un derivado o mutante del mismo, se expresan por dicha célula, en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y en donde dicho mutante se basa en una modificación orientada de secuencias CERT mediante sustitución, inserción
o deleción de uno a diez aminoácidos.
8. Método para aumentar la eficacia de transfección de una célula que expresa una proteína de interés de membrana o secretada en una célula, que comprende transfectar dicha célula con un primer polinucleótido que codifica una proteína que tiene una secuencia aminoacídica que comprende una proteína de transferencia de ceramida CERT o un derivado o mutante del mismo,
b. transfectar posteriormente dicha célula con un segundo polinucleótido que codifica una proteína de interés, en el que dichos primer y segundo polinucleótidos están localizados en sistemas de vector diferentes, en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y en donde dicho mutante se basa en una modificación orientada de secuencias CERT mediante sustitución, inserción o deleción de uno a diez aminoácidos.
9. Vector de expresión que comprende dos polinucleótidos,
a. un primer polinucleótido que codifica una proteína que tiene una secuencia aminoacídica que comprende una proteína de transferencia de ceramiad CERT o un derivado o mutante del mismo, y
b. un segundo polinucleótido que codifica una proteína de interés, en donde dicho derivado es una molécula de polipéptido que es al menos un 70% idéntica en la secuencia con la secuencia CERT original o su secuencia complementaria, o dicho derivado es una secuencia CERT homóloga de un organismo diferente, y 5 en donde dicho mutante se basa en una modificación orientada de secuencias CERT mediante sustitución, inserción o deleción de uno a diez aminoácidos.
10. Vector de expresión según la reivindicación 9, en el que la proteína de transferencia de ceramida CERT tiene la SEC ID Nº 11 o SEC ID Nº 13. 1.
11. Vector de expresión según la reivindicación 9, en el que la CERT mutada es CERT S132A (SEC ID Nº 15) .
12. Una célula que comprende el vector de expresión de las reivindicaciones 9 a 11.
13. Uso de una proteína de transferencia de ceramida CERT o un polinucleótido que codifica una proteína de transferencia de ceramida CERT para aumentar la secreción y/o producción de una proteína de interés.
FIGURA 1
FIGURA 2
Familia proteica del dominio START
FIGURA 3
A
B
CERT
FIGURA 4
FIGURA 5 FIGURA 6
B
FIGURA 7
FIGURA 8 FIGURA 9
A nhnntnnntnhtnhhntnnnWnnnnnnnnnnnnnnnnnhhthnnnnnnnnnnnnnnnnnnn+hnthhnnnnnnnhnnnhhntnnnnnntWppnhnn nnnnnnnnnnnhthlpnhtnsnnnnnnnsnlnhnnntnnhnnnhnsnRhhnlRnhpnnnnnnnnnnnttnhhlhnnohpnntnnnnnnnnnthhRsph hnshhhhpnnttsnnnnnnnnnnnnsphhhlnnhhtsnnnnnnnpnhhpnhhtnthnnhhpnnnnhtthptntnp
B rhogap_rat/1-20 HFLQDCVDGLFKEVKEKFKGWVSYP-----TSEQAELSYKKVS-------------EGPP CONSENSO/80% .h..t...t.ht.hh.t...W.................hhth.................. CONSENSO/65% .httpsttthhphhtsstttWhh..........pttttshpth.............tsps CONSENSO/50% phpscsspshlppsssspcsWspss......ptcstpcshpphsss..........sucs
rhogap_rat/1-20 LRLWRATIEVPA--APEEILKRLLKEQHLWDVDLL-----------DSKVIEILDSQ--- CONSENSO/80% .+h.thh.......h...hh.t......tWpp.h.............hthlp.ht.s... CONSENSO/65% h+hhshl.tss...hhtplhpsh.....pWcpsht...........tspslctlsss... CONSENSO/50% hRstulVsssss.plsp-lhccsth.hhcWDcshs...........pspll-slsss...
rhogap_rat/1-20 ----TEIYQYVQNSMA--PHPA-RDYVVLRTWRTN-------LPRGACALLFTSVDHDRA CONSENSO/80% ....s.l.h...t..h...h.s.R-hh.lR.hp..... .....tt.hhlh..ohp..t. CONSENSO/65% ....sslhhhhsphhh..slss.R-hlhlRhh+p.... ....spsshslsstSlsp.pt CONSENSO/50% ....uslpahssssss.sPlsP.RDaVhVRpp+p.... ....sccsalllssSlspsss
rhogap_rat/1-20 P------VAGVRVNVLLSRYLIEPCGSGK-----------SKLTYMCRADLRGHMP---- CONSENSO/80% ........thhRsphh.shhhhp..tts............sphhhl..h-hts....... CONSENSO/65% s.......shlRschhsothhlpspsss............splsal.ps-lputh..... CONSENSO/50% ss....psuhlRucphPSGhlIcssusGh...........o+lsalppsDLcGpsP....
rhogap_rat/1-20 EWYTKSFGHLCAAEVVKIRDSFSNQSTESKD CONSENSO/80% p.hhp.hht.th..hhp....htthpt.t.p CONSENSO/65% phhhcshhppshh.hhct..hhstlpptstp CONSENSO/50% ctll+slhssuhspss+p..phAsLpcssp+
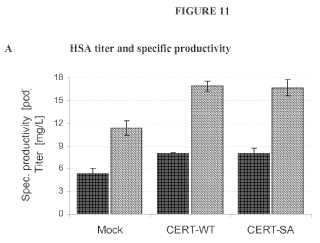
FIGURA 10 A Productividad específica de mAB en cultivos en serie B Productividad específica en procesos semicontinuos FIGURA 11 A Título de HSA y productividad específica B Productividad específica en procesos semicontinuos
Patentes similares o relacionadas:
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para aumentar la expresión de un antígeno patogénico codificado, del 3 de Junio de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica en la dirección 5' → 3' para: i) • una región codificante, que codifica para al menos […]
Procedimientos para la administración terapéutica de medicamentos de ácido ribonucleico mensajero, del 13 de Mayo de 2020, de Modernatx, Inc: Un ARN mensajero (ARNm) que codifica un polipéptido de interés, donde el ARNm comprende: (i) al menos un sitio de unión de microARN de miR-142-3p; (ii) al […]
Ácidos ribonucleicos con nucleótidos modificados con 4-tio y procedimientos relacionados, del 15 de Abril de 2020, de Translate Bio, Inc: Una molécula de ARNm que tiene una región codificante y opcionalmente, una o más regiones no codificantes, en donde al menos el 25% de los residuos de nucleótidos del […]
Sistema de expresión bacteriano cistrónico doble, del 25 de Marzo de 2020, de LUPIN LIMITED: Un procedimiento para la producción de un anticuerpo o un fragmento del mismo que comprende las etapas de: (i) transformar una célula hospedadora bacteriana […]
Moléculas de ácido nucleico artificiales para una expresión proteica mejorada, del 19 de Febrero de 2020, de CureVac AG: Molécula de ácido nucleico artificial que comprende a) al menos un marco de lectura abierto (ORF); y b) al menos una región 3'-no traducida (3'-UTR) […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para incrementar la expresión de un antígeno tumoral codificado, del 12 de Febrero de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica para, en la dirección 5' a 3': i) - una región codificante que codifica al menos un péptido […]
Constructo y secuencia para la expresión genética mejorada, del 15 de Enero de 2020, de ProteoNic Biotechnology IP B.V: Metodo para la transcripcion y/o expresion y, opcionalmente, la purificacion del transcrito y/o proteina o polipeptido de interes producidos que […]