Procedimiento para la determinación temprana de recidivas tras la terapia para el cáncer de próstata.
Un procedimiento para detectar si un paciente tiene una recidiva bioquímica en etapa temprana (ES - BCR) otiene una enfermedad estable,
que comprende
a) proporcionar dos o más muestras obtenidas a partir del paciente en los 18 meses posteriores a la terapia parael cáncer de próstata;
b) medir el nivel del PSA en las muestras mediante el uso de un inmunoensayo en formato de sándwichheterogéneo para el PSA con un límite de detección al menos tan bajo como de 2,0 pg / ml, usando dichoinmunoensayo en formato de sándwich una reacción en cadena de la polimerasa (PCR) para la generación de laseñal;
c) usar el nivel del PSA de las muestras para determinar un valor del PSA;
donde la ES - BCR se detecta si el valor del PSA es de al menos, o excede, un indicador de PSA, y la enfermedadestable se detecta si el valor del PSA no excede el indicador de PSA,
donde el indicador de PSA es una velocidad de aumento de la [PSA] de aproximadamente 2,0 pg / ml / mes.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/001114.
Solicitante: IRIS INTERNATIONAL, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9162 Eton Avenue Chatsworth, CA 91311 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KLEM, ROBERT, E., ADAMS,THOMAS, JABLONSKI,EDWARD, SARNO,MARK J, SAUNDERS,RUSS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
PDF original: ES-2433745_T3.pdf
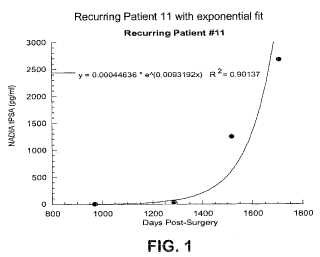
Fragmento de la descripción:
Procedimiento para la determinación temprana de recidivas tras la terapia para el cáncer de próstata
Campo de la invención Esta invención se refiere a procedimientos útiles en la detección de recidivas bioquímicas en etapa temprana o de una enfermedad estable.
Antecedentes e introducción a la invención En todo el mundo se producen aproximadamente 670.000 nuevos casos de cáncer de próstata al año. Las estadísticas de incidencia del cáncer de próstata en el Reino Unido, http: //info.cancerresearchuk.org/cancerstats/types/prostate/incidence/ (último acceso el 23 de enero de 2009) . En Europa 15 en 2004 se diagnosticaron 237.800 casos nuevos y se produjeron 85.200 muertes debidas al cáncer de próstata. Boyle, P y col. Annals of Oncology 16: 481 -488 (2005) . Además de los factores clínicos de riesgo tales como los antecedentes familiares de cáncer, hábitos tabáquicos, edad y raza, la detección inicial del cáncer de próstata se basa generalmente en los hallazgos de un aumento en las concentraciones circulantes de una proteína denominada antígeno prostático específico (PSA) , una proteasa de serina neutra producida por las células epiteliales prostáticas normales, benignas y malignas. El PSA producido por las células prostáticas está presente tanto en forma libre como complejada en el líquido seminal, el suero, el plasma y la orina, y puede ser medido en esos fluidos. La medición simultánea de la forma libre y complejada se denomina medición de "PSA total" y puede denominarse correctamente como "tPSA" o "PSA." La concentración del PSA en la sangre aumenta en varias enfermedades prostáticas, particularmente en el cáncer de próstata, y este aumento de la concentración está reflejado en las mediciones séricas del PSA. Valsanen y col., Prostate Cancer and Prostatic Disease 2: 91 -97 (1999) . Por lo tanto, durante las últimas dos décadas se han usado ensayos tales como inmunoensayos convencionales para el PSA sérico en la detección inicial del cáncer de próstata. Yu y col., J. Urology 157: 913 -918 (1997) .
Generalmente, si se observa un aumento en las concentraciones séricas de PSA en un paciente, se realiza una biopsia de próstata para confirmar la presencia del cáncer y para caracterizar la patología oncológica. Una vez confirmado el cáncer de próstata, aproximadamente dos tercios de los pacientes se tratan mediante una prostatectomía radical (RP, la extirpación quirúrgica completa de la próstata) , o con radiación, terapia hormonal o mediante diversos procedimientos. Sin embargo, hasta el 40% de esos pacientes tratados pueden experimentar recidivas de la enfermedad. Véase Moul, J. Urology 163: 1632 -1642 (2000) . Las recidivas del cáncer de próstata 35 están asociadas con un mal pronóstico de supervivencia. Sin embargo, el pronóstico puede mejorarse si se detecta la recidiva en una etapa temprana, de forma que puedan iniciarse unos procedimientos de tratamiento apropiado que incluyen tratamientos de rescate. Desafortunadamente, los procedimientos existentes para la evaluación de la probabilidad de recidivas son insuficientes para una detección temprana. Las observaciones clinicopatológicas tomadas antes o en el momento de la RP, tales como la etapa del cáncer, la puntuación de Gleason, la edad en el diagnóstico, la implicación del margen quirúrgico (presencia del cáncer en el margen quirúrgico) , la invasión de tejidos locales por parte del cáncer, la invasión de la cápsula prostática por parte del cáncer, la invasión de la vesícula seminal por parte del cáncer, la invasión del cuello de la vejiga por parte del cáncer, la invasión de los nódulos linfáticos por parte del cáncer y el volumen tumoral total, son en cierto modo informativos en la valoración de la probabilidad de la recidiva de la enfermedad, pero no siempre son predictivos y no pueden usarse para identificar
el momento exacto de una recidiva. Puede usarse una biopsia o procedimientos por imagen de diversos tipos para confirmar la recidiva de la enfermedad, pero estos procedimientos adolecen de una baja sensibilidad. Generalmente, en el momento en el que una biopsia o un estudio por imagen detecta nuevos tumores, la recidiva está en una etapa tardía, cuando el pronóstico es especialmente malo. Por lo tanto, estos procedimientos son insuficientes para una detección temprana y un tratamiento agresivo basado en la misma.
Para abordar las carencias de basar la recidiva de la enfermedad en los hallazgos clinicopatológicos y en los estudios de biopsia o por imagen, la recidiva de la enfermedad se basará principalmente en los hallazgos de un aumento en las concentraciones séricas del PSA en el paciente después del tratamiento. Por ejemplo, después de una prostatectomía radical en la que no queda ningún tejido prostático residual secretor de PSA y ha pasado un 55 tiempo suficiente para el aclaramiento fisiológico de los niveles preparatorios del PSA, la concentración sérica de PSA cae hasta una cifra mínima. Si las concentraciones séricas del PSA volvieran aumentar después del punto de la cifra mínima, puede ser indicativo de una recidiva de la enfermedad. Este tipo de recidiva se denomina "recidiva bioquímica" (BCR) ya que la recidiva sólo se refleja como un aumento en los niveles circulantes del PSA en lugar de como nuevos hallazgos de tumores locales o distantes. La recidiva bioquímica del PSA se ha transformado en el estándar actual de asistencia en el tratamiento médico del cáncer de próstata después de un tratamiento tal como una RP.
Se han publicado diversos umbrales para establecer el punto en el que se cree que aparece una recidiva bioquímica. Cookson MS, y col. J Urology 177: 540 -545 (2007) . Típicamente se utiliza un valor de 200 pg / ml (0, 2 65 ng / ml) tras las cifras mínimas de PSA para definir el punto de recidiva bioquímica. Id. Los ensayos convencionales del PSA tienen unos límites de detección en el intervalo de 100 pg / ml, con unas sensibilidades funcionales posiblemente mayores. El tiempo medio de detección de una recidiva bioquímica mediante el uso de un ensayo convencional de PSA con un límite de detección de 100 pg / ml es superior a 38, 4 meses. Vassilikos y col., Clinical Biochemistr y 33 (2) : 115 -123 (2000) . Witherspoon y Lapeyrolerie, J. Urology 157, 1322 -1328 (1997) ; Seto y col., Luminescence 16, 285 -290 (2001) ; Doherty y col., Br. J. Cancer 83, 1432 -1436 (2000) ; Ellis y col., Adult Urology
50, 573 -579 (1997) ; Klee y col., Urology 44, 76 -82 (1994) ; Taylor y col., BJU International 98, 540 -543 (2006) ; Prott y col., Anticancer Research 23, 979 -982 (2003) ; Manetti y col., J. Endocrinol. Invest. 25, RC29 -RC31 (2002) ; el documento WO2004/042030, el documento WO2006/137932, el documento WO 02/068695 describen ensayos del PSA.
Breve resumen de la invención La presente invención proporciona un procedimiento para detectar si un paciente tiene una recidiva bioquímica en una etapa temprana (ES -BCR) o si tiene una enfermedad estable, que comprende a) proporcionar dos o más muestras obtenidas a partir del paciente en los 18 meses posteriores a la terapia para el cáncer de próstata; b) medir el nivel del PSA en las muestras mediante el uso de un inmunoensayo en formato de sándwich heterogéneo para el PSA con un límite de detección al menos tan bajo como de 2, 0 pg / ml, usando dicho inmunoensayo en formato de sándwich una reacción en cadena de la polimerasa (PCR) para la generación de la señal; c) usar el nivel del PSA de las muestras para determinar un valor del PSA;
donde la ES -BCR es detectada si el valor del PSA es de al menos, o excede, un indicador de PSA, y se detecta una enfermedad estable si el valor del PSA no excede el indicador de PSA,
donde el indicador de PSA es una velocidad de aumento de la [PSA] de aproximadamente 2, 0 pg / ml / mes.
En una forma de realización adecuada, la invención proporciona un procedimiento donde el indicador de PSA es una velocidad de aumento de la [PSA] de aproximadamente 4, 0 pg / ml / mes.
En otra forma de realización adecuada, la invención proporciona un procedimiento donde el indicador de PSA es una velocidad de aumento de la [PSA] de 6, 58 pg / ml / mes.
Esta invención es útil para el control de los pacientes tratados por enfermedad prostática y para la detección del cáncer de próstata, y para la terapia de seguimiento de la recidiva del cáncer o de la enfermedad estable, o tras una decisión de administrar una terapia tras la prostatectomía dependiendo de las observaciones clínicas y de los valores del PSA y de los indicadores de PSA de esta invención. La presente invención tiene ventajas sobre otros ensayos convencionales del PSA sérico para la identificación de la recidiva bioquímica del cáncer de próstata tras... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para detectar si un paciente tiene una recidiva bioquímica en etapa temprana (ES -BCR) o tiene una enfermedad estable, que comprende a) proporcionar dos o más muestras obtenidas a partir del paciente en los 18 meses posteriores a la terapia para el cáncer de próstata; b) medir el nivel del PSA en las muestras mediante el uso de un inmunoensayo en formato de sándwich heterogéneo para el PSA con un límite de detección al menos tan bajo como de 2, 0 pg / ml, usando dicho inmunoensayo en formato de sándwich una reacción en cadena de la polimerasa (PCR) para la generación de la señal; c) usar el nivel del PSA de las muestras para determinar un valor del PSA;
donde la ES -BCR se detecta si el valor del PSA es de al menos, o excede, un indicador de PSA, y la enfermedad 15 estable se detecta si el valor del PSA no excede el indicador de PSA, donde el indicador de PSA es una velocidad de aumento de la [PSA] de aproximadamente 2, 0 pg / ml / mes.
2. El procedimiento de la reivindicación 1 donde el indicador de PSA es una velocidad de aumento de la [PSA] de aproximadamente 4, 0 pg / ml / mes. 20
3. El procedimiento de la reivindicación 1 donde el indicador de PSA es una velocidad de aumento de la [PSA] de 6, 58 pg / ml / mes.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]