Formulación de liposomas de mitoxantrona y procedimiento para la preparación de los mismos.
Un fármaco liposómico, en el que (1) el fármaco liposómico comprende mitoxantrona;
(2) el liposoma del fármacoliposómico tiene un tamaño de 30-80 nm; (3) la bicapa del liposoma comprende un fosfolípidos con una temperaturade transición de fase (Tm) superior a la temperatura corporal, de modo que la temperatura de transición de fase delliposoma es mayor que la temperatura corporal, la del colesterol y la de un lípido modificado con polímero hidrófilo; y(4) la fase intraliposómica del liposoma comprende un contraion multivalente en la que el contraion multivalente esportador de dos o más cargas opuestas a la del ingrediente farmacológico activo, seleccionándose el contraionmultivalente de un anión de ácido orgánico saturado o insaturado, un anión de ácido inorgánico o una forma iónicade un aminoácido, y en la que el ácido orgánico está seleccionado de ácido cítrico, ácido tartárico, ácido fumárico,ácido oxálico, ácido malónico, ácido succínico, ácido málico y ácido maleico; el ácido inorgánico está seleccionadodel anión sulfato y el anión fosfato; el aminoácido está seleccionado de cisteína.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CN2007/071403.
Solicitante: CSPC Zhongqi Pharmaceutical Technology (Shijiazhuang) Co., Ltd.
Nacionalidad solicitante: China.
Dirección: No. 226, Huanghe Street, Shijiazhuang Hebei 050035 CHINA.
Inventor/es: ZHANG, LI, SHEN, DONGMIN, GUO,WENMIN, LI,CHUNLEI, WANG,JINXU, WANG,CAIXIA, LI,YANHUI, ZHANG,LAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/136 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen el grupo amino unido directamente al ciclo aromático, p. ej. benzamina.
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2401526_T3.pdf
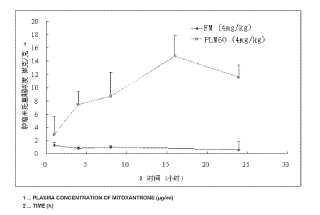
Fragmento de la descripción:
Formulación de liposomas de mitoxantrona y procedimiento para la preparación de los mismos Campo de la invención La presente invención se refiere a una preparación liposómica y a una preparación farmacéutica liposómica para encapsular fármacos, especialmente a una preparación farmacéutica liposómica de mitoxantrona. La presente invención también se refiere a procedimientos para fabricar el liposoma, la preparación farmacéutica liposómica y a usos de los mismos.
Antecedentes de la invención Los liposomas se pueden usar como vehículo para muchos fármacos, especialmente para fármacos antitumorales (en particular fármacos quimioterapéuticos) . Los liposomas pueden reducir la distribución del fármaco en tejidos normales, pero aumentan la acumulación del fármaco en tejidos tumorales, de modo que mejoran el índice terapéutico del fármaco. La razón por la cual un liposoma puede dirigirse pasivamente a un tumor está relacionada con las propiedades fisiológicas del tejido tumoral. Los vasos sanguíneos tumorales pueden tener un tamaño de poro de hasta 100-780 nm debido a su rápido crecimiento, mientras que las células endoteliales vasculares tienen un espacio típico de aproximadamente 2 nm. Por tanto, los liposomas se pueden acumular de forma pasiva en la región del tumor si pueden circular en la sangre durante un periodo relativamente largo de tiempo y tienen un tamaño inferior a 200 nm, ya que una vez que los liposomas con un tamaño pequeño se administran mediante inyección intravenosa, no pueden entrar en los tejidos normales pero pueden penetrar en el vaso sanguíneo de una región tumoral y llegar al área de tratamiento.
No obstante, no es fácil conseguir las ventajas terapéuticas de los liposomas y se tienen que cumplir los cuatro requisitos siguientes: (1) el fármaco se puede encapsular en el liposoma con una buena eficiencia de encapsulación y una carga farmacológica suficiente; (2) el fármaco no se liberará del liposoma durante el periodo de almacenamiento in vitro; (3) no existe una pérdida considerable de fármaco durante la circulación en sangre del fármaco en el liposoma; y (4) el fármaco se puede liberar con eficacia y, por tanto, puede ejercer sus efectos terapéuticos cuando los liposomas se acumulan en la región tumoral. Con respecto a las actuales técnicas liposómicas, los tres primeros problemas se han solucionado bien, por lo que la liberación racional in vivo del fármaco en el liposoma requiere más atención. Un problema técnico crucial que se ha de resolver para desarrollar fármacos liposómicos es controlar de un modo eficaz la liberación racional de fármacos liposómicos después de dirigirlos a una región tumoral. Esto es especialmente importante para algunos fármacos, tales como mitoxantrona.
Un grupo de estudio de liposomas en Canadá descubrió que una formulación liposómica con un tamaño de aproximadamente 100 nm preparada usando fosfatidilcolina de soja hidrogenada (HSPC) y colesterol como bicapa fosfolipídica y cargando el fármaco mediante un gradiente de ácido cítrico 300 mM no era tan buena como la mitoxantrona libre. Con el fin de mejorar el efecto terapéutico de los liposomas, el grupo cambió finalmente la composición de la bicapa de fosfolípidos a dimiristoil fosfatidilcolina (DMPC) y colesterol y obtuvo una preparación con mejores índices terapéuticos. No obstante, la pérdida de fármaco puede aumentar durante el periodo de almacenamiento porque la temperatura de transición de fase de la DMPC es de aproximadamente 21 ºC, de modo que la preparación puede no ser estable (Liposomal formulations of mitoxantone, documento US 5.858.397) .
Neopharm Corporation de EE.UU. usó otra técnica para desarrollar una formulación liposómica de mitoxantrona en la que a la bicapa de fosfolípidos se añadió una cardiolipina portadora de una carga negativa. Debido a la intensa interacción entre la cardiolipina y la mitoxantrona, la mitoxantrona podía insertarse en la bicapa de fosfolípidos mediante un modo de carga pasivo. Esta técnica de carga pasiva es diferente de la técnica de carga activa. En virtud de la técnica de carga activa, un fármaco se depositaría en la fase acuosa intraliposomal en forma de precipitación. En el estudio clínico de fase I sobre el producto de Neopharm se indicó que los fármacos liposómicos podían aumentar la posibilidad de infección ocasional en comparación con el fármaco libre. El desarrollo de este producto cesó en vista de la seguridad (Liposomal preparations of mitoxantrone, documento CN01817424.8) .
El Pacific Institute of Materia Medica (Changchou, China) también presentó una solicitud de patente para una preparación liposómica de mitoxantrona (A liposomal injection of mitoxantrone or mitoxantrone hydrochloride and the process for making the same, documento CN200410041612.1) . En esta solicitud se usó el procedimiento tradicional de gradiente por valor de pH para cargar los fármacos. Esta solicitud busca proteger una formulación con una proporción específica y no divulga los efectos de factores tales como la composición de los fosfolípidos, los tipos de sales tampón en la fase acuosa interna, el tamaño del liposoma, la proporción fármaco/liposoma etc. sobre la eficacia terapéutica y la toxicidad del liposoma.
Zhirong Zhang, y col. de la West China School of Pharmacy, Sichuan University, también estudiaron preparaciones liposómicas de mitoxantrona. Usaron fosfatidilcolina de soja con una temperatura de transición de fase de 0 ºC (que se comercializa con el nombre EPIKURON 200) para preparar liposomas de aproximadamente 60 nm. En este artículo solo se estudió la farmacocinética son la toxicidad asociada y la eficacia terapéutica de la preparación liposómica obtenida. Los contenidos relevantes se pueden ver en "Preparation of long circulating mitoxantrone liposomes and its pharmacokinetics", Zhirong Zhang, Botao Yu y Yisong Duan, Acta Pharmaceutica Sinica, 2002,
Vol. 37, Nº 6; Studies on preparation of long circulating mitoxantrone liposomes with transmembrane ammonium sulfate gradients, Zhirong Zhang, Botao Yu, Yisong Duan y Yuan Huang, Chinese Pharmaceutical Journal, 2002 Vol. 37, Nº 12; y Study on the preparation techniques of mitoxantrone liposomes, Yisong Duan, West China Journal of Pharmaceutical Sciences, 2001 Vol. 16, Nº 02.
En los estudios anteriores, normalmente se controla el tamaño de los liposomas en el intervalo de 80 ∼ 150 nm, ya que hay un consenso en el campo de los liposomas de que un liposoma con un tamaño de aproximadamente 100 nm tendría la mejor eficiencia en el objetivo (Pharmacol. Rev. 1999 51: 691-744.) . No obstante, como se ha mencionado en lo que antecede, un liposoma no solo debe tener una eficiencia por el objetivo excelente sino que también debe tener una liberación suficiente desde el liposoma para ejercer su efecto.
Como se ha indicado anteriormente, de acuerdo con el campo anterior, debería evitarse esencialmente la pérdida de fármaco durante la circulación en sangre de modo que el fármaco se pueda transferir con eficacia a los tumores, pero este requisito también da lugar a una dificultad para liberar el fármaco desde el liposoma cuando es dirigido a la región tumoral. En procedimientos convencionales para fabricación de liposomas, normalmente un fármaco se encapsula mediante una técnica de carga activa en la que el fármaco encapsulado en el liposoma está presente en forma de un precipitado coloidal que no tiene bioactividad, de modo que solo cuando el fármaco se libera del liposoma con eficacia puede convertirse en un fármaco terapéutico con bioactividad. Si la velocidad de liberación del fármaco es demasiado baja, el fármaco apenas podrá ejercer sus acciones terapéuticas aunque haya sido dirigido con eficacia a la región tumoral, y su efecto terapéutico puede ser incluso inferior al de un fármaco sin encapsular.
Por tanto, existe una urgente necesidad en el campo de una preparación liposómica capaz de liberar un fármaco con una buena capacidad de ser dirigido y liberar el fármaco en los tejidos objetivo con eficacia, y de una correspondiente preparación farmacéutica liposómica.
Sumario de la invención Sorprendentemente, los presentes inventores han encontrado, por casualidad, que la mitoxantrona que tiene una pluralidad de grupos disociables y una tendencia a formar un precipitado compacto con contrapones multivalentes podría procesarse para formar una pequeña preparación liposómica unilamelar con un índice terapéutico mejorado con eficacia, de modo que se podría resolver el problema técnico anterior.
Por tanto, en un aspecto, la presente invención proporciona un fármaco liposómico, en el que (1) el fármaco liposómico comprende mitoxantrona; (2) el liposoma... [Seguir leyendo]
Reivindicaciones:
1. Un fármaco liposómico, en el que (1) el fármaco liposómico comprende mitoxantrona; (2) el liposoma del fármaco liposómico tiene un tamaño d.
3. 80 nm; (3) la bicapa del liposoma comprende un fosfolípidos con una temperatura de transición de fase (Tm) superior a la temperatura corporal, de modo que la temperatura de transición de fase del liposoma es mayor que la temperatura corporal, la del colesterol y la de un lípido modificado con polímero hidrófilo; y
(4) la fase intraliposómica del liposoma comprende un contraion multivalente en la que el contraion multivalente es portador de dos o más cargas opuestas a la del ingrediente farmacológico activo, seleccionándose el contraion multivalente de un anión de ácido orgánico saturado o insaturado, un anión de ácido inorgánico o una forma iónica de un aminoácido, y en la que el ácido orgánico está seleccionado de ácido cítrico, ácido tartárico, ácido fumárico, ácido oxálico, ácido malónico, ácido succínico, ácido málico y ácido maleico; el ácido inorgánico está seleccionado del anión sulfato y el anión fosfato; el aminoácido está seleccionado de cisteína.
2. El fármaco liposómico de acuerdo con la reivindicación 1, en el que el tamaño del liposoma es 35 – 75 nm, preferentemente 40 – 70 nm, especialmente 40 – 60 nm.
3. El fármaco liposómico de acuerdo con la reivindicación 1 o 2, en el que el contraion multivalente es un anión citrato, anión sulfato o anión fosfato.
4. El fármaco liposómico de acuerdo con la reivindicación 3, en la que el contraion multivalente es un anión sulfato.
5. El fármaco liposómico de acuerdo con la reivindicación 1 o 2, caracterizado porque el fosfolípido con una temperatura de transición de fase (Tm) superior a la temperatura corporal en la bicapa fosfolipídica está seleccionado de fosfatidilcolina, fosfatidilcolina hidrogenada de soja, fosfatidilcolina de clara de huevo hidrogenada, dipalmitoil fosfatidilcolina, diestearoil fosfatidilcolina o cualquier combinación de los mismos.
6. El fármaco liposómico de acuerdo con la reivindicación 5, en el que la bicapa fosfolipídica comprende además un fosfolípidos con una temperatura de transición de fase Tm no superior a la temperatura corporal.
7. El fármaco liposómico de acuerdo con la reivindicación 1, en el que el fosfolípidos con una Tm superior a la temperatura corporal representa 50 – 100 mol/% mol, preferentemente 55 – 95 mol/% mol, más preferentemente 60
– 90 mol/% mol respecto al contenido total de los fosfolípidos en la bicapa fosfolipídica.
8. El fármaco liposómico de acuerdo con la reivindicación 1 o 2, en el que el contenido de colesterol es d.
2. 60 mol/mol %, preferentement.
5. 55 mol/mol %, especialment.
10. 50 mol/mol %, particularment.
15. 45 mol/mol %, más particularmente 20 – 40 mol/mol %, respecto al contenido total de los ingredientes en la bicapa fosfolipídica.
9. El fármaco liposómico de acuerdo con la reivindicación 1 o 2, en el que los lípidos modificados con polímeros hidrófilos están seleccionadosde diaestearoil fosfatidiletanolamina modificada con PEG (DSPE-PEG) , diaestearoil fosfatidilglicerol modificado con PEG (DSPG-PEG) , colesterol modificado con PEG (col-PEG) , diaestearoil fosfatidiletanolamina modificada con polividona (DSPE-PVP) , diaestearoil fosfatidilglicerol modificado con polividona (DSPG-PVP) , colesterol modificado con polividona (col-PVP) , o cualquier combinación de los mismos, en una cantidad de 0, 1 - 20 mol/% mol, preferentemente 0, 3 -18 mol/% mol, más preferentemente 0, 5 - 15 mol/% mol, incluso más preferentemente 0, 8 - 12 mol/% mol, más preferentement.
3. 6 mol/% mol respecto al contenido total de los fosfolípidos en la bicapa fosfolipídica.
10. El fármaco liposómico de acuerdo con la reivindicación 1, que comprende fosfatidilcolina de soja hidrogenada, colesterol y diestearoil fosfatidiletanolamina modificada con PEG en una proporción en peso de 3:1:1, en el que la diestearoil fosfatidiletanolamina modificada con PEG es, preferentemente, diestearoil fosfatidiletanolamina modificada con PEG2000.
11. El fármaco liposómico de acuerdo con la reivindicación 1, en el que la temperatura de transición de fase Tm del liposoma es superior a la temperatura corporal.
12. Un procedimiento para preparar el fármaco liposómico de acuerdo con una cualquiera de las reivindicaciones 1 a 11, que comprende las etapas siguientes: (1) preparar un liposoma con un tamaño d.
30. 80 nm usando un fosfolípidos con una Tm superior a la temperatura corporal, a la del colesterol y a la de un lípido modificado con polímero hidrófilo; y (2) encapsular la mitoxantrona y la fase intraliposómica del liposoma comprende un contraion multivalente.
13. Una preparación farmacéutica liposómica, que comprende el fármaco liposómico de acuerdo con una cualquiera de las reivindicaciones 1 a 11 y, opcionalmente, un vehículo y/o excipiente farmacéuticamente aceptable.
14. La preparación farmacéutica liposómica de acuerdo con la reivindicación 13, que además comprende una sal para alterar la presión osmótica, un agente tampón y/o un antioxidante.
15. El fármaco liposómico de acuerdo con una cualquiera de las reivindicaciones 1 – 11 o la preparación farmacéutica liposómica de acuerdo con una cualquiera de las reivindicaciones 13 – 14 para su uso en el tratamiento de un tumor en un paciente.
16. El fármaco liposómico o la preparación farmacéutica de acuerdo con la reivindicación 15, en el que el tratamiento comprende además tratar al paciente mediante termoterapia, preferentemente termoterapia radiactiva.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.