Células huésped mejoradas y métodos de cultivo.
Método de aumento de la producción de una glicoproteína de interés en una célula huésped aislada que se hamodificado por ingeniería genética para sobreexpresar dicha glicoproteína de interés,
comprendiendo dicho métodoaumentar en dicha célula huésped la expresión de alfa 1,2-manosidasa (MAN1C1) que es nativa para dicha célulahuésped.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/046443.
Solicitante: AMGEN INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE THOUSAND OAKS, CA 91320-1799 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CROWELL,CHRISTOPHER K.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/52 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican enzimas o proenzimas.
- C12N15/67 C12N 15/00 […] › Métodos generales para favorecer la expresión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N9/24 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos glicosílicos (3.2).
PDF original: ES-2434494_T3.pdf
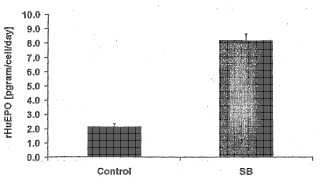
Fragmento de la descripción:
Células huésped mejoradas y métodos de cultivo Campo de la invención La invención se refiere a células huésped mejoradas y a métodos de cultivo que mejoran la producción de glicoproteínas.
Antecedentes de la invención Son altamente deseables métodos de aumento de la producción de proteína huésped recombinante en la industria farmacéutica y en el laboratorio de muchas maneras, incluyendo ahorros de costes, ahorros de tiempo y capacidad de fabricación. El tratamiento con butirato de sodio ha sido un método de aumento de la producción de proteína en cultivo celular en procedimientos biofarmacéuticos comerciales. Sin embargo, el beneficio derivado del aumento de los rendimientos de proteína algunas veces se compensa por los efectos secundarios tóxicos del butirato de sodio.
El butirato de sodio es un ácido graso de cadena corta que inhibe la enzima histona desacetilasa (HDAC) responsable del mantenimiento de la estructura de la cromatina en el núcleo de las células (Davie, J. Nutrition 133: 2485S-2493S, 2003) . La pérdida de actividad da como resultado una alteración en la regulación transcripcional de genes a través del proceso de acetilación y desacetilación normal de las histonas (Prasad et al., In Vitro 12: 125-132, 1976) . Se ha mostrado que el cambio en la regulación transcripcional aumenta la productividad específica de líneas celulares que producen proteínas recombinantes in vitro. Por ejemplo, se ha mostrado que el butirato de sodio aumenta la síntesis de hormona foliculoestimulante (FSH) recombinante secretada, activador del plasminógeno tisular (tPA) , eritropoyetina (EPO) y trombopoyetina (TPO) en células de ovario de hámster chino (CHO) (Sung et al.,
J. Biotechnology 112: 323-335, 2004; Hendrick et al. Cytotechnology 36: 71-83, 2001; Chung et al., J. Microbiol. Biotechnol. 11, 1087-1092, 2001; Chotigeat et al., Cytotechnology 15: 217-221, 1994; Chang et al., Free Radical Research 30: 85-91, 1999) . No está claro el mecanismo preciso responsable de estos aumentos. Se ha mostrado que el tratamiento con butirato de sodio aumenta transitoriamente los niveles de ARNm para proteína recombinante, dando como resultado aumentos en la biosíntesis de proteínas resultante (Yuan et al., J. Biol. Chem. 260: 37783783, 1985) .
Se han estudiado previamente los cambios en la expresión génica provocados por el butirato de sodio en líneas celulares implicadas en la investigación del cáncer de colon. Los estudios demostraron que el butirato de sodio altera la expresión de múltiples genes implicados en la progresión del ciclo celular, diferenciación, señalización por citocinas y apoptosis. Sin embargo, tales estudios se limitaban a un subconjunto relativamente pequeño de genes y no determinaron si los genes estaban implicados en la biosíntesis de proteínas. (Joseph et al., Oncogene 23: 63046315, 2004; Tabuchi et al., Biochem. Biophys. Research Comm. 293: 1287-1294, 2002; Iacomino et al., Biochem. Biophys. Research Comm. 285: 1280-1289, 2001; Mariadason et al., Cancer Res. 60: 4561-4572, 2000; Della Ragione et al., FEBS Letters 499, 199-204, 2001) .
La enzima alfa 1, 2 manosidasa I (MAN1C1) es una enzima implicada en el procesamiento de oligosacáridos unidos en N a glicoproteínas que se ha descrito en Tremblay et al. (Glycobiology 8: 585-595, 1998) y Gonzalez et al. (J. Biol. Chem. 274: 21375-21386, 1999) . La enzima cataliza la primera etapa de recorte de la manosa asociada con el procesamiento de estructuras oligosacáridas con alto contenido en manosa eliminando un azúcar manosa terminal del oligosacárido. La glicosilación N-terminal implica la adición y eliminación de diversos azúcares de monosacáridos en los compartimentos de tanto el retículo endoplasmático (RE) como el aparato de Golgi (Kornfeld et al., Ann. Rev. Biochem. 54: 631-664, 1985) . En el RE, la glicosilación unida a N va acompañada por el plegamiento de las glicoproteínas nacientes para dar su estructura nativa a través de interacciones con chaperonas moleculares (Ellgaard et al., Science 286: 1882-1888, 1999; Jakob et al., J. Cell Biol. 142: 1223-1233, 1998) . Este proceso se ha denominado control de calidad del RE, y si se bloquea el proceso debido a una proteína mal plegada, normalmente se produce el comienzo de la degradación asociada al RE, o ERAD, de la proteína (Ellgaard et al., Curr. Opin. Cell Biol. 13: 431-437, 2001; Sifers, Science 299: 1330-1331, 2003; Oda et al., Science 299: 1394-1397, 2003; Molinari et al., Science 299: 1397-1400, 2003; Hurtley et al., Ann. Rev. Cell Biol. 5: 277-307, 1989) . Se ha mostrado que la eliminación de un azúcar manosa terminal desde Man9 hasta Man8 por la enzima alfa 1, 2 manosidasa I (MAN1C1) afecta al comienzo de la respuesta de ERAD (Liu et al., J. Biol. Chem. 274: 5861-5867, 1999; Grinna et al. J. Biol. Chem. 255, 2255-2258, 1980) .
En vista de la toxicidad de inductores de la producción de proteína tales como butirato de sodio, existe una necesidad de otros medios de aumento de la producción global de proteínas recombinantes en cultivo celular.
El documento WO 00/65070 A2 da a conocer un método para producir una glicoproteína en el que se cultivan células huésped que expresan dicha glicoproteína en presencia de un factor que modifica el estado de crecimiento en un cultivo celular, un catión de metal divalente o un componente plasmático. Se sugiere que las células huésped
deben expresar también enzimas que proporcionan las reacciones de modificación postraduccional apropiadas, entre otras alfa-1, 2-manosidasa.
En el documento WO 2004/081201 A1, se da a conocer la expresión de una glucosidasa II mutante en combinación con alfa-1, 2-manosidasa en Trichoderma reesei. La expresión de la glucosidasa II mutante aumenta la secreción de proteínas en las células. La expresión simultánea de alfa-1, 2-manosidasa pretende proporcionar un perfil de glicosilación de tipo humano.
Ninguno de estos documentos da a conocer o sugiere que la sobreexpresión de alfa-1, 2-manosidasa en una célula huésped aumente eficazmente la cantidad de una glicoproteína que se produce en dicha célula huésped.
Sumario de la invención La presente invención se refiere a un método de aumento de la producción de una glicoproteína de interés en una célula huésped aislada que se ha modificado por ingeniería genética para sobreexpresar dicha glicoproteína de interés, comprendiendo dicho método aumentar en dicha célula huésped la expresión de alfa 1, 2-manosidasa (MAN1C1) que es nativa para dicha célula huésped.
En una realización preferida de la invención, la célula huésped usada en el método de la invención se transfecta con un vector que comprende un ácido nucleico que codifica para MAN1C1 operativamente unido a una secuencia de control de la expresión heteróloga. En otra realización preferida, la célula huésped comprende una secuencia de control de la expresión heteróloga que está operativamente unida a un ácido nucleico que codifica para MAN1C1.
En una realización preferida adicional, la célula huésped se ha transfectado con un vector que comprende un ácido nucleico que codifica para dicha glicoproteína de interés operativamente unido a una secuencia de control de la expresión heteróloga. En otra realización preferida, la célula huésped comprende una secuencia de control de la expresión heteróloga operativamente unida a un ácido nucleico que codifica para dicha glicoproteína de interés.
El método de la invención puede usarse para producir cualquier glicoproteína o proteína de interés. Preferiblemente, la glicoproteína es una molécula estimulante de la eritropoyesis, tal como eritropoyetina o darbepoetina, o análogos, variantes o derivados de la misma. En una realización preferida de la invención, la glicoproteína es la eritropoyetina de SEQ ID NO:3 o la darbepoetina de SEQ ID NO:5.
En una realización preferida adicional de la invención, la célula huésped es una célula CHO, una célula humana, una célula BHK, una célula NS/0 o una célula HT-1080.
La presente invención puede usar células huésped modificadas por ingeniería genética para sobreexpresar alfa 1, 2 manosidasa (MAN1C1) y una glicoproteína o proteína de interés. Tales células huésped pueden comprender una secuencia de control de la expresión heteróloga operativamente unida a un ácido nucleico que codifica para MAN1C1, y una secuencia de control de la expresión heteróloga operativamente unida a un ácido nucleico que codifica para tal glicoproteína. La células huésped pueden modificarse por ingeniería genética para sobreexpresar cualquiera de o tanto MAN1C1 como la glicoproteína de interés mediante cualquier medio conocido en la técnica, incluyendo transfección con un... [Seguir leyendo]
Reivindicaciones:
1. Método de aumento de la producción de una glicoproteína de interés en una célula huésped aislada que se ha modificado por ingeniería genética para sobreexpresar dicha glicoproteína de interés, comprendiendo dicho método aumentar en dicha célula huésped la expresión de alfa 1, 2-manosidasa (MAN1C1) que es nativa para dicha célula huésped.
2. Método según la reivindicación 1, en el que dicha célula huésped se transfecta con un vector que comprende un ácido nucleico que codifica para MAN1C1 operativamente unido a una secuencia de control de la expresión heteróloga.
3. Método según la reivindicación 1, en el que dicha célula huésped comprende una secuencia de control de la 10 expresión heteróloga operativamente unida a un ácido nucleico que codifica para MAN1C1.
4. Método según cualquiera de las reivindicaciones 1-3, en el que dicha célula huésped se ha transfectado con un vector que comprende un ácido nucleico que codifica para dicha glicoproteína de interés operativamente unida a una secuencia de control de la expresión heteróloga.
5. Método según cualquiera de las reivindicaciones 1-3, en el que dicha célula huésped comprende una secuencia
de control de la expresión heteróloga operativamente unida a un ácido nucleico que codifica para dicha glicoproteína de interés.
6. Método según cualquiera de las reivindicaciones 1-5, en el que la glicoproteína de interés es una molécula estimulante de la eritropoyesis.
7. Método según la reivindicación 6, en el que la glicoproteína de interés es eritropoyetina de SEQ ID NO: 3.
8. Método según la reivindicación 6, en el que la glicoproteína de interés es darbepoetina de SEQ ID NO: 5.
9. Método según cualquiera de las reivindicaciones 1-8, en el que dicha célula huésped es una célula CHO.
10. Método según cualquiera de las reivindicaciones 1-8, en el que dicha célula huésped es una célula humana.
11. Método según cualquiera de las reivindicaciones 1-8, en el que dicha célula huésped es una célula BHK.
12. Método según cualquiera de las reivindicaciones 1-8, en el que dicha célula huésped es una célula NS/0. 25 13. Método según cualquiera de las reivindicaciones 1-8, en el que dicha célula huésped es una célula HT-1080.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]