Anticuerpos inhibidores que se unen al complejo del activador del plasminógeno tipo uroquinasa (uPA y su receptor (uPAR).
Anticuerpo monoclonal o fragmento de unión al antígeno del mismo,
que incluye:
(a) una cadena VL que comprende tres CDRs que tienen las secuencias de aminoácidos respectivas SEQ IDnº: 3, SEQ ID nº: 4 y SEQ ID nº: 5 y
(b) una cadena VH que comprende tres CDRs que tienen las secuencias de aminoácidos respectivas SEQ IDnº: 6, SEQ ID nº: 7 y SEQ ID nº: 8;
donde el anticuerpo o fragmento de unión al antígeno del mismo tiene la propiedad de unirse con uPAR.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/018322.
Solicitante: Tactic Pharma, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1007 Church Street, Suite 307 Evanston 60201 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MAZAR, ANDREW, P., PARRY,GRAHAM C.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
PDF original: ES-2398221_T3.pdf
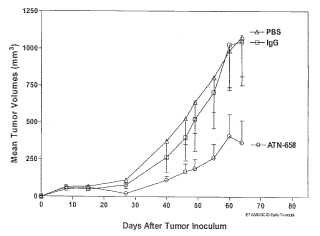
Fragmento de la descripción:
Anticuerpos inhibidores que se unen al complejo del activador del plasminógeno tipo uroquinasa (uPA y su receptor (uPAR)
Antecedentes de la invención Campo de la invención [0001] La presente invención, en el campo de la bioquímica, la inmunología y la medicina, se refiere a anticuerpos ("Abs") u otros ligandos específicos para (a) los complejos binarios uPA-uPAR, (b) los complejos ternarios incluyendo uPA-uPAR y (c) los complejos de uPAR y proteínas que no sean uPA, tales como integrinas. Estos ligandos Abs o no Ab inhiben la interacción de uPA y uPAR con moléculas adicionales con las que los complejos anteriores interactúan. Tales ligandos Abs u otros no Ab se usan en métodos de diagnóstico y terapéuticos, particularmente contra el cáncer.
Descripción del estado de la técnica [0002] Un cuerpo significativo de evidencia a partir de estudios in vitro e in vivo ha establecido que el sistema del activador del plasminógeno de uroquinasa (uPA) es fundamental para el proceso de metástasis, haciéndolo un objetivo prometedor para el desarrollo de fármacos contra el cáncer (Mazar, AP et al. (1999) Angiogenesis 3: 15-32) . Además de uPA, su receptor de superficie de célula (uPAR) es un objetivo adecuado para el diseño y desarrollo de agentes de diagnóstico y terapéuticos del cáncer (Mazar, AP (2001) Anti- Cancer Drugs 12: 397-400) porque:
(a) uPAR se expresa selectivamente en células tumorales metastásicas y células endoteliales angiogénicas ("ECs") , pero no en otras células;
(b) uPAR es un participante importante en diferentes recorridos intracelulares y extracelulares requeridos para la metástasis que son actualmente el objetivo de intensos esfuerzos de desarrollo de fármacos; y
(c) es posible interferir en diferentes puntos a lo largo del recorrido uPA.
Así, uPA y uPAR son objetivos prometedores para el desarrollo de diagnósticos y tratamientos útiles contra diferentes tipos de tumores/cánceres.
El sistema uPA/uPAR y el cáncer
La metástasis y la angiogénesis comparten muchas características funcionales comunes que caracterizan los procesos invasivos y migratorios de las células tumorales y ECs. Estas características incluyen (1) la sobreregulación de proteasa y la expresión de integrina, (2) la pérdida de los contactos célula-célula y célula-matriz, (3) la receptividad aumentada para el crecimiento y los factores de diferenciación, y (4) la remodelación de la matriz extracelular (ECM) y la membrana basal (BasM) . Todos esto contribuye a la progresión tumoral.
El "sistema" uPA, que incluye la serina proteasa uPA, su receptor uPAR y su inhibidor de serpina específico, activador plasminógeno tipo inhibidor 1 (PAI-1) , desempeña un papel fundamental en muchas de estas actividades. La actividad de este sistema es responsable de:
(1) el inicio de cataratas que provocan la activación de plasminógeno activando diferentes pro-metaloproteasas (proMMPs) ,
(2) la liberación y el procesamiento de factores de crecimiento latente tales como factor-2 de crecimiento de fibroblasto (FGF-2) , factor de crecimiento endotelial vascular (VEGF) , factor de crecimiento de hepatocito (HGF) , y factor-r de crecimiento de transformación (TGFr) ,
(3) (a) las interacciones con componentes del ECM tales como vitronectina (Vn) y fibronectina (Fn) ; (b) las interacciones directas con diferentes integrinas incluidas a5r1 y avr3, y (c) la remodelación de BasM y ECM para promover la motilidad celular.
Además, el sistema uPA puede también iniciar la producción de fibrina localizada que puede desempeñar un papel en la angiogénesis.
La expresión de uPA y uPAR se ha demostrado en numerosos tipos de tumores, incluyendo glioblastoma, carcinoma de próstata, pecho, colon, hepatocelular y de células renales. (Mizukami IF et al. (1994) Clin Immunol and Immunopathol 71:96-104; Hsu DW et al., (1995) Am J Pathol 147:114-23; de Witte JH et al. (1999) Br J Cancer 79:11908) . La expresión de uPA y uPAR es típicamente superior en formas más agresivas de la enfermedad. En células tumorales, esta expresión suele ser superior en el frente invasivo del tumor. (Buo, L et al., (1995) Human Pathol 26:1133-1138; Yamamoto M et al. (1994) Cancer Res 54:5016-5020) . La fuerte coloración immunohistoquímica de uPAR en los vasos sanguíneos asociada al frente invasivo de carcinomas celulares de pecho, colon y renales se ha dado a conocer (Bastholm L et al. Appl Immunohistochem Mol Morphol 7: 39-47; Nakata S et al. (1998) Int. J. Cancer 79:179-186) . En el estudio del carcinoma de colon, uPAR se colocalizó con VEGF. La expresión de uPA y uPAR también se ha observado en macrófagos asociados a tumores en diferentes tipos de tumores (Ohtani H et al. (1995) Int J Cancer 62:691-6; Xu Y et al. (1997) Hum Pathol 28:206- 13) . El uPA es quimiotáctico para monocitos y media tanto la adhesión como la migración de estas células. La adhesión y la migración requieren sólo la ocupación de uPAR pero no la actividad catalítica de uPA. Así, el sistema uPA se cree que contribuye a la progresión tumoral actuando en múltiples tipos de célula asociada a tumores.
Varios estudios recientes han evaluado el potencial terapéutico de la inhibición de la unión de uPA a uPAR en sistemas singénicos. La entrega de un fragmento aminoterminal murino codificado por adenovirus de uPA (abreviado "ATF" por sus siglas en inglés - este es el dominio de uPA que contiene la región de unión a uPAR) directamente en tumores dio como resultado (a) la supresión de la neovascularización y (b) la detención del crecimiento tumoral (Li H et al. (1998) Gene Ther 5:1105-1113) . Debido a la "especificidad" de especies, el ATF murino se esperaría que sólo se enlazara a ECs huéspedes murinas y leucocitos, no a células tumorales humanas. Esto indica que la inhibición tumoral se medió a través de la supresión de la respuesta angiogénica huésped. Finalmente, un estudio colaborativo entre algunos de los presentes inventores y S. Rabbani y J. Gladu ha demostrado recientemente que un Ab policlonal se puso en contra de un fragmento de 100-residuos de uPAR de rata selectivamente localizado para un tumor de pecho de rata que creció a partir de células de la línea celular de Mat BIII (Rabbani SA et al. (2002) Cancer Res 62:2390-97) . Este anticuerpo policlonal inhibió completamente el crecimiento del tumor y llevó a la regresión tumoral.
Luther et al. describen anticuerpos monoclonales contra uPAR para el análisis de la expresión de antígeno de uPAR en tumores humanos malignos por métodos inmunológicos (Luther et al. (1997) Am. J. Pathol. 150:1231-1244) . Específicamente, Luther et al. divulga el anticuerpo monoclonal IIIB11 que se enlaza a residuos de aminoácidos 125132 de dominio II de uPAR.
Rabbani y Gladu ([2002] Cancer Research 62:2390-2397) revelan la capacidad de un anticuerpo policlonal contra el dominio de NH2-terminal enlazando ligandos de rata uPAR para reducir el volumen tumoral en ratones.
Desafortunadamente, a pesar de la promesa de enfocar el sistema uPA para propósitos terapéuticos y de diagnóstico, los esfuerzos de investigación no han dado como resultado el desarrollo de agentes adecuados para la clínica. Los accesos a moléculas pequeñas se han visto obstaculizados por (1) la dificultad de inhibir potentemente una interacción de proteína-proteína (p. ej., uPA-uPAR o uPAR-integrina) , y (2) la falta de direcciones adecuadas o información estructural susceptible de esfuerzos de química medicinal. Diferentes inhibidores de péptido potentes de la interacción uPA-uPAR se han identificado pero estos padecerían las propiedades farmacológicas típicamente pobres de los péptidos y no han demostrado los niveles de actividad requeridos ni en ensayos basados en células (Ploug M et al. (2001) Biochemistr y 40:12157-68) .
Resumen de la invención [0010] Los presentes inventores produjeron un conjunto de anticuerpos monoclonales (mAbs) que enlazan con complejos uPA-uPAR y que inhiben su interacción con objetivos aguas abajo tales como integrinas. Tal inhibición se espera que inhiba el crecimiento tumoral y la metástasis. Estos mAbs pueden tener utilidad como anticuerpos "desnudos" así como para agentes terapéuticos de reconocimiento y agentes de formación de imágenes para tumores. Diferentes anticuerpos que apuntan a uPAR son eficaces en modelos animales de crecimiento canceroso (el modelo de cáncer ovárico A2780 y el modelo de cáncer pulmonar A549) . Los epítopos reconocidos por estos mAbs son regiones peptídicas dentro de uPAR. Por lo tanto, los péptidos uPAR correspondientes a estas regiones o derivados de ellas son útiles como antagonistas de interacciones uPAR con proteínas aguas abajo.
Es habitual... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo monoclonal o fragmento de unión al antígeno del mismo, que incluye:
(a) una cadena VL que comprende tres CDRs que tienen las secuencias de aminoácidos respectivas SEQ ID nº: 3, SEQ ID nº: 4 y SEQ ID nº: 5 y
(b) una cadena VH que comprende tres CDRs que tienen las secuencias de aminoácidos respectivas SEQ ID nº: 6, SEQ ID nº: 7 y SEQ ID nº: 8;
donde el anticuerpo o fragmento de unión al antígeno del mismo tiene la propiedad de unirse con uPAR
2. Anticuerpo monoclonal o fragmento de unión al antígeno del mismo según la reivindicación 1, donde el anticuerpo o fragmento de unión al antígeno del mismo tiene la propiedad de unirse con uPAR sin inhibición de la unión de uPA. 15
3. Anticuerpo monoclonal purificado o fragmento de unión al antígeno del mismo según la reivindicación 1 o la reivindicación 2 que comprende una cadena VL que tiene la secuencia SEQ ID nº: 1 y una cadena VH que tiene la secuencia SEQ ID nº: 2.
(a) marcado de manera diagnósticamente detectable, o
(b) marcado, conjugado o fusionado con una fracción terapéuticamente activa, que hace a dicho anticuerpo 25 terapéuticamente activo.
5. Composición de diagnóstico que incluye:
(a) el anticuerpo marcado según la reivindicación 4 (a) ; y 30
(b) un portador diagnósticamente aceptable.
6. Composición según la reivindicación 5 donde el anticuerpo se marca con un radionucleido, un agente imprimible en PET, un agente imprimible en MRI, un agente fluorescente, un fluorógeno, un cromóforo, un cromógeno, un fosforizador, 35 un quimioluminiszador o un bioluminiszador.
7. Composición según la reivindicación 6, donde el marcador es un radionucleido seleccionado del grupo que consiste 3 I, 125I, 169
en H, 14C, 35S, 67Ga, 68Ga, 22As, 89Zr, 97Ru, 99TC, 111In, 123I, 131Yb y 201Tl.
8. Composición según la reivindicación 6 donde el marcador es un agente fluorescente o fluorógeno seleccionado del grupo que consiste en fluoresceína, rodamina, dansilo, ficoeritrina, ficocianina, aloficocianina, o-ftaldehído, fluorescamina, un derivado de fluoresceína, verde de Oregón, verde de rodamina, verde de rodol y rojo de Texas.
9. Composición farmacéutica terapéutica antiangiogénica o anti-tumoral que incluye: 45
(a) una cantidad eficaz del anticuerpo terapéuticamente activo según la reivindicación 4 (b) ; y
(b) un portador farmacéuticamente aceptable. 50 10. Composición farmacéutica terapéutica según la reivindicación 9 en una forma adecuada para la inyección.
11. Composición farmacéutica terapéutica según la reivindicación 9 donde la fracción terapéuticamente activa se conjuga directamente o se enlaza indirectamente con el anticuerpo.
12. Composición farmacéutica terapéutica según la reivindicación 9 donde la fracción terapéuticamente activa es un fármaco quimioterapéutico, una toxina o un radionucleido terapéutico.
13. Composición farmacéutica terapéutica según la reivindicación 9 donde una fracción terapéuticamente activa es un péptido o polipéptido, tal como una toxina, fusionada con dicho anticuerpo. 60
14. Anticuerpo terapéuticamente activo según la reivindicación 4 (b) para su uso como medicamento.
15. Anticuerpo terapéuticamente activo según la reivindicación 4 (b) para su uso en el tratamiento de un sujeto que tiene
una enfermedad, trastorno o condición caracterizada por angiogénesis indeseada, crecimiento tumoral y/o metástasis 65 tumoral.
16. Uso de un anticuerpo terapéuticamente activo según la reivindicación 4 (b) para la producción de un medicamento para su uso en el tratamiento de un sujeto con una enfermedad, trastorno o condición caracterizada por angiogénesis indeseada, crecimiento tumoral y/o metástasis tumoral.
17. Anticuerpo terapéuticamente activo para su uso según la reivindicación 14 o 15 o un uso según la reivindicación 16, donde la fracción terapéuticamente activa se conjuga directamente o se enlaza indirectamente con el anticuerpo.
18. Anticuerpo terapéuticamente activo para su uso o un uso según cualquiera de las reivindicacione.
14. 17, donde la fracción terapéuticamente activa es un fármaco quimioterapéutico, una toxina o un radionucleido terapéutico. 10
19. Anticuerpo terapéuticamente activo para su uso o un uso según cualquiera de las reivindicacione.
14. 18, donde la fracción terapéuticamente activa es un péptido o polipéptido, tal como una toxina, fusionada con dicho anticuerpo.
20. Método in vitro para inhibir la migración celular, invasión celular, proliferación celular o angiogénesis, o para inducir
apoptosis, incluyendo la puesta en contacto de células asociadas a la migración, invasión, proliferación o angiogénesis celular indeseada con una cantidad eficaz de un anticuerpo según cualquiera de las reivindicaciones 1 - 3 o 4 (b) .
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]