Amidas de péptidos sintéticos.
Una amida de péptido sintético de la fórmula:
Xaa1Xaa2Xaa3Xaa4-W-Y Z
R1-(V)e-R2
o un estereoisómero,
mezcla de estereoisómeros, sal farmacéuticamente aceptable, hidrato, solvato, hidrato desal de ácido, N-óxido de una amida de péptido sintético que contiene una amina donde el átomo de nitrógeno dela amina está unido a un átomo de oxígeno, o forma isomórfica cristalina de ésta;
donde
Xaa1 se selecciona del grupo que consiste en (A)(A')D-Phe, (A)(A')(β-Me)D-Phe, D-Tyr, D-Tic, D-tert-leucina, Dneopentilglicina,
D-fenilglicina, D-homofenilalanina y ß-(E)D-Ala, donde cada (A) y cada (A') son sustituyentes de anillo
fenilo seleccionados de forma independiente del grupo que consiste en -H, -F, -Cl, -NO2, -CH3, -CF3, -CN y -CONH2, ydonde cada (E) se selecciona de forma independiente del grupo que consiste en ciclobutilo, ciclopentilo, ciclohexilo,piridilo, tienilo y tiazolilo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/023858.
Solicitante: CARA THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 PARROTT DRIVE SHELTON, CT 06484 ESTADOS UNIDOS DE AMERICA.
Inventor/es: JIANG, GUANGCHENG, CHALMERS, DEREK, T., SCHTEINGART, CLAUDIO, D., MENZAGHI,FREDERIQUE, ALEXANDER,ROBERTA VEZZA, SUEIRAS-DIAZ,JAVIER, SPENCER,ROBERT H, LUO,ZHIYONG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/07 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Tetrapéptidos.
- A61K38/08 A61K 38/00 […] › Péptidos que tienen de 5 a 11 aminoácidos.
- C07K5/107 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 5/00 Péptidos con hasta cuatro aminoácidos en una secuencia totalmente determinada; Sus derivados. › la cadena lateral del primer aminoácido contiene carbociclos, p. ej. Phe, Tyr.
- C07K7/02 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › Péptidos lineales que contienen al menos un enlace peptídico anormal.
PDF original: ES-2394377_T3.pdf
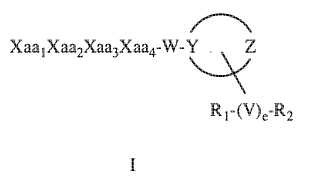
Fragmento de la descripción:
Amidas de péptidos sintéticos.
CAMPO DE LA INVENCIÓN
La invención se refiere a amidas de péptidos sintéticos que incorporan D-aminoácidos en la cadena peptídica y, más concretamente, a tales amidas de péptidos sintéticos que son agonistas de receptores opioides kappa y a su uso como agentes profilácticos y terapéuticos.
FUNDAMENTOS
Los receptores opioides kappa han sido propuestos como objetivos a intervenir para el tratamiento o prevención de una gran variedad de enfermedades y afecciones mediante la administración de agonistas de receptores opioides kappa. Véanse, por ejemplo, Jolivalt et al., Diabetologia, 49 (11) :2775-85; Epub agosto. 19 de 2006) , que describe la eficacia de la asimadolina, un agonista de receptores kappa, en la neuropatía diabética en roedores; y Bileviciute-Ljungar et al., Eur.
J. Pharm. 494:139-46 (2004) que describe la eficacia del agonista kappa U-50, 488 en el modelo de dolor neuropático de la lesión constrictiva crónica (CCI, por sus siglas en inglés) en ratas y el bloqueo de sus efectos por parte del antagonista opioide, naloxona. Estos estudios respaldan el uso de agonistas de receptores opioides kappa para el tratamiento del dolor neuropático diabético, viral e inducido por quimioterapia. También ha sido examinado el uso de agonistas de receptores kappa para el tratamiento o prevención del dolor visceral, incluidas afecciones ginecológicas tales como calambres menstruales dolorosos y endometriosis. Véase, por ejemplo, Riviere, Br. J. Pharmacol. 141:1331-4 (2004) .
Los agonistas de receptores opioides kappa también se han propuesto para el tratamiento del dolor, incluida la hiperalgesia. Se cree que la hiperalgesia se debe a cambios en el entorno de la terminal sensorial periférica que se producen tras una lesión tisular local. La lesión y la inflamación tisular (p. ej., abrasiones y quemaduras) pueden producir aumentos significativos en la excitabilidad de los nociceptores polimodales (fibras C) y en los mecanorreceptores de alto umbral (Handwerker et al. (1991) Proceeding of the VIth World Congress on Pain, Bond et al., eds., Elsevier Science Publishers BV, págs. 59-70; Schaible et al. (1993) Pain 55:5-54) . Se cree que la hiperalgesia subyace tras este aumento de excitabilidad y tras las respuestas exageradas de los aferentes sensoriales, donde la respuesta al dolor es el resultado de una respuesta exagerada a un estímulo. Se ha demostrado reiteradamente la importancia del estado hiperalgésico en el estado de dolor poslesión y parece ser responsable de una proporción mayoritaria del estado de dolor poslesión/inflamatorio. Véase, por ejemplo, Woold et al. (1993) Anesthesia and Analgesia 77:362-79; Dubner et al. (1994) En, Textbook of Pain, Melzack et al., eds., Churchill-Livingstone, Londres, págs. 225-242.
Se han propuesto los receptores opioides Kappa como objetivos para la prevención y tratamiento de enfermedades cardiovasculares. Véase, por ejemplo, Wu et al. “Cardioprotection of Preconditioning by Metabolic Inhibition in the Rat Ventricular Myocyte – Involvement of kappa Opioid Receptor” (1999) Circulation Res vol. 84: págs. 1388-1395. Véase también Yu et al. “Anti-Arr y thmic Effect of kappa Opioid Receptor Stimulation in the Perfused Rat Heart: Involvement of a cAMP-Dependent Pathway” (1999) J Mol Cell Cardiol. vol. 31 (10) : págs. 1809-1819.
También se ha descubierto que se puede prevenir el desarrollo o evolución de estas enfermedades y afecciones relacionadas con la neurodegeneración o con la muerte de células neuronales, o al menos se puede ralentizar, mediante el tratamiento con agonistas de receptores opioides kappa. Se cree que esta mejora se debe a la neuroprotección por parte de agonistas de receptores opioides kappa. Véase, por ejemplo, Kaushik et al. “Neuroprotection in Glaucoma” (2003) J. Postgraduate Medicine vol. 49 (1) : págs. 90-95.
Se ha relacionado la presencia de receptores opioides kappa en células inmunitarias (Bidlak et al., (2000) Clin. Diag. Lab. Immunol. 7 (5) :719-723) con la acción inhibitoria de un agonista de receptores opioides kappa, que se ha demostrado suprime la expresión de VIH-1. Véanse Peterson PK et al., Biochem Pharmacol. 2001, 61 (19) :1145-51.
Walker, Adv. Exp. Med. Biol. 521:148-60 (2003) evalúa las propiedades antiinflamatorias de agonistas kappa para el tratamiento de la osteoartritis, artritis reumatoide, enfermedad intestinal inflamatoria y eczema. Bileviciute-Ljungar et al., Rheumatology 45:295-302 (2006) describe la reducción del dolor y de la degeneración en la artritis inducida por el adyuvante de Freund por parte del agonista kappa U-50, 488.
Wikstrom et al., J. Am. Soc. Nephrol. 16:3742-7 (2005) describe el uso de un agonista kappa, TRK-820, para el tratamiento del prurito urémico e inducido por opiáceos, y Ko et al., J. Pharmacol. Exp. Ther. 305:173-9 (2003) describe la eficacia de U-50, 488 en el purito inducido por morfina en simios.
También se ha examinado de forma exhaustiva la aplicación de opioides periféricos, incluidos los agonistas kappa, para el tratamiento de enfermedades gastrointestinales. Véase, por ejemplo, Lembo, Diges. Dis. 24:91-8 (2006) para una discusión sobre el uso de opioides en el tratamiento de trastornos digestivos, incluido el síndrome del intestino irritable (SII) , íleo y dispepsia funcional.
Se ha demostrado que los trastornos oftalmológicos, incluida la inflamación ocular y el glaucoma, son tratables con opioides kappa. Véase Potter et al., J. Pharmacol. Exp. Ther. 309:548-53 (2004) , que describe la función del potente agonista de receptores opioides kappa, bremazocina, en la reducción de la presión intraocular y el bloqueo de este efecto
por parte de la norbinaltorfimina (norBNI) , el antagonista de receptores opioides kappa prototípico; y Dortch-Carnes et al., CNS Drug Rev. 11 (2) :195-212 (2005) . La patente de EE. UU. 6 191 126 de Gamache divulga el uso de agonistas opioides kappa para tratar el dolor ocular. También se ha demostrado que el dolor óptico es tratable mediante la administración de agonistas opioides kappa. Véase la patente de EE. UU. 6 174 878 que también es de Gamache.
Los agonistas opioides kappa aumentan la excreción renal de agua y disminuye la excreción urinaria de sodio (es decir, producen una diuresis selectiva de agua, que también se conoce como acuaresis) . Muchos investigadores, pero no todos, atribuyen este efecto a una supresión de la secreción de vasopresina de la pituitaria. Estudios que comparan opioides kappa supuestamente selectivos periféricamente y que actúan de forma central han concluido que los receptores opioides kappa del interior de la barrera hematoencefálica son los responsables de mediar este efecto. Otros investigadores han propuesto tratar la hiponatremia con péptidos nociceptina o conjugados peptídicos cargados que actúan periféricamente sobre el receptor de nociceptina, que está relacionado pero es diferente del receptor opioide kappa (D. R. Kapusta, Life Sci., 60:15-21, 1997) (patente de EE. UU. N.º 5 840 696) . Solicitud de patente de EE. UU. 20060052284. WO993251 describe antagonistas del KOR con una estructura química relacionada p. ej., H-D-Phe-D-PheD-Nle-D-Arg-piperazinilo.
RESUMEN DE LA INVENCIÓN
La presente invención estipula amidas de péptidos sintéticos que poseen la fórmula de la Fórmula I siguiente y estereoisómeros, mezclas de estereoisómeros, sales farmacéuticamente aceptables, hidratos, solvatos, hidratos de sales de ácidos, N-óxidos y formas cristalinas isomórficas de las amidas de péptidos sintéticos de la Fórmula I:
Xaa1Xaa2Xaa3Xaa4-W-Y Z
R1- (V) e-R2
Fórmula I
En la Fórmula I, Xaa1 representa un aminoácido N-terminal que puede ser cualquiera de: (A) (A’) D-Phe, (A) (A’) (a-Me) D-Phe, D-Tyr, ácido D-1, 2, 3, 4-tetrahidroisoquinolina-3-carboxílico, D-tert-leucina, D-neopentilglicina, D-fenilglicina, D-homofenilalanina o º (E) D-Ala, donde cada (A) y cada (A’) son sustituyentes de anillo fenilo elegidos de forma independiente entre -H, -F, -Cl, -NO2, -CH3, -CF3, -CN y -CONH2, y donde cada (E) se elige de forma independiente entre los siguientes sustituyentes: ciclobutilo, ciclopentilo, ciclohexilo, piridilo, tienilo y tiazolilo.
Xaa2 es un segundo aminoácido que puede ser cualquiera de (A) (A’) D-Phe, 3, 4-dicloro-D-Phe, (A) (A’) (a-Me) D-Phe, D-1naftilalanina, D-2-naftilalanina, D-Tyr, (E) D-Ala o D-Trp; donde (A) , (A’) y (E) se eligen cada uno de forma independiente entre los sustituyentes enumerados anteriormente para cada uno de (A) , (A’) y (E) .
Xaa3 es un tercer aminoácido que puede ser cualquiera de D-norleucina, D-Phe,... [Seguir leyendo]
Reivindicaciones:
1. Una amida de péptido sintético de la fórmula:
Xaa1Xaa2Xaa3Xaa4-W-Y
R1- (V) e-R2
o un estereoisómero, mezcla de estereoisómeros, sal farmacéuticamente aceptable, hidrato, solvato, hidrato de sal de ácido, N-óxido de una amida de péptido sintético que contiene una amina donde el átomo de nitrógeno de la amina está unido a un átomo de oxígeno, o forma isomórfica cristalina de ésta;
donde
Xaa1 se selecciona del grupo que consiste en (A) (A’) D-Phe, (A) (A’) (a-Me) D-Phe, D-Tyr, D-Tic, D-tert-leucina, Dneopentilglicina, D-fenilglicina, D-homofenilalanina y º- (E) D-Ala, donde cada (A) y cada (A’) son sustituyentes de anillo fenilo seleccionados de forma independiente del grupo que consiste en -H, -F, -Cl, -NO2, -CH3, -CF3, -CN y -CONH2, y donde cada (E) se selecciona de forma independiente del grupo que consiste en ciclobutilo, ciclopentilo, ciclohexilo, piridilo, tienilo y tiazolilo;
Xaa2 se selecciona del grupo que consiste en (A) (A’) D-Phe, 3, 4-dicloro-D-Phe, (A) (A’) (a-Me) D-Phe, D-1Nal, D2Nal, D-Tyr, (E) D-Ala y D-Trp;
Xaa3 se selecciona del grupo que consiste en D-Nle, D-Phe, (E) D-Ala, D-Leu, (a-Me) D-Leu, D-Hle, D-Val y D-Met;
Xaa4 se selecciona del grupo que consiste en (B) 2D-Arg, (B) 2D-Nar, (B) 2D-Har, º- (B) D-Hlys, D-Dap, E- (B) D-Lys, E- (B) 2-D-Lys, D-Amf, amidino-D-Amf, y- (B) 2D-Dbu, 5- (B) 2a- (B') D-Orn, ácido D-2-amino-3 (4-piperidil) propiónico, ácido D-2-amino3 (2-aminopirrolidil) propiónico, ácido D-a-amino-º-amidinopropiónico, ácido a-amino-4-piperidinacético, ácido cis-a, 4
diaminociclohexanoacético, ácido trans-a, 4-diaminociclohexanoacético, ácido cis-a-amino-4metilaminociclohexanoacético, ácido trans-a-amino-4-metilaminociclohexanoacético, ácido a-amino-1-amidino-4piperidinacético, ácido cis-a-amino-4-guanidinociclohexanoacético y ácido trans-a-amino-4-guanidinociclohexanoacético, donde cada (B) se selecciona de forma independiente del grupo que consiste en H y C1-C4 alquilo, y (B') es H o (a-Me) ;
W se selecciona del grupo que consiste en:
nulo, siempre que cuando W sea nulo, Y será N;
- NH- (CH2) b- con b igual a 0, 1, 2, 3, 4, 5 ó 6; y
- N- (CH2) c-O- con c igual a 2 ó 3, siempre que Y sea C;
el resto
Y Z
es un anillo sustituyente heterocíclico de 4 a 8 miembros opcionalmente sustituido donde todos los heteroátomos del anillo en dicho anillo sustituyente son N; donde Y y Z son cada uno de forma independiente C o N; siempre que, cuando tal anillo sustituyente sea un anillo de seis, siete u ocho miembros, Y y Z estén separados por al menos dos átomos del anillo; y, siempre que, cuando tal anillo sustituyente posea un único heteroátomo en el anillo que sea N, entonces tal anillo sustituyente será no aromático;
V es C1-C6 alquilo, y e es 0 ó 1, donde cuando e sea 0, entonces V será nulo, y R1 y R2 están unidos directamente al mismo o a diferentes átomos del anillo;
donde (i) R1 se selecciona del grupo que consiste en -H, -OH, halo, -CF3, -NH2, -COOH, C1-C6 alquilo, C1-C6 alcoxi, amidino, amidino sustituido por C1-C6 alquilo, arilo, heterociclilo opcionalmente sustituido, Pro-amida, Pro, Gly, Ala, Val, Leu, Ile, Lys, Arg, Orn, Ser, Thr, -CN, -CONH2, -COR', -SO2R', -CONR'R'', -NHCOR', OR' y SO2NR'R''; donde dicho 40 heterociclilo opcionalmente sustituido está opcionalmente sustituido de forma única o doble por sustituyentes seleccionados de forma independiente del grupo que consiste en C1-C6 alquilo, C1-C6 alcoxi, oxo, -OH, -Cl, -F, -NH2, -NO2, -CN, -COOH, y amidino; donde R' y R'' son cada uno de forma independiente -H, C1-C8 alquilo, arilo o heterociclilo, o
R' y R'' se combinan para formar un anillo de 4 a 8 miembros, estando dicho anillo opcionalmente sustituido de forma única o doble por sustituyentes seleccionados de forma independiente del grupo que consiste en C1-C6 alquilo, -C1-C6 alcoxi, -OH, -Cl, -F, -NH2, -NO2, -CN, -COOH y amidino; y R2 se selecciona del grupo que consiste en -H, amidino, amidino sustituido de forma única o doble por C1-C6 alquilo, -CN, -CONH2, -CONR'R'', -NHCOR', -SO2NR'R'' y -COOH; o
(ii) si R1 y R2 se juntan pueden formar un anillo sustituyente heterocíclico, monocíclico o bicíclico de 4 a 9 miembros opcionalmente sustituido que está enlazado a un único átomo del anillo del anillo sustituyente que contiene Y y Z; o
(iii) si R1 y R2 se juntan con un único átomo del anillo sustituyente que contiene Y y Z pueden formar un anillo sustituyente heterocíclico de 4 a 8 miembros opcionalmente sustituido para formar una estructura espiro; o
(iv) si R1 y R2 se juntan con dos o más átomos del anillo adyacentes del anillo sustituyente que contiene Y y Z pueden formar un anillo sustituyente heterocíclico, monocíclico o bicíclico de 4 a 9 miembros opcionalmente sustituido fusionado con el anillo sustituyente que contiene Y y Z;
donde cada uno de dichos anillos sustituyentes heterocíclicos de 4, 5, 6, 7, 8 y 9 miembros opcionalmente sustituidos que comprenden R1 y R2 está opcionalmente sustituido de forma única o doble por sustituyentes elegidos de forma independiente del grupo que consiste en C1-C6 alquilo, C1-C6 alcoxi, fenilo opcionalmente sustituido, oxo, -OH, -Cl, -F, -NH2, -NO2, -CN, -COOH y amidino;
siempre que cuando el anillo sustituyente que contiene Y y Z sea un anillo de seis o siete miembros que posea un único heteroátomo en el anillo, y e sea cero, entonces R1 no será OH, y R1 y R2 no serán a la vez -H.
además, siempre que cuando el anillo sustituyente que contiene Y y Z sea un anillo de seis miembros que posea dos heteroátomos en el anillo, tanto Y como Z sean N y W sea nulo, entonces - (V) eR1R2 estará enlazado a otro átomo del anillo que no sea Z; y cuando e sea cero, entonces R1 y R2 no serán a la vez -H; y
por último, siempre que cuando Xaa3 sea D-Nle, entonces Xaa4 no será (B) 2D-Arg, y cuando Xaa3 sea D-Leu o (aMe) D-Leu, entonces Xaa4 no será 5- (B) 2a- (B') D-Orn.
2. La amida de péptido sintético de la reivindicación 1, donde Xaa4 se selecciona del grupo que consiste en (B) 2D-Arg, D-Lys, (B) 2D-Har, º- (B) D-Hlys, D-Dap, E- (B) D-Lys, E- (B) 2-D-Lys, D-Amf, amidino-D-Amf, y- (B) 2D-Dbu y 5- (B) 2a- (B') D-Orn.
3. La amida de péptido sintético de cualquiera de las reivindicaciones 1 ó 2, donde Xaa3 se selecciona del grupo que consiste en D-Nle y D-Leu.
4. La amida de péptido sintético de la reivindicación 3, donde Xaa3 es D-Leu y Xaa4 se selecciona del grupo que consiste en D-Arg, D-Nar, D-Har, D-Lys, E- (isopropil) -D-Lys y E- (metil) -D-Lys.
5. La amida de péptido sintético de cualquiera de las reivindicaciones 1-4, donde Xaa1-Xaa2 es D-Phe-D-Phe.
6. La amida de péptido sintético de cualquiera de las reivindicaciones 1-5, donde W es nulo.
7. La amida de péptido sintético de la reivindicación 6, donde Y es N y Z es C.
8. La amida de péptido sintético de la reivindicación 33, donde el anillo sustituyente que contiene Y y Z es un anillo saturado de seis miembros que comprende un único heteroátomo en el anillo.
9. La amida de péptido sintético de cualquiera de las reivindicaciones 1-6, donde Y y Z son ambos N y son los únicos heteroátomos del anillo del anillo sustituyente que contiene Y y Z.
10. La amida de péptido sintético de cualquiera de las reivindicaciones 1-9, donde e es cero.
11. La amida de péptido sintético de la reivindicación 10, donde R1 y R2 están enlazados al mismo átomo del anillo.
12. La amida de péptido sintético de la reivindicación 10 u 11, donde R1 es -H, -OH, -NH2, -COOH, C1-C3 alquilo, amidino, amidino sustituido por C1-C3 alquilo, dihidroimidazol, D-Pro, D-Pro-amida o CONH2 y donde R2 es -H, -COOH o C1-C3 alquilo.
13. La amida de péptido sintético de cualquiera de las reivindicaciones 1-5, donde el resto:
R1- (V) e-R2
se selecciona del grupo que consiste en:
N
N
H2N O O OH N NH
OH N
N
NH
NN
N
NN N
H NH2
O
N
N
N O N NH N
HN NH O
OO N
O
N
OH
N NN NH NH N O
N O N
NH
ON
NH2
N
O N
OH
H
N O
NNH
O O N
N OH N
NH2 NH2 NH
NH
N O N
O
O N H
OH OH NH2 OH
O O N OH ON
N
NN
NH
N O N
NH N
N
N
N N
N
Cl O
N
N N N O NH H
N N
y OH .
14. La amida de péptido sintético de la reivindicación 1 que posee la estructura del Compuesto (2) :
O
O
H
H
N
N
N
NO
H2N
H
O
O
OH
NH2
NH2
D-Phe-D-Phe-D-Leu-D-Lys-[w (ácido 4-aminopiperidin-4-carboxílico) ]-OH
15. Una composición farmacéutica que comprende una cantidad eficaz de la amida de péptido sintético de cualquiera de las reivindicaciones 1-14 y un portador o excipiente farmacéuticamente aceptable.
16. El uso de la amida de péptido sintético de cualquiera de las reivindicaciones 1-14 para la fabricación de un medicamento para el tratamiento o la prevención de una enfermedad o afección asociada con receptores opioides kappa en un mamífero, preferentemente donde la afección asociada con receptores opioides kappa se selecciona del grupo que consiste en inflamación, prurito, edema, hiponatremia, íleo, tos, glaucoma y dolor, preferentemente donde el dolor se selecciona del grupo que consiste en dolor neuropático, dolor somático, dolor visceral y dolor cutáneo, dolor artrítico,
dolor provocado por piedras en el riñón, cólico uterino, dismenorrea, endometriosis, dolor después de un procedimiento médico, dolor ocular, dolor otítico, dolor irruptivo debido al cáncer, dolor asociado con un trastorno GI y dolor posquirúrgico, preferentemente donde la cirugía es laparoscopia pélvica, ligadura de trompas, histerectomía y colecistectomía.
17. Una amida de péptido sintético de cualquiera de las reivindicaciones 1-14 para usar en el tratamiento o la prevención de una enfermedad o afección asociada con receptores opioides kappa en un mamífero, preferentemente donde la afección asociada con receptores opioides kappa se selecciona del grupo que consiste en inflamación, prurito, edema, hiponatremia, hipocalemia, úleo, tos, glaucoma y dolor, preferentemente donde el dolor se selecciona del grupo que consiste en dolor neuropático, dolor somático, dolor visceral y dolor cutáneo, dolor artrítico, dolor provocado por piedras en el riñón, cólico uterino, dismenorrea, endometriosis, dispepsia, dolor después de un procedimiento médico,
dolor ocular, dolor otítico, dolor irruptivo debido al cáncer, dolor asociado con un trastorno GI y dolor posquirúrgico, preferentemente donde la cirugía es laparoscopia pélvica, ligadura de trompas, histerectomía y colecistectomía.
Figura 2
b1.c,
O
O
d, b 2. H
H
Cl
a, b HN
N N
e, b3. BocHN NN H
f, b 4.
O
O
HNO O
O
O
H
H
O
O
N
N
g, h, i, j
H
H
k
BocHN
N
N
O
N
N
H
OH
N
N
H2N
O
O
H
O
O
N
HN
HN
Figura 3 Figura 4
O
O
H
H
b
a N BocHN
N
O
Ph
H2N
O
O H2N
O
O O
BocHN CO2H
I-1 I-2 I-3
I-4
NHBoc
Ph
Ph
Ph O O
O
O
H
O O
e H
H
BocHN
N
d
BocHN
N
O
N
OH
BocHN N
N
N
N O H
H
H
O
H
O
O
Ph
O
Ph
Ph
I-6 I-5
I-7
NHBoc Ph Ph
O
O
H
H
O O
N
N
H
f
N
NR1R2 N
OH g, h H2N
BocHN N
H
N
O
O
H
H
Ph Ph
O O
25. 36
NH2
I-8
Figura 7
Figura 8 Figura 9
Figura 10 Figura 11
Figura 12
Patentes similares o relacionadas:
Composiciones nutricionales que contienen un componente de péptido y sus usos, del 29 de Julio de 2020, de MJN U.S. Holdings, LLC: Una composición nutricional para su uso para reducir la incidencia de la diabetes mellitus, en donde dicha composición nutricional comprende: (i) […]
Péptido que tiene actividad antiinflamatoria, y uso del mismo, del 8 de Julio de 2020, de CAREGEN CO., LTD: Un péptido que consiste en una secuencia de aminoácidos de SEQ ID NO: 1, SEQ ID NO: 2 o SEQ ID NO: 3.
INHIBIDORES DE LA CASPASA 1 PARA USO EN EL TRATAMIENTO DE LA ANEMIA, del 2 de Julio de 2020, de UNIVERSIDAD DE MURCIA: La presente invención se refiere a una composición que comprende al menos un inhibidor de caspasa-1 para su uso en un método de tratamiento de una enfermedad […]
Péptido y composición del mismo para usar en el tratamiento del accidente cerebrovascular con fiebre, del 20 de Mayo de 2020, de NoNO Inc: Un peptido que tiene una secuencia de aminoacidos que comprende [E/D/N/Q]-[S/T]-[D/E/Q/N]-[V/L] para su uso en el tratamiento, opcionalmente en donde el tratamiento […]
Composiciones y métodos para el cuidado de la piel que comprenden agonistas selectivos del receptor de melanocortina 1, del 13 de Noviembre de 2019, de UNIVERSITY OF CINCINNATI: Un agonista selectivo de péptidos del receptor de melanocortina 1 (MC1R) según la siguiente fórmula: Ar(CH2)mX1-X2-CO-X3-X4-X5-(Trp)n-NX6R […]
Péptidos para el manejo de la lactación, del 18 de Septiembre de 2019, de MILEUTIS LTD: Un péptido sintético o recombinante que comprende una secuencia de 4-7 aminoácidos de fórmula X1(n)-Ser(P)-Ser(P)-Ser(P)-X2(n) (SEQ ID NO: 1), en el que al […]
Modulación de actividad del complemento, del 4 de Septiembre de 2019, de RA Pharmaceuticals, Inc: Polipéptido, en el que el polipéptido se selecciona de: SEQ ID NO: 177, 184 y 191-195.
Compuestos para el tratamiento y/o cuidado de la piel y/o membranas mucosas y su uso en composiciones cosméticas o farmacéuticas, del 4 de Septiembre de 2019, de LUBRIZOL ADVANCED MATERIALS, INC.: Un compuesto de fórmula general (I), R1-Wn-Xm-AA1-AA2-AA3-AA4-AA5-AA6-Yp-Zq-R2 (I) sus estereoisómeros, mezclas de los mismos y/o sus sales cosmética o farmacéuticamente […]