Procedimientos de cuantificación de microARN y ARN interferentes pequeños.
Un procedimiento para la determinación cuantitativa de un ARN de longitud corta,
que tiene una longitud de como mucho 100 nucleótidos, que comprende
a) preparar, a partir de una muestra que comprende dicho ARN de longitud corta, un polinucleótido de molde que consiste en 1) una secuencia diana monocatenaria que consiste en la secuencia de dicho ARN de longitud corta, su secuencia de ADN correspondiente o una secuencia de nucleótidos complementaria a la secuencia de dicho ARN de longitud corta y 2) una secuencia de nucleótidos adyacente 5' y/o 3', donde dicha secuencia de nucleótidos adyacente 5' y/o 3' es un polinucleótido que consiste en nucleótidos idénticos,
b) usar dicho polinucleótido de molde en una transcripción inversa o una polimerización de nucleótidos para obtener una cadena de ADNc y
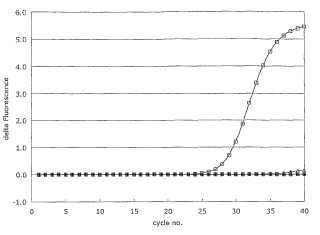
c) realizar una PCR a tiempo real cuantitativa (qPCR) incluyendo como molde o moldes dicho ADNc y, opcionalmente, el polinucleótido de molde, en el que
1) los cebadores usados para qPCR en la etapa c se seleccionan de
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia en la secuencia de nucleótidos adyacente 5' o 3' y
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente, o en el que 2) la reacción de la etapa (b) utiliza un cebador de transcripción inversa o un cebador de polimerización de ADN, que corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2005/000239.
Solicitante: EXIQON A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: SKELSTEDET 16 2950 VEDBAEK DINAMARCA.
Inventor/es: KAUPPINEN, SAKARI, KONGSBAK, LARS, MOURITZEN,Peter, JACOBSEN,Nana, ECHWALD,Søren Morgenthaler, NIELSEN,Peter Stein, NØRHOLM,Mikkel.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2380923_T3.pdf
Fragmento de la descripción:
Procedimientos de cuantificación de microARN y ARN interferentes pequeños La presente invención se refiere a ácidos nucleicos, sondas y procedimientos para la detección, la cuantificación, así como el control de la expresión de microARN maduros y ARN interferentes pequeños (ARNip) . La invención se refiere además a procedimientos para controlar la expresión de otros ARN no codificantes, variantes de corte y empalme de ARNm, así como la detección y cuantificación de la edición de ARN, variantes alélicas de transcritos individuales, mutaciones, deleciones o duplicaciones de exones particulares en transcritos, por ejemplo, alteraciones asociadas con una enfermedad humana, tal como cáncer. La invención se refiere además a procedimientos para la detección y cuantificación de una secuencia de ADN diana.
Antecedentes de la invención La presente invención se refiere a la cuantificación de secuencias de nucleótidos diana en una amplia diversidad de muestras de ácido nucleico y, más específicamente, a los procedimientos que emplean el diseño y el uso de sondas oligonucleotídicas que son útiles para detectar y cuantificar secuencias de nucleótidos diana, especialmente secuencias diana de ARN, tales como secuencias diana de microARN y ARNip de interés, y para detectar diferencias entre muestras de ácido nucleico (por ejemplo, tales como muestras de un paciente con cáncer y un paciente sano) .
MicroARN
El creciente inventario de bases de datos de secuencias internacionales y la secuenciación concomitante de casi 200 genomas que representan los tres dominios de vida —bacterias, arqueas y eucariotas— han sido los impulsores principales en el procedimiento de deconstrucción de organismos vivos en catálogos moleculares completos de genes, transcritos y proteínas. La importancia de la variación genética dentro de una sola especie se ha hecho evidente, extendiéndose más allá de la conclusión de proyectos genéticos de varios genomas importantes, culminando en la publicación del borrador de trabajo de la secuencia del genoma humano en 2001 (Lander, Linton, Birren y col., 2001 Nature 409: 860-921; Venter, Adams, Myers y col., 2001 Science 291: 1304-1351; Sachidanandam, Weissman, Schmidt y col., 2001 Nature 409: 928-933) . Por otro lado, el número creciente de análisis moleculares detallados a gran escala de la transcripción que se origina de los genomas humanos y de ratón, junto con la reciente identificación de varios tipos de ARN no codificantes de proteínas, tales como ARN nucleolares pequeños, ARNip, microARN y ARN antisentido, indica que los transcriptomas de eucariotas superiores son mucho más complejos de lo que se esperaba originariamente (Wong y col. 2001, Genome Research 11: 1975-1977; Kampa y col. 2004, Genome Research 14: 331-342) .
Como resultado del Dogma Central: "el ADN genera ARN y el ARN genera proteína", los ARN se han considerado como simples moléculas que sólo traducen la información genética en proteínas. Recientemente, se ha estimado que aunque la mayor parte del genoma se transcribe, casi el 97% del genoma no codifica proteínas en eucariotas superiores, sino supuestos ARN no codificantes (Wong y col. 2001, Genome Research, 11: 1975-1977) . Los ARN no codificantes (ARNnc) parecen estar particularmente bien adaptados para papeles reguladores que requieren un reconocimiento de ácido nucleico altamente específico. Por lo tanto, la visión del ARN está cambiando rápidamente desde la molécula simplemente informativa para comprender una amplia diversidad de moléculas estructurales, informativas y catalíticas en la célula.
Recientemente, se han identificado y diseñado un gran número de genes de ARN pequeños no codificantes como microARN (miARN) (para una revisión, véase Ke y col. 2003, Curr. Opin. Chem. Biol. 7: 516-523) . Los primeros miARN que se descubrieron fueron el lin-4 y el let-7, que son genes de cambio heterocrónico esenciales para el control temporal normal de diversos acontecimientos de desarrollo (Lee y col. 1993, Cell 75: 843-854; Reinhart y col. 2000, Nature 403: 901-906) en el verme redondo C. elegans. Los miARN se han conservado evolutivamente a lo largo de una amplia variedad de especies y muestran diversidad en sus perfiles de expresión, sugiriendo que ocupan una amplia diversidad de funciones reguladoras y ejercen efectos significativos sobre el crecimiento y el desarrollo celular (Ke y col. 2003, Curr. Opin. Chem. Biol. 7: 516-523) . Un trabajo reciente ha demostrado que los miARN pueden regular la expresión génica a muchos niveles, representando un mecanismo regulador de genes novedoso y confirmando la idea de que el ARN es capaz de realizar papeles reguladores similares a los de las proteínas. La compresión de esta regulación basada en ARN contribuirá a que los presentes inventores entiendan la complejidad del genoma en eucariotas superiores, así como a que entiendan las complejas redes reguladoras de genes.
Los miARN son ARN de 21-25 nucleótidos (nt) que se procesan a partir de transcritos de horquilla endógenos más largos (Ambros y col 2003, RNA 9: 277-279) . Hasta la fecha se han identificado más de 719 microARN en seres humanos, vermes, moscas de la fruta y plantas de acuerdo con la base de datos de registro de miARN alojada por el Sanger Institute, Reino Unido, y también se han identificado muchos miARN que corresponden a supuestos genes. Algunos miARN tienen múltiples loci en el genoma (Reinhart y col. 2002, Genes Dev. 16: 1616-1626) y, ocasionalmente, varios genes de miARN se disponen en grupos en tándem (Lagos-Quintana y col. 2001, Science 294: 853-858) . El hecho de que muchos de los miARN descritos hasta la fecha se hayan aislado sólo una vez
sugiere que se descubrirán muchos nuevos miARN en el futuro. Un reciente análisis transcripcional en profundidad de los cromosomas humanos 21 y 22 descubrió que el 49% de la transcripción observada estaba fuera de cualquier anotación conocida, y además que estos nuevos transcritos eran ARN tanto codificantes como no codificantes (Kampa y col. 2004, Genome Research 14: 331-342) . Los miARN identificados hasta la fecha representan muy probablemente la punta del iceberg, y el número de miARN podría resultar ser muy grande.
Las características combinadas de los microARN caracterizados hasta la fecha (Ke y col. 2003, Curr. Opin. Chem. Biol. 7: 516-523; Lee y col. 1993, Cell 75: 843-854; Reinhart y col. 2000, Nature 403: 901-906) pueden resumirse como:
1. Los miARN son ARN monocatenarios de aproximadamente 21-25 nt.
2. Se escinden a partir de un precursor de horquilla bicatenario endógeno más largo mediante la enzima Dicer.
3. Los miARN coinciden con precisión con las regiones genómicas que pueden codificar potencialmente ARN precursores en forma de horquillas bicatenarias.
4. Los miARN y sus estructuras secundarias precursoras predichas están conservados filogenéticamente.
Varias líneas de pruebas sugieren que las enzimas Dicer y Argonaute son participantes cruciales en la biosíntesis, la maduración y la función de los miARN (Grishok y col. 2001, Cell 106: 23-24) . Las mutaciones en genes necesarios para la biosíntesis de miARN conducen a defectos genéticos del desarrollo, que al menos en parte, proceden del papel de generar miARN. La visión actual es que los miARN se escinden mediante Dicer a partir del precursor de horquilla en forma de dúplex, inicialmente con salientes de 2 ó 3 nt en los extremos 3', y se denominan pre-miARN. Los cofactores se unen al pre-miRNP y desenrollan los pre-miARN en miARN monocatenarios, y los pre-miRNP se transforman después en miRNP. Los miARN pueden reconocer dianas reguladoras mientras sean parte del complejo de miRNP. Existen varias similitudes entre los miRNP y el complejo de silenciamiento inducido por ARN, RISC, incluyendo tamaños similares y que ambos contienen ARN helicasa y las proteínas PPD. Por lo tanto, se ha propuesto que los miRNP y RISC son el mismo RNP con múltiples funciones (Ke y col. 2003, Curr. Opin. Chem. Biol.
7: 516-523) . Diferentes efectores dirigen a los miARN hacia diversas rutas. La estructura de los pre-miARN concuerda con la observación de que dúplex de ARN de 22 nt con salientes de 2 ó 3 nt en los extremos 3' son beneficiosos para la reconstitución del complejo proteico y podrían ser necesarios para una unión de alta afinidad del dúplex de ARN corto con los componentes proteicos (para una revisión, véase Ke y col. 2003, Curr. Opin. Chem. Biol. 7: 516-523) .
Las pruebas crecientes sugieren que los miARN desempeñan papeles cruciales en la regulación de genes eucariotas. Los primeros genes de miARN que se descubrieron, lin-4... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la determinación cuantitativa de un ARN de longitud corta, que tiene una longitud de como mucho 100 nucleótidos, que comprende a) preparar, a partir de una muestra que comprende dicho ARN de longitud corta, un polinucleótido de molde que consiste en 1) una secuencia diana monocatenaria que consiste en la secuencia de dicho ARN de longitud corta, su secuencia de ADN correspondiente o una secuencia de nucleótidos complementaria a la secuencia de dicho ARN de longitud corta y 2) una secuencia de nucleótidos adyacente 5' y/o 3', donde dicha secuencia de nucleótidos adyacente 5' y/o 3' es un polinucleótido que consiste en nucleótidos idénticos, b) usar dicho polinucleótido de molde en una transcripción inversa o una polimerización de nucleótidos para obtener una cadena de ADNc y c) realizar una PCR a tiempo real cuantitativa (qPCR) incluyendo como molde o moldes dicho ADNc y, opcionalmente, el polinucleótido de molde, en el que 1) los cebadores usados para qPCR en la etapa c se seleccionan de
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia en la secuencia de nucleótidos adyacente 5' o 3' y
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente, o en el que
2) la reacción de la etapa (b) utiliza un cebador de transcripción inversa o un cebador de polimerización de ADN, que corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente.
2. El procedimiento de acuerdo con la reivindicación 1, en el que los cebadores usados para la qPCR en la etapa c se seleccionan de
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia en la secuencia de nucleótidos adyacente 5' o 3'
- al menos 2 oligonucleótidos, en el que al menos uno de dichos oligonucleótidos corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente, en
- al menos 2 oligonucleótidos, en el que uno corresponde a una primera secuencia de nucleótidos en la secuencia diana monocatenaria y el otro es complementario a una segunda secuencia de nucleótidos en la secuencia diana monocatenaria y
en el que dichos cebadores usados para la qPCR pueden incluir cada uno independientemente un marcador detectable.
3. El procedimiento de acuerdo con la reivindicación 1 ó 2, en el que la reacción en la etapa (b) utiliza un cebador de transcripción inversa o un cebador de polimerización de ADN que corresponde a o es complementario a la secuencia diana monocatenaria o que corresponde a o es complementario a una secuencia contigua en el polinucleótido de molde constituida por parte de la secuencia diana monocatenaria y parte de la secuencia de nucleótidos 5' o 3' adyacente.
4. El procedimiento de acuerdo con la reivindicación 3, en el que dicho cebador de transcripción inversa o cebador de polimerización de nucleótidos es específico para al menos un ARN de longitud corta.
5. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-4, en el que la secuencia diana monocatenaria y la secuencia o secuencias de nucleótidos adyacentes 5' y/o 3' están unidas covalentemente.
6. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-5, en el que la secuencia diana monocatenaria y la secuencia o secuencias de nucleótidos adyacentes 5' y/o 3' están unidas no covalentemente.
7. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-6, en el que la secuencia de nucleótidos adyacente 5' y/o 3' incluye un marcador detectable.
8. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-7, en el que la secuencia de nucleótidos adyacente 5' y/o 3' se une a la secuencia diana monocatenaria por una reacción enzimática.
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-7, en el que la secuencia de nucleótidos adyacente 5' y/o 3' se une a la secuencia diana monocatenaria por una reacción no enzimática.
10. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-9, en el que la secuencia de nucleótidos adyacente 5' y/o 3' no aparece de forma natural en el organismo del que procede el ARN de muestra.
11. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-10, en que la secuencia de nucleótidos adyacente 5' y/o 3' no es de mamífero.
12. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-11, en que la etapa (a) comprende la preparación del polinucleótido de molde por ligación de la secuencia de nucleótidos adyacente 5' y/o 3' con el ARN de longitud corta, o en el que la etapa (a) comprende la preparación del polinucleótido de molde por unión de la secuencia de nucleótidos adyacente 5' y/o 3' al ARN de longitud corta en una reacción de transferasa terminal, preferentemente en una reacción de transferasa de poli A.
13. El procedimiento de acuerdo con la reivindicación 12, en que la ligación se selecciona de ligación de salientes y ligación de extremos romos, preferentemente ligación de salientes.
14. El procedimiento de acuerdo con la reivindicación 13, que comprende aparear, con el ARN de longitud corta, un oligonucleótido en parte complementario al extremo reactivo con ligasa de la secuencia de nucleótidos adyacente 5'
o 3' y en parte complementario con el extremo reactivo con ligasa de la molécula de ARN de longitud corta para situar el extremo reactivo con ligasa de la secuencia de nucleótidos adyacente 5' o 3' directamente adyacente al extremo reactivo con ligasa de la molécula de ARN pequeña para permitir la ligación de salientes.
15. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 12-14, en el que todo el ARN en la muestra se somete a la ligación o a la reacción de transferasa terminal.
16. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 12-15, en el que la ligación o la reacción de transferasa terminal se realiza solamente en el extremo 3' de la secuencia diana.
17. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 12-15, en el que la ligación con el extremo 5' de la secuencia diana se realiza por fosforilación del extremo 5' de la secuencia diana antes de la reacción de ligación.
18. El procedimiento de una cualquiera de las reivindicaciones 12-17, en el que la secuencia de nucleótidos adyacente 5' se bloquea en su extremo 5' terminal y la secuencia de nucleótidos adyacente 3' se bloquea en su extremo 3' terminal antes de la ligación.
19. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-18, en el que la secuencia de nucleótidos adyacente 5' y/o 3' se une preferentemente o exclusivamente a un estado de procesamiento definido de dicho ARN de longitud corta en la etapa (a) .
20. El procedimiento de acuerdo con la reivindicación 19, en el que el estado de procesamiento definido de dicho ARN es el estado maduro.
21. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 12-20, en el que la etapa (b) comprende una transcripción inversa del polinucleótido de molde para obtener el ADNc.
22. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-8, en el que la etapa (a) comprende una etapa de polimerización de nucleótidos para unir las secuencias de nucleótidos adyacentes.
23. El procedimiento de acuerdo con la reivindicación 22, en el que la polimerización se consigue por medio de una polimerasa seleccionada del grupo que consiste en una polimerasa independiente de molde y dependiente de molde.
24. El procedimiento de acuerdo con la reivindicación 23, en el que la polimerasa es una ADN polimerasa.
25. El procedimiento de acuerdo con una cualquiera de las reivindicaciones, en el que la polimerización consiste en la adición de una cola de poli-A, poli-G, poli-T o poli-C al extremo 3' de la secuencia diana.
26. El procedimiento de acuerdo con la reivindicació.
2. 25, en el que la etapa (a) comprende la preparación del polinucleótido de molde mediante las etapas de
- aparear el extremo 3' del ARN de longitud corta con una sonda de captura oligonucleotídica cuyo extremo 5' es complementario al extremo 3' del ARN de longitud corta, y
- extender el ARN de longitud corta por polimerización de nucleótidos usando la sonda de captura de oligonucleotídica como molde para obtener una molécula de ARN de longitud corta extendida que constituye el polinucleótido de molde.
27. El procedimiento de acuerdo con la reivindicación 26, en el que la polimerización de nucleótidos comprende una polimerización de ADN para obtener un híbrido de ARN-ADN que constituye el polinucleótido de molde.
28. El procedimiento de acuerdo con la reivindicación 26 ó 27, en el que la etapa (b) comprende que (I) la cadena híbrida de ARN-ADN se someta a transcripción inversa para obtener el ADNc, opcionalmente después de la eliminación de material que no se aparee con la sonda de captura oligonucleotídica.
29. El procedimiento de acuerdo con la reivindicación 28, en el que el cebador en la transcripción inversa es la sonda de captura oligonucleotídica o un cebador de transcripción inversa separado.
30. El procedimiento de acuerdo con la reivindicació.
2. 25, en el que la etapa (a) comprende la preparación del polinucleótido de molde mediante las etapas de
- aparear el extremo 5' del ARN de longitud corta con una sonda de captura oligonucleotídica cuyo extremo 3' es complementario al 5' del ARN de longitud corta, y cuyo extremo 5' comprende la secuencia de nucleótidos adyacente 5' y
- extender la sonda de captura por transcripción inversa usando ARN de longitud corta como molde para obtener una sonda de captura extendida que constituye el polinucleótido de molde.
31. El procedimiento de acuerdo con la reivindicación 30, en el que la etapa (b) comprende que el ARN de longitud corta se elimine de la sonda de captura extendida, se permita que la sonda de captura se aparee en su extremo 3' con un oligonucleótido auxiliar que comprende una secuencia de nucleótidos complementaria a la secuencia de nucleótidos adyacente 3', y la sonda de captura se alargue adicionalmente en la dirección 5' → 3' para obtener el ADNc por medio de polimerización de ADN usando el oligonucleótido auxiliar como molde.
32. El procedimiento de acuerdo con una cualquiera de las reivindicacione.
2. 31, en el que el oligonucleótido de captura contiene un resto que permite la inmovilización sobre un soporte sólido.
33. El procedimiento de acuerdo con la reivindicación 32, en el que la sonda de captura se inmoviliza después del apareamiento para permitir la eliminación del material no apareante.
34. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-33, en el que la muestra en la etapa
(a) está enriquecida para ARN de longitud corta.
35. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-34, en el que la etapa (c) comprende el uso de una sonda de detección que comprende nucleótidos modificados.
36. El procedimiento de acuerdo con la reivindicación 35, en el que los nucleótidos modificados son nucleótidos de LNA.
37. El procedimiento de acuerdo con la reivindicación 35, en el que el nucleótido de LNA se selecciona de nucleótidos de oxi-LNA, alfa-LNA y/o xilo LNA.
38. El procedimiento de acuerdo con la reivindicación 35 ó 36, en el que la sonda de detección corresponde a o es complementaria a una secuencia en el ARN de longitud corta.
39. El procedimiento de acuerdo con una cualquiera de las reivindicacione.
3. 38, en el que la sonda de detección de 6 a 30 nucleótidos comprende de 1 a 8 nucleótidos de LNA.
40. El procedimiento de acuerdo con una cualquiera de las reivindicacione.
3. 39, en el que en la sonda de detección que comprende al menos dos nucleótidos de LNA, estos pueden ser consecutivos o estar separados por uno o más nucleótidos distintos de LNA.
41. El procedimiento de acuerdo con una cualquiera de las reivindicacione.
3. 40, en el que la sonda de detección es de menos de aproximadamente 20 nucleótidos de longitud, tal como de menos de 15 nucleótidos, tal como de aproximadamente 7 u 8 ó 9 ó 10 u 11 nucleótidos.
42. El procedimiento de acuerdo con una cualquiera de las reivindicacione.
3. 41, en el que la sonda de detección comprende una pareja de marcadores que interaccionan entre sí para producir una señal o para producir un cambio en una señal cuando se produce la hibridación de la sonda de detección con una secuencia diana.
43. El procedimiento de acuerdo con la reivindicación 42, en el que la sonda de detección comprende un resto fluoróforo y un resto inactivador, situados de tal modo que el estado hibridado de la sonda puede distinguirse del estado no hibridado de la sonda por un aumento en la señal fluorescente del nucleótido.
44. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-43, en el que los cebadores usados en la transcripción inversa o en la polimerización de ADN comprenden nucleótidos modificados.
45. El procedimiento de acuerdo con la reivindicación 44, en el que los nucleótidos modificados son nucleótidos de LNA.
46. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-45, en el que al menos un cebador usado en la qPCR en la etapa (c) está constituido por un cebador usado en la transcripción inversa o polimerización de nucleótidos de la etapa (b) .
47. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-46, en el que la secuencia de nucleótidos diana es una secuencia de microARN.
48. El procedimiento de acuerdo con la reivindicación 47, en el que la secuencia de nucleótidos diana es una secuencia de microARN maduro.
49. El procedimiento de acuerdo con la reivindicación 1, en el que
- una muestra de ARN total o una fracción de muestra de ARN que contiene solamente ARN de un tamaño por debajo de 200 nucleótidos se somete a una polimerasa de poli A para añadir a todas las moléculas diana de microARN una cola de nucleótidos de poli A.
- un cebador de poli T se usa posteriormente como cebador en una reacción de transcriptasa inversa (RT) para
convertir la muestra de ARN en ADNc, en el que dicha reacción de RT se vuelve opcionalmente específica de secuencia permitiendo que la secuencia de cebador de RT solape en parte con la secuencia de microARN específica para microARN específicos o un grupo o familia de microARN y
- someter dicho ADNc a una amplificación por qPCR a tiempo real usando cebadores de qPCR específicos para
una diana de microARN específica y, opcionalmente, una sonda de detección marcada, en el que dichos 15 cebadores de qPCR solapan opcionalmente en su totalidad o en parte con la secuencia añadida.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]