Partículas de centro escindido para la presentación de moléculas extrañas, particularmente para aplicaciones de vacunas y procedimiento para su preparación.
Sistema de vehículo de centro escindido, que presenta como polipéptidos separados el dominio de centro N y de centro C de la proteína de centro de un virus de la hepatitis B y al menos una molécula extraña con base peptídica frente a la que se debe generar una respuesta inmune,
estando fusionada la molécula extraña al extremo C del dominio de centro N o al extremo N del dominio de centro C y pudiendo formar la proteína de centro partículas de tipo cápside y estando fusionada la molécula extraña a un aminoácido de la proteína de centro que se encuentra entre las posiciones 73 y 94 de la proteína de centro.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/006190.
Solicitante: UNIVERSITATSKLINIKUM FREIBURG.
Nacionalidad solicitante: Alemania.
Dirección: HUGSTETTER STRASSE 49 79106 FREIBURG ALEMANIA.
Inventor/es: NASSAL,Michael, SKAMEL,Claudia, WALKER,Andreas.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hepadnaviridae, p. ej. virus de la hepatitis B.
PDF original: ES-2377742_T3.pdf
Fragmento de la descripción:
Partículas de centro escindido para la presentación de moléculas extrañas, particularmente para aplicaciones de vacunas y procedimiento para su preparación Son objeto de la presente invención nuevos vehículos para vacunas, pero también para otras moléculas, basados en el antígeno central del virus de la hepatitis B. En el antígeno central del virus de la hepatitis se incluyen secuencias extrañas de aminoácidos, que pueden proceder de patógenos. Frente a estas secuencias proteicas deben formarse anticuerpos mediante la vacuna, prefiriéndose anticuerpos protectores o neutralizantes. Mediante las partículas de acuerdo con la invención se puede estimular también la respuesta inmune celular (linfocitos T) . La proteína del centro de la hepatitis B tiene la propiedad de que varias copias se pueden ensamblar hasta dar las denominadas partículas de tipo cápside (capsid-like particles) . Estas partículas de tipo cápside (CLP) son particularmente adecuadas para la preparación de vacunas, ya que estimulan el sistema inmune y conducen de este modo a una producción aumentada de anticuerpos. El término "vacuna" se tiene que entender en la presente solicitud preferentemente como sistema de vehículo que puede producir respuestas inmunes tanto humorales como celulares.
Las cápsides de los virus de la hepatitis B son nanopartículas simétricas icosaédricas (diámetro aproximadamente 30 nm) , que están compuestas de 180 o 240 copias de la proteína de centro vírico. La proteína de centro se denomina HBcAg. Pueden servir como vehículos particulados para moléculas extrañas; la aplicación preferente es como vehículos de antígenos de refuerzo inmunitario para vacunas. Mediante modificación adecuada de la proteína de centro se pueden presentar las moléculas extrañas sobre la superficie de la partícula (si es necesario también en el interior) . Para la exposición en la superficie es óptima la asociación de la molécula extraña con restos de aa que se encuentran de forma central en la secuencia de aa de la proteína de centro (zona de los aa aproximadamente 7394) , que contienen el epítopo de linfocito B inmunodominante "c/e1" y que están más intensamente expuestos en la estructura 3D sobre la superficie de las partículas (aa significa aminoácido) .
El documento WO 01/77158 describe proteínas de fusión de antígeno central de la hepatitis B, introduciéndose epítopos heterólogos preferentemente en la zona entre las posiciones 61 y 90. El documento US 2003/0198649 describe partículas de antígeno central del virus de la hepatitis B, en las que los inmunógenos están unidos mediante estructura de ligando con la proteína de centro del virus de la hepatitis B (VHB) . Kratz y col. [PNAS (1999) , 1915-1920] describen la presentación de GFP (Proteína Verde Fluorescente) sobre la superficie de la proteína de centro del VHB. A este respecto, los aminoácidos 79 y 80 de la proteína de centro se sustituyeron por la secuencia de 238 aminoácidos de longitud de GFP.
Nassal y col. [Eur. J. Immunol. (2005) , pág. 655-665] describen un producto de fusión de toda la proteína OspA de Borrelia burgdorferi y de la proteína de la cápside del virus de la hepatitis B. También en este caso se sustituyeron los aminoácidos 79 y 80 por los aminoácidos 18 a 273 de OspA, incluyéndose, sin embargo, entre la proteína de centro y OspA secuencias de engarce. Skamel y col. (Journal of Biological Chemistr y , 2006, páginas 17474-17481) describen la presentación de toda la proteína OspC de Borrelia burgdorferi con ayuda de partículas de tipo cápside del virus de la hepatitis B. Sin embargo, se ha observado en soluciones conocidas por el estado de la técnica que las proteínas de centro modificadas ya no tienden del modo deseado a la formación de partículas de tipo cápside (CLP) y que, por lo tanto, la respuesta inmune ya no se estimula de forma satisfactoria.
En una inserción genética de moléculas extrañas de base peptídica o proteica en la proteína de centro, esto significa que la secuencia extraña está unida con la proteína de centro tanto por su extremo N como por el C. Ahora se ha hallado que la asociación bilateral limita espectacularmente el tipo y la selección de secuencias extrañas adecuadas.
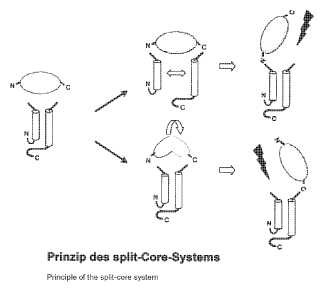
El "sistema de centro escindido" descrito en el presente documento elimina estas limitaciones, generándose la proteína de centro en dos partes independientes, que se encuentran sorprendentemente de forma espontánea y que forman partículas de cápside de forma comparable a la cadena proteica continua.
Las moléculas extrañas se pueden fusionar al fragmento N-terminal ("centroN") o al C-terminal ("centroC") y de este modo ya solamente están asociadas mediante un extremo con la proteína transportadora. De este modo se eliminan en lo esencial las limitaciones estructurales de la asociación bilateral durante la inserción de secuencias extrañas en la cadena peptídica continua de la proteína de centro.
Por tanto, el sistema de centro escindido de acuerdo con la invención permite:
(i) la presentación de moléculas extrañas, que debido a su tamaño y/o estructura no se pueden presentar o se pueden presentar solo muy mal en el contexto convencional de proteína de centro continua;
(ii) la presentación de proteínas extrañas heterodiméricas;
(iii) la presentación de moléculas extrañas con capacidad de interacción en una forma flexible, bien accesible, que simplifica considerablemente la interacción con las moléculas compañeras deseadas;
(iv) la presentación de moléculas extrañas adicionales mediante los extremos N y C expuestos en superficie adicionales presentes en el centro escindido, sin embargo, no en el sistema de centro continuo convencional.
Los virus de la hepatitis B (VHB) son virus envueltos. La nucleocápside interna se denomina también partícula de centro ("centro") ; serológicamente está definida como antígeno central de la hepatitis B (HBcAg) . Los centros están compuestos de 180 o 240 copias de la proteína de centro de 183-185 aa de longitud (dependiendo del subtipo de VHB) . La proteína de centro puede expresarse de forma heteróloga (en bacterias, levadura, células eucariotas) ; a este respecto se forman espontáneamente "partículas de tipo cápside" (=CLP) . Ya que no contienen ni el genoma del virus ni la envuelta externa, no son infecciosas. Tales CLP se pueden obtener también de los VHB de mamífero más emparentados (por ejemplo, marmota canadiense = woodchuck; ardilla = grounds squirrel; y otros) así como de los VHB de ave menos emparentados (por ejemplo, pato = duck; garza = heron; y otros) . Básicamente se pueden usar de acuerdo con la invención todas las secuencias de VHB, sin embargo, son preferentes las secuencias de VHB que pueden infectar al ser humano.
La secuencia de aminoácidos o secuencia de nucleótidos de la proteína de centro de VHB es conocida [Galibert y col., Nature (1979) , pág. 646-650; Nassal, Gene (1988) , páginas 279-294 o documento WO 01/77158], a estas publicaciones se hace referencia. Se usa preferentemente la secuencia de la proteína de centro del subtipo ayw, sin embargo, se pueden usar asimismo variantes, modificaciones de la secuencia de VHB, tales como la secuencia de otros VHB de mamífero o VHB de ave. Las secuencias están almacenadas en las genotecas de acceso público.
Además del virus de la hepatitis B patógeno para el ser humano (VHB en el sentido más riguroso) existe una serie de virus de la hepatitis B emparentados, específicos de animales, por ejemplo, el VHB de la marmota norteamericana (inglés: woodchuck; zool. Marmota monax; virus de la hepatitis B de marmota (woodchuck hepatitis B virus) = WHV) , el VHB de la ardilla terrestre californiana (inglés: california ground squirrel; zool. Spermophilus beecheyi; virus de la hepatitis B de ardilla (ground squirrel hepatitis B virus) = GSHV) así como otros.
Estos virus poseen una estructura genética similar al VHB humano, sin embargo, presentan distintas diferencias en su secuencia de nucleótidos y, por tanto, de aminoácidos de sus proteínas.
El uso del centro de VHB humano como vehículo de vacuna está sometido a dos posibles limitaciones:
1. Las personas con una infección por VHB crónica son parcialmente tolerantes frente a antígenos del VHB (esta respuesta inmune ausente es corresponsable de la persistencia de la infección) . El centro también actúa como antígeno dependiente de linfocitos T. Por tanto, los epítopos de linfocitos T en la secuencia de la proteína de centro participan en la fuerte inmunogenicidad de las vacunas basadas... [Seguir leyendo]
Reivindicaciones:
1. Sistema de vehículo de centro escindido, que presenta como polipéptidos separados el dominio de centro N y de centro C de la proteína de centro de un virus de la hepatitis B y al menos una molécula extraña con base peptídica frente a la que se debe generar una respuesta inmune, estando fusionada la molécula extraña al extremo C del dominio de centro N o al extremo N del dominio de centro C y pudiendo formar la proteína de centro partículas de tipo cápside y estando fusionada la molécula extraña a un aminoácido de la proteína de centro que se encuentra entre las posiciones 73 y 94 de la proteína de centro.
2. Sistema de vehículo de centro escindido de acuerdo con la reivindicación 1, caracterizado porque el virus de la hepatitis B es específico de mamíferos.
3. Sistema de vehículo de centro escindido de acuerdo con la reivindicación 2, caracterizado porque la proteína de centro presenta la secuencia de un virus de la hepatitis B humano.
4. Sistema de vehículo de centro escindido de acuerdo con la reivindicación 2, caracterizado porque la proteína de centro presenta la secuencia de aminoácidos del VHB de la marmota norteamericana.
5. Sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 4, caracterizado porque la molécula extraña es una secuencia de aminoácidos de una proteína de una bacteria patógena.
6. Sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 4, caracterizado porque la molécula extraña es una secuencia de aminoácidos de una proteína de un eucariota patógeno, particularmente del patógeno de la malaria Plasmodium falciparum.
7. Sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 4, caracterizado porque la molécula extraña es una secuencia de aminoácidos de una proteína de un virus.
8. Sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 4, caracterizado porque la molécula extraña es una secuencia de aminoácidos de una proteína con potencial respecto a la patogenia propio, particularmente una proteína de marcador tumoral.
9. Procedimiento para la preparación de un vehículo para proteínas extrañas frente a las que se debe inducir una respuesta inmune que presenta, por un lado, una secuencia proteica del antígeno central de un virus de la hepatitis B y, por otro lado, una secuencia proteica heteróloga como molécula extraña, fusionándose la secuencia proteica heteróloga detrás de la posición 73 y delante de la posición 94 de la región de centro de hepatitis B al dominio de centro N o de centro C e interrumpiéndose la cadena polipeptídica del vehículo detrás del dominio de centro N o delante del dominio de centro C, caracterizado porque el dominio de centro N y la secuencia proteica heteróloga o el dominio de centro C y la secuencia proteica heteróloga se expresan independientemente como proteínas de fusión o porque entre el centro N y la secuencia proteica heteróloga o entre la secuencia proteica heteróloga y el centro C se incluye una secuencia de reconocimiento para una proteasa y la vacuna de centro escindido se escinde después de la expresión, pero antes del uso con la proteasa, en dos polipéptidos y porque se forman partículas de tipo cápside.
10. Procedimiento de acuerdo con la reivindicación 9, caracterizado porque la secuencia proteica heteróloga se fusiona detrás del aminoácido 74 y delante del aminoácido 85 del antígeno central de la hepatitis B.
11. Procedimiento de acuerdo con una de las reivindicaciones 9-10, caracterizado porque la secuencia de proteína extraña heteróloga tiene al menos 40 aminoácidos de longitud.
12. Procedimiento de acuerdo con la reivindicación 9, caracterizado porque la secuencia de proteína extraña heteróloga tiene al menos 120 aminoácidos de longitud.
13. Procedimiento de acuerdo con una de las reivindicaciones 9-11, caracterizado porque se expresan dos polipéptidos independientes con ayuda de un vector bicistrónico, conteniendo uno de los polipéptidos el dominio de centro N y el otro polipéptido el dominio de centro C y fusionándose la secuencia proteica heteróloga con el extremo C del dominio de centro N o con el extremo N del dominio de centro C.
14. Fármaco que presenta partículas de tipo cápside, caracterizado porque estas partículas presentan un sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 8.
15. Fármaco de acuerdo con la reivindicación 14, caracterizado porque se trata de una vacuna.
16. Medio de diagnóstico que presenta partículas de tipo cápside, caracterizado porque estas partículas presentan un sistema de vehículo de centro escindido de acuerdo con una de las reivindicaciones 1 a 8.
Fig. 1: Representación esquemática de la estructura de proteína de centro Fig. 2: Principio del sistema de centro escindido Fig. 3 Representación esquemática de dos realizaciones de vectores de expresión bacterianos para una producción aproximadamente equimolar de los dos fragmentos de centro N y centroC
Cinética de la inducción de anticuerpos específicos para OspA
Anticuerpos totales anti-OspA frente a equivalentes de LA2
Figura 4
Fig. 5: Principio de la inducción selectiva específicamente a región de anticuerpos frente a una proteína extraña en el sistema de centro escindido Fig. 6: Fusión de centro escindido con molécula extraña con capacidad de interacción expuesta de forma flexible Fig. 7: Principio de las CLP de centro escindido autofluorescentes que presentan sobre su superficie una molécula extraña con capacidad de interacción, en el presente documento, GB1
Artritis, día 52 Protegido contra infección Grupo de ratones inmunizados pasivamente con marcada débil LA-2, 5 g 1/6 1/6 4/6 LA-2, 1 g 2/6 3/6 1/6 LipOspA, 5 g 0/6 1/6 5/6 LipOspA, 1 g 1/6 0/6 5/6 OspA-centro escindido en centroN, 5 g de anticuerpos equivalentes de LA-2 0/6 0/6 6/6 OspA-centro escindido en centroN, 1 g de anticuerpos equivalentes de LA-2 0/6 0/6 6/6 OspA-centro escindido en centroC, vol. equiv. a 5 g de equiv. de LA-2 con Ospa en centroN 2/6 0/6 4/6 OspA-centro escindido en centroC, vol. equiv. a 1 g de equiv. de LA-2 con Ospa en centroN 3/6 2/6 1/6 Suero de ratón normal 3/3 0/3 0/3Figura 8: potencial protector de diferentes sueros inmunes anti-OspA con respecto a la exposición de ratones SCID a B. burgdorferi
Inmunógeno Semana (pr = postrefuerzo) CSP rec NANP NVDP HBc rec. Péptido CSP12 Péptido CSP8 HBc149 CSPrepetición cont. s8 No det. 1, 25 x 105 5x103 6, 25 x 105 No det. No det. s6pr 3x106 3x106 6, 25 x 105 3x105 0 0 Centro escindid.14. CSP corta s8 No det. 1, 25 x 105 5, 0 x 103 1, 25 x 105 No det. No det. s6pr 3x106 3x106 6, 25 x 105 1, 25 x 105 2, 5 x 104 0 Centro escindid.
14. CSP de longitud completa s8 No det. 1, 25 x 105 2, 5 x 104 2, 5 x 104 No det. No det. s6pr 12 x 106 3x106 6, 25 x 105 1, 25 x 105 2x102 2, 5 x 104
Fig. 9: respuestas de linfocitos B frente a CSP y vehículo de centro después de una o dos inmunizaciones de ratones B10 con los inmunógenos indicados
Patentes similares o relacionadas:
Lipopéptidos para su uso en el tratamiento de enfermedades hepáticas y enfermedades cardiovasculares, del 23 de Octubre de 2019, de Ruprecht-Karls-Universität Heidelberg: Compuesto basado en lipopéptidos para su uso en la prevención y/o tratamiento de una enfermedad o afección hepática, en el que el compuesto basado en lipopéptidos […]
Proteínas de fusión transportadoras de péptido como vacunas para alergias, del 23 de Enero de 2019, de BIOMAY AG: Polipéptido capaz de generar respuestas de IgG contra al menos un alérgeno de tipo silvestre y capaz de inducir la producción de IL-10 e IFN-gamma, […]
Vacunación tumoral que involucra una respuesta inmunitaria contra la proteína propia CLDN18.2, del 9 de Mayo de 2018, de Biontech Protein Therapeutics GmbH: Una proteína que comprende la secuencia de aminoácidos expuesta en la sec. con núm. de ident.: 37.
Vacuna de ADN, del 4 de Abril de 2018, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno de la nucleocápsida del virus de la hepatitis B quimérico insertado con una secuencia de aminoácidos que comprende […]
Composiciones inmunoterapéuticas para el tratamiento o prevención de infección por virus de hepatitis delta, del 21 de Marzo de 2018, de GLOBEIMMUNE, INC: Una composición inmunoterapéutica que comprende: a) un vehículo de levadura; y b) una proteína de fusión que comprende antígenos de VHD, en la que el antígeno […]
Método de diagnóstico para trastornos relacionados con el daño cerebral basado en la detección de NDKA, del 8 de Noviembre de 2017, de ELECTROPHORETICS LIMITED: Un método de diagnóstico de un trastorno relacionado con el daño cerebral seleccionado de traumatismo craneoencefálico, ictus isquémico, ictus hemorrágico, […]
Método de diagnóstico para trastornos relacionados con el daño cerebral, del 8 de Noviembre de 2017, de ELECTROPHORETICS LIMITED: Un método de diagnóstico de un trastorno relacionado con el daño cerebral seleccionado de traumatismo craneal, ictus isquémico, ictus hemorrágico, hemorragia […]
Método de diagnóstico para trastornos relacionados con el daño cerebral basado en la detección de DJ-1, del 8 de Noviembre de 2017, de ELECTROPHORETICS LIMITED: Un método de diagnóstico de un trastorno relacionado con el daño cerebral seleccionado de traumatismo craneoencefálico, ictus isquémico, ictus hemorrágico, hemorragia […]